Neues zur Herzinsuffizienz vom ESC-Kongress
Der Jahreskongress der European Society of Cardiology (ESC) fand von 26. bis 29. August 2022 als Hybridveranstaltung in Barcelona und online statt. Gewohntermaßen war das Spektrum hochqualitativer Wissenschaft breit – der Bogen spannte sich von kardiovaskulärer Grundlagenforschung bis zu klinischer Praxis. Dies galt insbesondere auch für den Schwerpunktbereich Herzinsuffizienz, wo auch heuer wieder neue Studiendaten mit Potenzial für signifikanten Einfluss auf das Therapie-Management herzinsuffizienter Patient:innen präsentiert und diskutiert wurden.
Auf einige Highlights soll hier im Speziellen eingegangen werden: diuretische Therapie in der akuten Herzinsuffizienz (ADVOR1), Therapiesicherheit und Wirkung medikamentöser Therapieansätze in der chronischen Herzinsuffizienz mit einer LVEF > 40 % (PERSPECTIVE, DELIVER2) sowie Revaskularisierung und medikamentöse Sekundärprophylaxe in der ischämischen Kardiomyopathie (REVIVE3, EMMY4).
Akute Herzinsuffizienz: erfolgreiche Rekompensation durch dualen Ansatz
In der chronischen Herzinsuffizienz sind wir mit der Herausforderung rezidivierender akuter Dekompensationen konfrontiert. Zeichen jeglicher Volumenüberladung sind Ausdruck der Krankheitsprogression und beeinflussen Hospitalisierungsrate und Outcome unserer Patient:innen negativ. Die Euvolämie stellt folglich das Therapieziel im Volumenmanagement in der stabilen chronischen Phase, aber insbesondere in der akute Dekompensation dar.5 Hier ist eine residuale Hypervolämie mit einem 1-Jahres-Rehospitalisierungsrisiko von bis zu 60 % assoziiert.
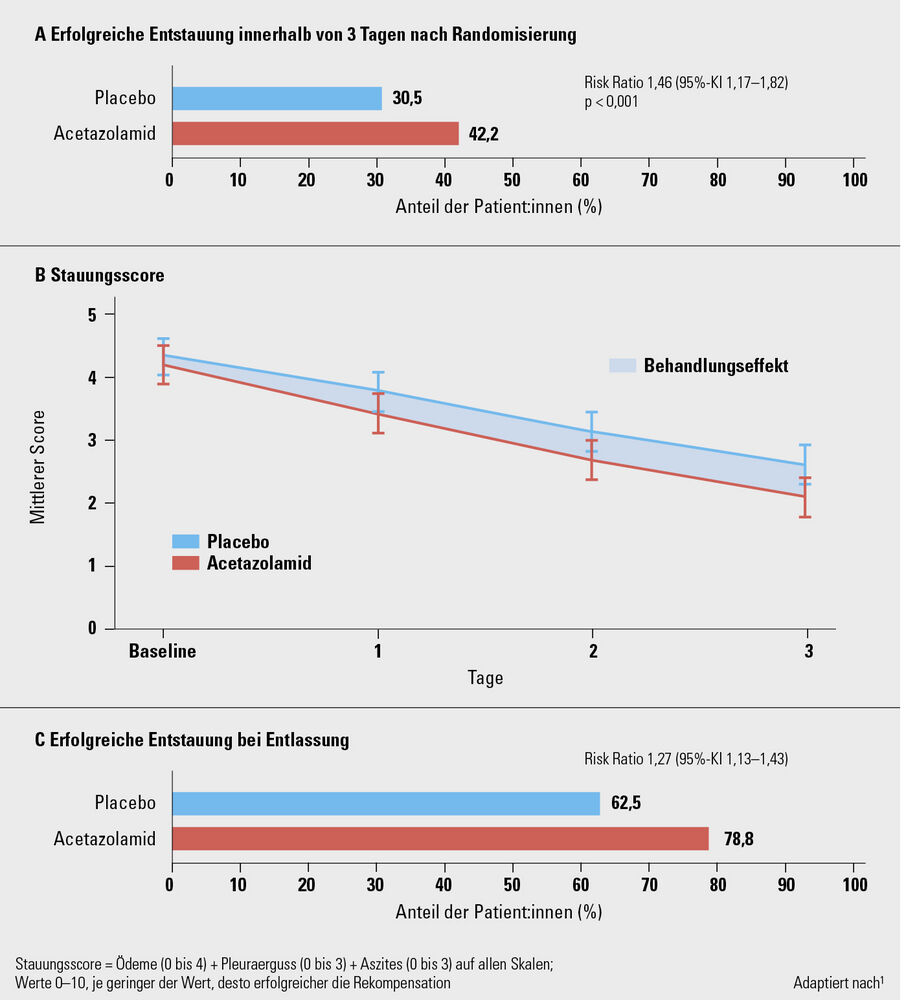
Schleifendiuretika sind mit einer Klasse-I-Empfehlung das etablierte Entwässerungsmittel der Wahl für alle Herzinsuffizienz-Phänotypen (HFrEF, HFmrEF, HFpEF). Die Hypothese der ADVOR-Studie (Acetazolamide in Acute Decompensated Heart Failure with Volume Overload)1 ist eine Wirkungsverstärkung der Schleifendiuretika durch die kombinierte Gabe von Acetazolamid, einem Carboanhydrasehemmer, der die Natrium- und Bikarbonat-Resorption im proximalen Nierentubulus hemmt und folglich die Natriurese verstärkt.
Die Studie randomisierte 519 akut dekompensierte Patient:innen mit chronischer Herzinsuffizienz zu i. v. Schleifendiuretikum + Acetazolamid (500 mg) versus i. v. Schleifendiuretikum + Placebo. Der primäre Endpunkt, die erfolgreiche Rekompensation an Tag 3 nach Randomisierung, wurde mit 44,2 % versus 30,5 % erreicht (p < 0,001). Dies entspricht einem relativen Risiko (RR) von 1,46 (p = 0,0009) und einer Number needed to treat (NNT) von 8,5. Zum Zeitpunkt der Entlassung waren 78,8 % versus 62,5 % der Patient:innen frei von Stauungszeichen (p = 0,0001; NNT = 6) (Abb. 1). Auch die Hospitalisierungsdauer war im Verumarm kürzer (8,8 vs. 9,9 Tage, p = 0,016), ohne signifikanten Unterschied in der Nebenwirkungsrate zwischen den beiden Studiengruppen. Keinen signifikanten Benefit gab es hinsichtlich Gesamtmortalität oder Rehospitalisierungsrate im Kurzzeitverlauf (3 Monate).
Limitationen der Studie sind die relativ kleine Zahl der Studienteilnehmer:innen, die ausschließliche Beteiligung belgischer Zentren, was die Verallgemeinerung der Studienergebnisse einschränken könnte, sowie die Exklusion der gleichzeitigen Therapie mit SGLT2-Hemmern. SGLT2-Hemmer sind Teil der aktuellen leitliniengerechten Therapieempfehlung und zeigen ebenfalls diuretische Wirkung auf Ebene des proximalen Nierentubulus. Die Wirkung von Acetazolamid in Verbindung mit SGLT2-Hemmern ist aktuell unbekannt und muss weiter untersucht werden.
Neprilysin-Hemmung: positiver Effekt auf Herzleistung, keine Beeinträchtigung der ZNS-Leistung
Sacubitril/Valsartan (Angiotensin-Rezeptor-Neprilysin-Inhibitor [ARNI]) reduziert Hospitalisierungsrate und Mortalität bei Patient:innen mit Herzinsuffizienz mit reduzierter Ejektionsfraktion (HFrEF) und ist signifikanter Bestandteil der medikamentösen Therapie.5, 6 Der durch die Hemmung der Endopeptidase vermittelte Wirkmechanismus bei Herzinsuffizienz ist mehrdimensional und nicht gänzlich verstanden. Als eines von mehreren Enzymen ist Neprilysin jedoch auch am proteolytischen Abbau von Amyloid-β-Peptiden, die mit der Alzheimer-Demenz in Verbindung gebracht werden, beteiligt. Aufgrund bis dato fehlender spezifischer Langzeitdaten konnte nicht ausgeschlossen werden, dass die langfristige Neprilysin-Hemmung mit Sacubitril zu zerebraler Amyloid-Akkumulation und folglich kognitiver Beeinträchtigung führen könnte.
Die prospektiv randomisierte, multizentrische PERSPECTIVE-Studie (Sacubitril/valsartan and cognitive function in HFmrEF and HFpEF) untersuchte die Auswirkungen der Therapie mit Sacubitril/Valsartan vs. Valsartan-Monotherapie hinsichtlich kognitiver Funktionseinschränkung, ermittelt durch serielle neuropsychologische Testung (GCCS) und PET-Bildgebung, bei Herzinsuffizienzpatient:innen (n = 592) mit leicht eingeschränkter oder erhaltener LVEF (> 40 %).
Die Beobachtungsphase betrug 3 Jahre und zeigte keine stärkere Einschränkung der kognitiven Leistung im Studienarm. Der Nachweis, dass die Neprilysin-Hemmung das zentrale Nervensystem bei Patient:innen mit HFmrEF und HFpEF nicht negativ beeinflusst, ist wichtig, um diesbezügliche Bedenken gegenüber einer Langzeitbehandlung mit Sacubitril/Valsartan zu widerlegen.
Klasseneffekt der SGLT2-Inhibitoren im gesamten Spektrum der Herzinsuffizienz
Initial konnte für die SGLT2-Hemmer Dapagliflozin7 und Empagliflozin8 eine überzeugende Hospitalisierungs- und Mortalitätsreduktion bei Patient:innen mit stabiler HFrEF (LVEF ≤ 40 %) gezeigt werden. EMPEROR-Preserved9 untersuchte den Einsatz von Empagliflozin bei HFmrEF und HFpEF (LVEF > 40 %) und zeigte auch für diese Patient:innen eine signifikante Reduktion des kombinierten Endpunktes Hospitalisierung oder Tod.
Die Ergebnisse der DELIVER-Studie (Dapagliflozin in Heart Failure with Mildly Reduced and Preserved Ejection Fraction)2, die mit vergleichbarem Studienaufbau als randomisierte, placebokontrollierte Multicenterstudie den Einsatz von Dapagliflozin bei symptomatischen Patient:innen (n = 6.236) mit HFmrEF und HFpEF (NYHA-Stadium II–IV, LVEF > 40%) untersuchte, wurden am diesjährigen ESC-Kongress präsentiert. Die mediane Follow-up-Zeit betrug 2,3 Jahre. Dapagliflozin reduzierte den primären kombinierten Endpunkt, kardiovaskulärer Tod oder Verschlechterung der Herzinsuffizienz, um 18 % (p < 0,001). Sekundäre Endpunkte wie unter anderem die Verbesserung der Lebensqualität (mittlerer Unterschied im KCCQ-Score 2,4; 95%-KI 1,6–3,2) wurden ebenfalls erreicht.
Neben EMPEROR-Preserved ist DELIVER die zweite Landmarkstudie, die Evidenz zur Implementierung von SGLT2-Hemmern zur Behandlung von symptomatischenHerzinsuffizienzpatient:innen mit einer LVEF > 40 % bietet.
Die Daten wurden in präspezifizierten Analysen weiter aufgearbeitet. So konnte beispielsweise in einer gepoolten Analyse10 der Patientendaten aus den Studien DAPA-HF (LVEF ≤ 40 %) und DELIVER (LVEF > 40 %) (n = 11.007) die Stichhaltigkeit der Risikoreduktion für kardiovaskulären Tod (HR 0,86; p= 0,01), Gesamtmortalität (HR 0,90; p = 0,03), oder Herzinsuffizienzhospitalisierung (HR 0,71; p < 0,001) mit Dapagliflozin für das breite Spektrum von Patient:innen mit Herzinsuffizienz, unabhängig von der LVEF, gezeigt werden.10
Den Klasseneffekt der SGLT2-Hemmer in der Herzinsuffizienz mit erhaltener oder leicht reduzierter Auswurffraktion (LVEF > 40 %) unterstrich eine weitere gepoolte Analyse der DELIVER-(Dapagliflozin-) und der EMPEROR-Preserved-(Empagliflozin-)Studien11 (pooled n = 12.251). Beide Studien zeigten, dass der Einsatz der SGLT2-Hemmer Dapagliflozin bzw. Empagliflozin bei Patient:innen mit Herzinsuffizienz und einer LVEF > 40 % die Zahl kombinierter kardiovaskulärer Ereignisse signifikant senkt. Nicht endgültig geklärt ist jedoch der Therapiebenefit hinsichtlich Sterblichkeit sowie weiterer Subgruppenanalysen mit unzureichender Power der jeweiligen Studien allein.
Bei einer medianer Follow-up-Zeit von 2,2–2,3 Jahren verringerte der SGLT2-Hemmer auch in der Metaanalyse das Risiko des kombinierten Endpunktes kardiovaskuläre Mortalität oder Herzinsuffizienzhospitalisierung um 20 % (p < 0,001), der Herzinsuffizienzhospitalisierungen um 26 % (p < 0,001) und nummerisch des kardiovaskulären Todes (HR 0,88; 95%-KI 0,77–1,00). Es gab keine signifikante Auswirkung auf die Gesamtmortalität. Der signifikante Benefit der Therapie, v. a. hinsichtlich Hospitalisierungsreduktion und symptomatischer Verbesserung, unterstützt den therapeutischen Klasseneffekt der SGLT2-Hemmer und ihren Einsatz als Therapiesäule bei Herzinsuffizienzpatient:innen mit einer LVEF > 40 % (Abb. 2).11
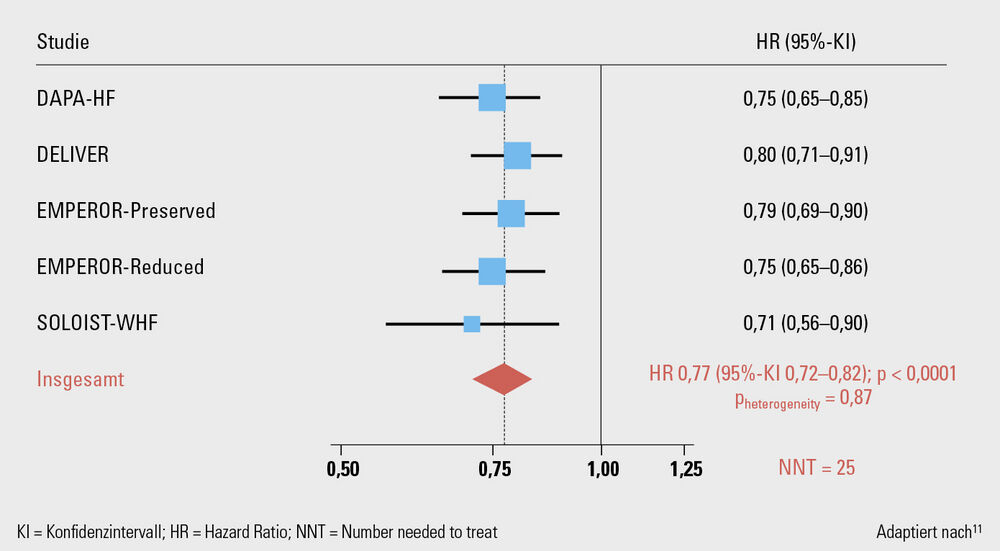
Abb. 2: Metaanalyse der 5 großen randomisierten, placebokontrollierten Landmark Trials. ↓ 23 % (18–28 %) relative Risikoreduktion des primären Endpunktes (CV-Tod oder Herzinsuffizienzhospitalisierung)
Je früher, desto besser? SGLT2-Hemmer als Sekundärprophylaxe nach Herzinfarkt
Auf Basis der positiven Daten zur Wirkung der SGLT2-Hemmer bei stabiler Herzinsuffizienz entstand die EMMY-Studie (Empagliflozin in acute Myocardial Infarction).4 EMMY untersuchte die Sicherheit und Wirksamkeit des SGLT2-Hemmers Empagliflozin bei Patient:innen nach akutem Myokardinfarkt (AMI).
In dieser akademischen, multizentrischen, placebokontrollierten Studie wurden AMI-Patient:innen (n = 476) innerhalb von 72 Stunden nach perkutaner Koronarintervention (PCI) randomisiert. Primärer Endpunkt war die Dynamik von NT-proBNP als prognostischer Surrogatmarker innerhalb der ersten 26 Wochen. Echokardiografische Parameter wurden im Sinne sekundärer Endpunkte analysiert.
Die Initiierung von Empagliflozin kurz nach dem akuten Ereignis ging mit einer signifikant stärkeren Senkung des NT-proBNP nach 26 Wochen einher (95%-KI –4,4 % bis –23,6 %; p = 0,026), begleitet von einer signifikanten Verbesserung der echokardiografischen Funktions- und Strukturparameter LVEF (absolut: 1,5 %; p = 0,029), mittlere E/e’-Reduktion (6,8 %; p = 0,015), sowie Reduktion des LV-endsystolischen und -enddiastolischen Volumens (7,5 ml; p = 0,0003 bzw. 9,7 ml; p = 0,0015) in der Empagliflozin-Therapiegruppe. Keine Differenz gab es hinsichtlich der Herzinsuffizienz-Rehospitalisierungsrate oder im Nebenwirkungsprofil.
Bei EMMY handelt es sich um eine vergleichsweise kleine Studie ohne klinische Endpunkte. Die Daten geben einen vielversprechenden ersten Einblick in den Einsatz von Empagliflozin bei Herzinfarkt. Endgültigere Resultate werden die DAPA-MI- (NCT04564742) und die EMPACT-MI-Studie (NCT04509674) bringen.
Ischämische HFrEF: #Optimal Medical Therapy works!
REVIVED-BCIS2 (Percutaneous Revascularization for Ischemic Left Ventricular Dysfunction)3 untersuchte den Benefit der PCI im Vergleich zur optimalen medizinischen Therapie (OMT) bei Patient:innen mit ischämischer Herzinsuffizienz mit hochgradig eingeschränkter systolischer LV-Funktion (LVEF ≤ 35 %) und schwerer koronarer Herzkrankheit (KHK). 700 Patient:innen wurden prospektiv randomisiert. Nach einer medianen Beobachtungszeit von 41 Monaten zeigte sich die Mehrgefäß-PCI dem nichtinvasiven Therapieapproach im primären kombinierten Endpunkt Gesamtmortalität oder Herzinsuffizienzhospitalisierung nicht überlegen (Eventrate: 37,2% versus 38,0 %; p = 0,96). Ebenfalls keinen signifikanten Unterschied gab es in den wichtigen sekundären Endpunkten Verbesserung der LVEF und Lebensqualität.
Obwohl die Studienergebnisse den Schluss nahelegen, dass die PCI bei Patient:innen mit stabiler KHK und HFrEF keinen zusätzlichen Nutzen gegenüber der OMT bietet, sollten bei der Ergebnisinterpretation unter anderem folgende Aspekte mitberücksichtigt werden:
- Vergleichsweise kurze Follow-up-Zeit: In der STICH-Studie12 (Randomisierung Bypass-OP vs. OMT) wurde erst im Langzeitverlauf (5–10 Jahre) ein Rückgang der (kardiovaskulären) Mortalität durch die Revaskularisierung beobachtet.
- Numerischer Rückgang akuter koronarer Ereignisse (Myokardinfarkte, ungeplanter Revaskularisationen) im Revaskularisationsarm.
- Potenzieller Selektionsbias: Patient:innen, die potenziell von einer Revaskularisierung profitieren könnten, wurden möglicherweise bereits vor Randomisierung einer Bypass-Operation zugeführt.
Subanalysen werden hier mögliche weiter phänotypisierende Erkenntnis liefern.