Die Rolle der Niere im Glukosestoffwechsel
Leber und Niere spielen eine zentrale Rolle in der Blutzuckerregulation, da sie Glukose sowohl aus Vorläufern wie Glutamin, Alanin, Laktat und Glyzerol synthetisieren („Glukoneogenese“) sowie Glukose in Form von Glykogen speichern, aber auch Glukose in den Kreislauf abgeben können („endogene Glukoseproduktion“). So kann Glukose sowohl aus der Zirkulation entfernt als auch (unter Nüchternbedingungen) zur Verfügung gestellt werden (Consoli, Diabetes Care 1992; Stingl, Dissertation an der Medizinischen Universität Wien 2000).
Der Anteil der Glukoneogenese an der endogenen Glukoseproduktion beträgt unter Nüchternbedingungen ca. zwischen 50 und 70 % (Stingl et al., Diabetologia 2001) und steigt nach längerem Fasten auf nahezu 100 % an (Kunert et al., Diabetes 2003, Landau et al., Am J Physiol 1995). Der letzte Schritt der Glukosefreisetzung (von Glukose-6-Phosphat zu Glukose) wird durch die Glukose-6-Phosphatase katalysiert. Dieses Enzym ist in Leber und Niere vorhanden, fehlt aber im Skelettmuskel. Die Muskulatur kann daher aus ihrem Glykogenvorrat keine Glukose an das Blut abgeben.
Die Rolle der Niere bei Nichtdiabetikern
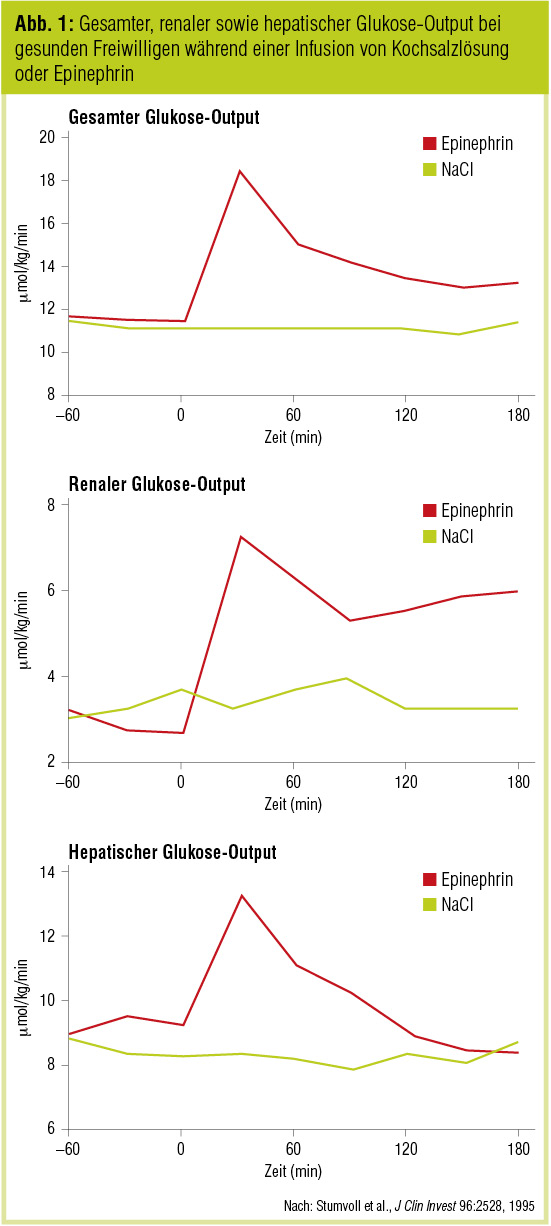
Da der Glykogengehalt der Niere verglichen mit jenem der Leber gering ist (Petersen et al., Am J Physiol 1999), wurde die Rolle der Niere im Glukosestoffwechsel lange unterschätzt. In den 1990er-Jahren konnte jedoch durch die Anwendung von Tracer-Techniken gezeigt werden, dass der Anteil der Niere an der Glukoseproduktion und an der Glykogensynthese deutlich höher (bis zu 25 %) ist, da diese simultan ablaufen (Stumvoll et al., J Clin Invest 1995). In dieser Studie konnte dieser renale Anteil zusätzlich durch die Infusion von Epinephrin auf das Doppelte gesteigert werden (Abb. 1). Die dabei erreichten Katecholaminkonzentrationen im Plasma entsprachen dem physiologischen Anstieg während einer Hypoglykämie. Die klinisch beobachtete katecholamingetriggerte reaktive Hyperglykämie nach einer Hypoglykämie könnte somit zu einem wesentlichen Teil durch die renale endogene Glukoseproduktion zu erklären sein.
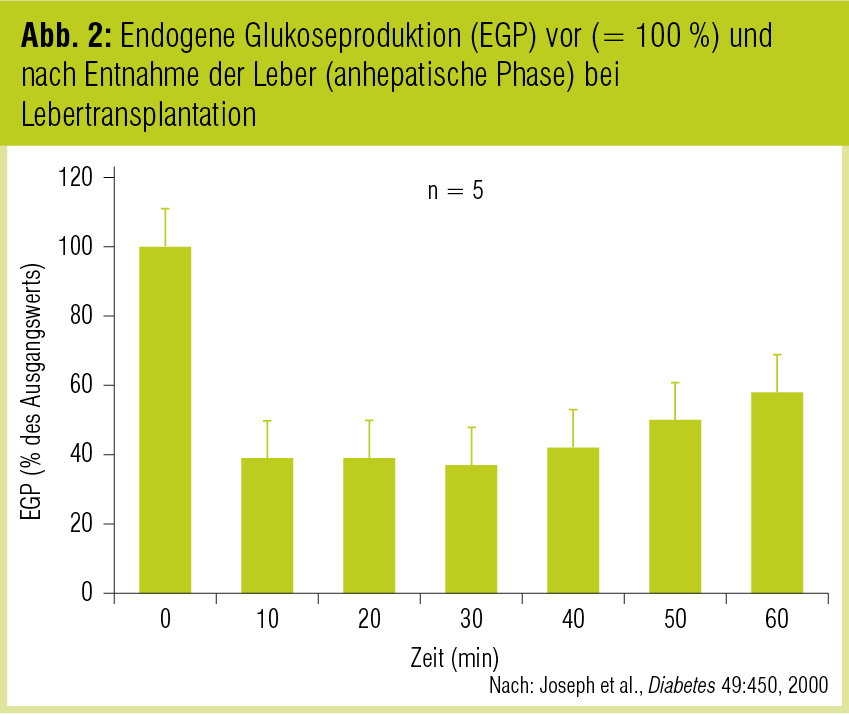
Die bedeutende Rolle der Niere zur Aufrechterhaltung der Glukosehomöostase wurde auch in einer weiteren Arbeit gezeigt, in der die renale Glukoseproduktion während der anhepatischen Phase bei Lebertransplantationen gemessen wurde (Joseph et al., Diabetes 2000). Unter diesen Bedingungen sank die Glukoseproduktion direkt nach Entnahme der Leber auf rund 36 %, stieg jedoch innerhalb einer Stunde auf rund 54 % des Ausgangswertes an (Abb. 2). Wenn auch theoretisch andere „Organe“ (z. B. extrahepatisches splanchnisches Gewebe) zur Glukoseproduktion nach Entnahme der Leber beitragen könnten, so ist doch – zieht man die Kenntnisse über die enzymatische Ausstattung der Gewebe in Betracht (siehe oben) – die Niere der wichtigste „Kandidat“ für die beobachtete partielle Aufrechterhaltung der Glukoseproduktion. Es dürften vor allem die Zellen des proximalen Tubulus sein, welche ein enormes Potenzial zur raschen Steigerung der Glukoneogenese haben. Interessanterweise wurde in dieser Studie ein Anstieg der Katecholamine auf das Doppelte der Ausgangskonzentrationen nach Entnahme der Leber beobachtet, gut vergleichbar mit den Konzentrationen, die nach einer Hypoglykämie erreicht werden. Dieser Anstieg könnte somit auch in diesem Fall der entscheidende Stimulus für die Steigerung der endogenen Glukoseproduktion durch die Niere sein. Zusätzlich kam es zu einem deutlichen Anstieg von glukoneogenetischen Präkursoren, insbesondere Laktat und Glyzerol. Diese gelten als wichtigste Substrate der renalen Glukoneogenese (Cersosimo et al., Diabetes 1998).
Der renale Glukosestoffwechsel bei Diabetes mellitus Typ 2
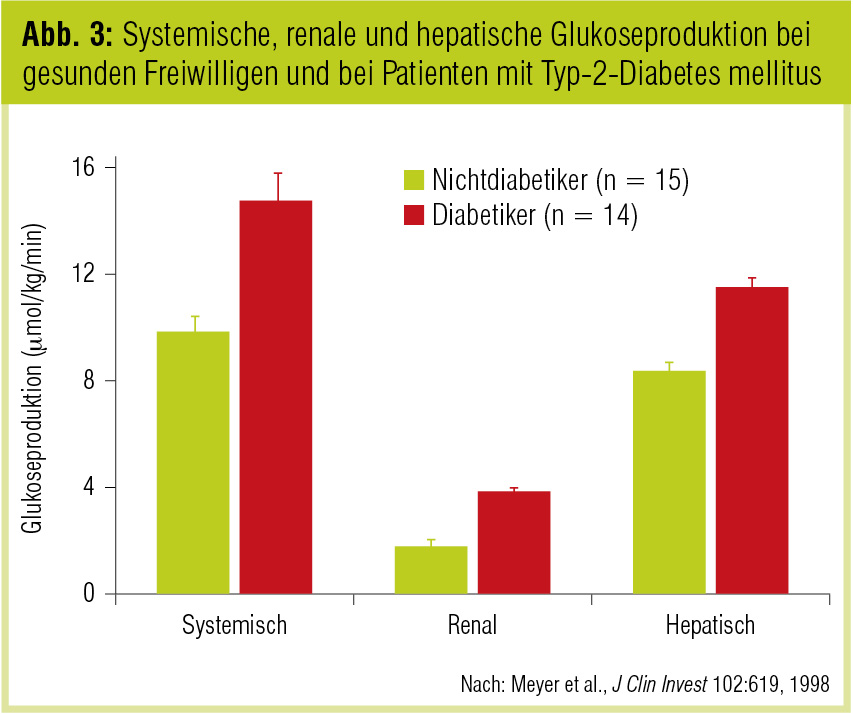
Wissend um die physiologische Rolle der Niere im Glukosestoffwechsel konnte schließlich auch bei Typ-2-Diabetikern gezeigt werden, dass unter Nüchternbedingungen bei erhöhtem Blutzucker die erhöhte endogene Glukoseproduktion zu ungefähr gleichen Teilen durch Leber und Niere bedingt ist (Meyer et al., J Clin Invest 1998; Abb. 3).
Unter postprandialen Bedingungen wird bei Typ-2-Diabetikern die endogene Glukoseproduktion durch Insulin nur insuffizient supprimiert und trägt so zur postprandialen Hyperglykämie bei. Es konnte gezeigt werden, dass unter diesen Bedingungen bis zu 40 % der erhöhten Glukoseproduktion durch die renale Glukoseabgabe bedingt sind (Meyer et al., Am J Physiol Endocrinol Metab 2004). Gleichzeitig speichert die Niere aber postprandial auch mehr Glykogen als bei Nichtdiabetikern. Dies dürfte den erhöhten renalen Glykogengehalt der Niere bei Diabetes mellitus Typ 2 erklären und könnte zur Entwicklung der diabetischen Nephropathie beitragen.
Niere und Hypoglykämie
Bei bereits eingeschränkter Nierenfunktion könnte die Möglichkeit der Niere, einer Hypoglykämie entgegenzuwirken, eingeschränkt sein. In der täglichen klinischen Arbeit beobachten wir häufig Hypoglykämien bei Patienten mit chronischer Niereninsuffizienz, welche häufig, aber nicht immer, durch entsprechende insulinotrope Medikation erklärbar sind. Bereits in den 1970er-Jahren wurde in Fallberichten von Hypoglykämien bei Niereninsuffizienz ohne entsprechende Medikation, teils sogar bei Nichtdiabetikern, berichtet (Block & Rubenstein, JAMA 1970; White & Kurtzman, JAMA 1971). Auch in einer retrospektiven Kohortenanalyse mit über 240.000 Patienten zeigte sich die Niereninsuffizienz als unabhängiger Risikofaktor für schwere Hypoglykämien, selbst wenn kein Diabetes vorlag (Moen et al., Clin J Am Soc Nephrol 2009). In dieser Studie war die Eintagesmortalität nach einer schweren Hypoglykämie bis auf das 10-Fache erhöht.
Die Ursachen für diese Hypoglykämieneigung könnten einerseits in der verminderten Clearance von Insulin oder antidiabetischen Medikamenten zu finden sein, andererseits durch die verminderte Fähigkeit des (geschädigten) proximalen Tubulus zur Steigerung der endogenen Glukoseproduktion. Bei wiederholten Hypoglykämien ist zudem der reaktive Katecholaminanstieg reduziert. Zusätzlich ist die katabole (Protein-)Stoffwechsellage bei fortgeschrittener Niereninsuffizienz zu bedenken.
Therapeutische Nutzung von Glukosefiltration und -reabsorption
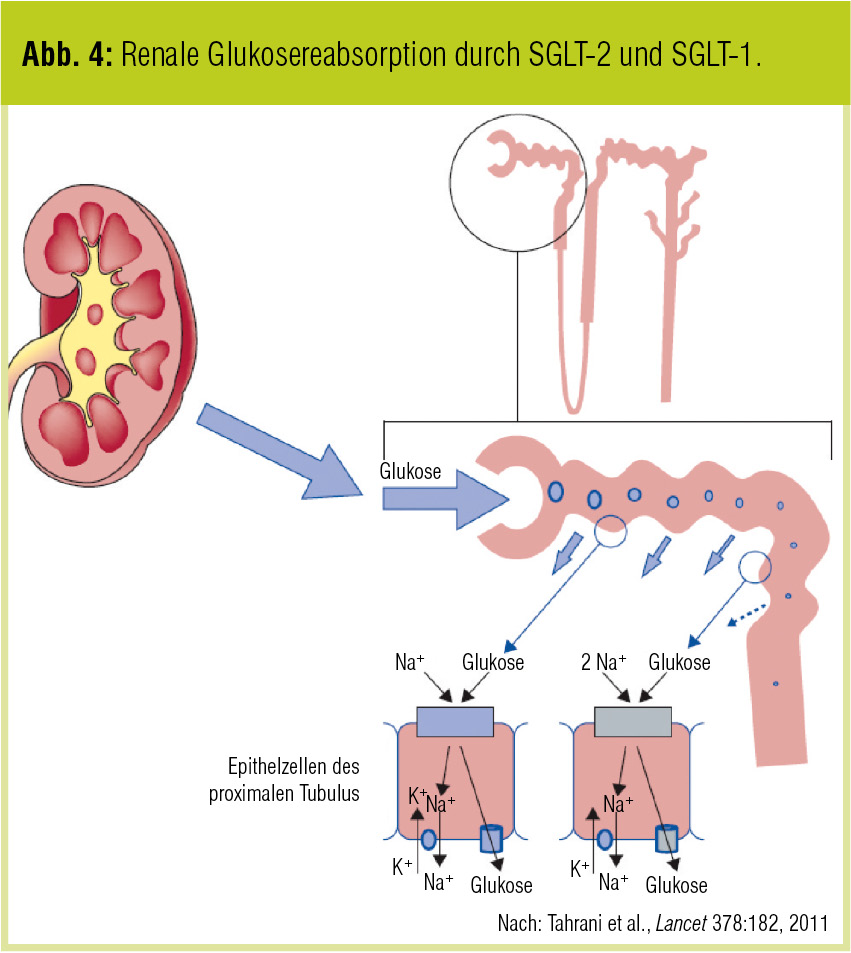
Täglich werden ca. 180 Liter Plasma glomerulär filtriert. Bei einer durchschnittlichen Blutzuckerkonzentration von 100 mg/dl entspricht dies rund 180 g Glukose, die im Tubulussystem rückabsorbiert werden. Dies findet großteils über den Sodium-Glukose-Cotransporter 2 (SGLT-2) im proximalen Tubulus und zum geringeren Anteil über den SGLT-1 statt (Tahrani et al., Lancet 2011; Abb. 4). Es gibt Hinweise, dass eine „Up-Regulation“ von SGLT-2 eine der wesentlichen Ursachen für die erhöhte renale Glukoserückresoption und Glukoseproduktion bei Diabetikern ist.
Die neue Substanzklasse der SGLT-2-Inhibitoren, die voraussichtlich in Kürze zur Verfügung stehen wird, wurde daher entwickelt, um SGLT-2 selektiv zu hemmen. SGLT-2-Inhibitoren induzieren ausreichend Glukosurie, um die Glukosekonzentrationen im Plasma deutlich zu senken. Als erster Vertreter der Substanzklasse steht Dapagliflozin kurz vor der Zulassung. Neben einer HbA1c-Senkung von bis zu 1 Prozentpunkt kommt es (im Gegensatz zu vielen anderen Therapien) auch zu einer Gewichtsabnahme (in Studien bis zu 4 kg), die einerseits durch den Energieverlust im Rahmen der Glukosurie, andererseits durch eine gewisse diuretische Wirkung zu erklären sein dürfte. Auch eine milde Blutdrucksenkung wurde beobachtet.
Die SGLT-2 Hemmung ist insulinunabhängig und wird bei niedrigen Glukosekonzentrationen durch die nachfolgende Reabsorption mittels SGLT-1 (ein Transporter mit hoher Glukoseaffinität) ausgeglichen. Auf diese Weise ist selbst bei niedrigen Glukosekonzentrationen die Hypoglykämiegefahr niedrig. Als Nebenwirkung treten etwas mehr urogenitale Infektionen auf. Diese dürften durch die Glukosurie als Nährboden für Keime bedingt sein, verlaufen jedoch typischerweise mild und sind gut behandelbar. Interessant erscheint die Möglichkeit, die SGLT-2-Inhibitoren neben oralen Antidiabetika auch mit Insulin zu kombinieren, wodurch eine Reduktion der benötigten Insulindosis erreicht werden kann.
Resümee
Die Rolle der Niere im Glukosestoffwechsel wurde lange unterschätzt, das Organ wurde lediglich als Zielorgan der diabetischen Spätschäden gesehen. Die Niere trägt jedoch sowohl physiologisch als auch pathophysiologisch bei Diabetes mellitus wesentlich zur Blutzuckerregulation, Entstehung von Hyperglykämien, aber auch Hypoglykämien bei und wird in Zukunft auch ein wichtiges „Erfolgsorgan“ der antidiabetischen Therapie darstellen.