Insulinresistenz und Insulinbedarf mit zunehmender Nierenschädigung
Bei gesunden Menschen spielen die Nieren die wichtigste Rolle beim Insulinmetabolismus (Mak & DeFronzo, Nephron 1992). Insulin hat ein Molekulargewicht von 6.000 und wird daher frei filtriert. Von der gesamten Insulinclearance werden ungefähr 60 % durch glomeruläre Filtration und 40 % durch Extraktion aus den peripheren peritubulären Gefäßen ausgeschieden. Das Insulin im Tubuluslumen gelangt mittels durch Carrier gesteigerte Endozytose in proximale Tubuluszellen und wird dann in Lysosomen zu Aminosäuren metabolisiert (Rabkin et al., Am J Physiol 1972). Letztendlich wird weniger als 1 % des gefilterten Insulins mit dem Harn ausgeschieden.
Die renale Insulinclearance beträgt 200 ml/min und ist damit wesentlich höher als die normale, durch die tubuläre Sekretion bedingte glomerulären Filtrationsrate (GFR) von 120 ml/min. Von der renalen Clearance ausgehend kann man kalkulieren, dass täglich 6–10 Einheiten Insulin von den Nieren degradiert werden; dies entspricht ca. 25 % der täglichen Insulinproduktion im Pankreas.
Bei Diabetikern mit exogener Insulinzufuhr ist der renale Metabolismus verstärkt, da das exogene Insulin direkt, ohne vorherige Passage der Leber, in den systemischen Kreislauf gelangt (Hager, Am J Kidney Dis 1989).
Insulinresistenz bei Niereninsuffizienz
Urämie ist oft mit einer gestörten Glukosetoleranz assoziiert. Ein Teil der Patienten mit Urämie zeigt eine Hyperglykämie im Glukosebelastungstest. Viele Patienten können durch Hyperinsulinämie eine Normoglykämie aufrechterhalten. Wenn Insulin und Blutglukose ansteigen, besteht eine Insulinresistenz, die durch Urämie verstärkt wird. Die weitere Folge ist ein Typ-2-Diabetes.
Die Insulinresistenz in Muskulatur und Fettzellen reduziert die Glukoseaufnahme, während die Insulinresistenz in den Leberzellen zu einer reduzierten Glykogensynthese und -speicherung sowie zu einer fehlerhaften Suppression der Glukose im Blut führt. Insulinresistenz bedeutet einen reduzierten blutzuckersenkenden Effekt des Insulins (Abdul-Ghani & DeFronzo, J Biomed Biotechnol 2010). Es können aber auch andere Funktionen des Insulins betroffen sein: Beispielsweise führt eine verminderte Insulinwirkung in Fettzellen zu einer reduzierten Aufnahme von zirkulierenden Lipiden und zu einer verstärkten Hydrolyse der gespeicherten Triglyzeride (Reaven, Diabetes 1988). Eine verstärkte Mobilisation von gespeicherten Lipiden in diesen Zellen erhöht die Konzentration der freien Fettsäuren im Blutplasma. Erhöhte Blutfettkonzentrationen, reduzierte Glukoseaufnahme in die Muskulatur und erhöhte Glukoseproduktion in der Leber tragen allesamt zu den erhöhten Plasmaspiegeln von Blutglukose und Insulin bei. Diese hohen Plasmaspiegel von Glukose und Insulin als Folge der Insulinresistenz sind die Hauptkomponenten des metabolischen Syndroms.
In einer Untersuchung der Gewebesensitivität auf Insulin mittels der euglykämischen Insulin-Clamp-Technik konnten DeFronzo et al. (J Clin Invest 1981) demonstrieren, dass die Zunahme der hepatischen Glukoseproduktion bei Urämie nicht verstärkt wird; die primäre Ursache der Insulinresistenz ist somit eine Abnahme der Gewebesensitivität auf Insulin. Diese Insulinresistenz bei chronischer Nierenerkrankung ist mit hoher Morbidität und Mortalität der Patienten assoziiert.
Ursachen der Insulinresistenz bei Urämie
Diese sind komplex und multifaktoriell. Vor allem zählt dazu das erhöhte Gewicht: Übergewicht ist ein unabhängiger Risikofaktor für eine chronische Nierenerkrankung. Bei der Entstehung der Insulinresistenz können Änderungen in der Degradation und Sekretion von Insulin dazu beitragen. Insulinresistenz und Hyperinsulinämie finden sich schon bei Patienten mit beginnender Nierenerkrankung (Filser et al., Kidney Int 1981). In einer asiatischen Kohortenstudie war Insulinresistenz mit der Prävalenz der chronischen Nierenerkrankung und abnehmender Nierenfunktion assoziiert (Cheng et al., J Clin Endocrinol Metab 2012). Die Assoziation zwischen Übergewicht und Insulinresistenz bei chronischer Urämie unterstützt die Rolle des Fettgewebes und der Adiponectinprofile im Rahmen der Entstehung der Insulinresistenz bei übergewichtigen Patienten mit chronischer Nierenerkrankung. Adiponectinmangel spricht für Insulinresistenz und Glukoseintoleranz (Rabe et al., Mol Med 2008). Hormonelle Störungen, chronische Azidose und systemische Inflammation sowie oxidativer Stress sind relevante mit Urämie assoziierte Ursachen von Insulinresistenz auch bei nicht übergewichtigen Individuen (Guarnieri et al., J Ren Nutr 2009).
Auch Rauchen führt zu verminderter Insulinwirkung und zu Insulinresistenz. Rauchen ist wichtig für die Entwicklung von Insulinresistenzsyndromen, die insbesondere bei Patienten mit chronischer Nierenerkrankung mit einem hohen kardiovaskulären Risiko assoziiert sind (Yki-Järvinen & Westerbacka, Adv Cardiol 2007).
In mehreren Studien wurde demonstriert, dass die Insulinresistenz bei chronischer Urämie mit einer verminderten muskulären Glukoseaufnahme und einem nichtoxidativen Glukosemetabolismus verbunden ist. Dies kann durch eine Hämodialyse verbessert werden (Foss et al., Nephron 1996). Bei Nierenpatienten ohne Diabetes zeigten sich keine signifikanten Unterschiede zwischen kontinuierlicher ambulanter Peritonealdialyse (CAPD) und Hämodialyse (Satirapoj et al., J Med Assoc Thai 2011).
Insulinbedarf
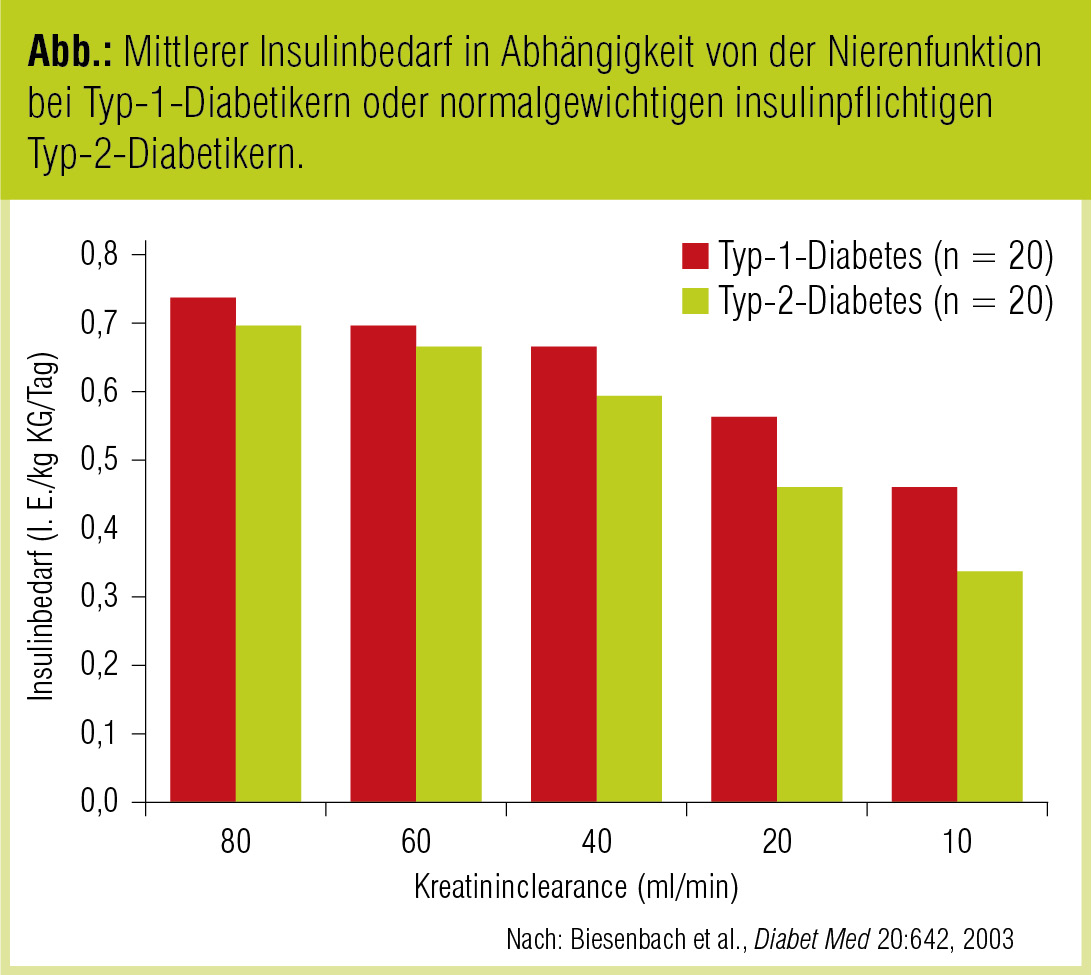
Bei insulinbehandelten Diabetikern mit Nierenfunktionseinschränkung muss die Insulindosis wegen Abnahme der Insulinclearance trotz bestehender Insulinresistenz reduziert werden. Bei Typ-1-Diabetikern ändern sich Insulinclearance und Schweregrad der Insulinresistenz mit dem Auftreten einer Nierenfunktionsstörung. Eine klinisch relevante Reduktion der Insulindosis ist aber erst bei fortgeschrittener Niereninsuffizienz erforderlich. In einer eigenen Studie mit Typ-1- und Typ-2-Diabetikern fand sich kein signifikanter Unterschied in der Abnahme des Insulinbedarfs, allerdings waren die Patienten in der Gruppe der Typ-2-Diabetiker annähernd normalgewichtig und der mittlere Body Mass Index war in beiden Gruppen vergleichbar hoch (Biesenbach et al., Diabet Med 2003; Abb.). Unter Hämodialysetherapie kann eine Reduktion des Insulinbedarfs beobachtet werden. In Studien mit dem „künstlichen Pankreas“ war sowohl der prandiale als auch der basale Teil des Insulinbedarfs inkludiert. Es wurde gezeigt, dass ein Insulinrezeptor oder ein Postrezeptordefekt für die Insulinsensitivität repräsentativ ist (Schmitz et al., Proc Eur Dial Transplant Assoc 1983).
Insulintherapie bei Nierenschädigung
Es gibt bei insulinbehandelten Diabetikern klinisch relevante Aspekte in Relation zu den verschiedenen Stadien der Niereninsuffizienz. So nimmt der Insulinbedarf während der prädialytischen Phase ab, da die Abnahme der renalen Insulinclearance (Akkumulation von Insulin) den Blutglukoseanstieg infolge der Insulinresistenz übertrifft. Unter chronischer Hämodialysetherapie kommt es zu einer Verbesserung der Insulinresistenz und damit zu einer weiteren Abnahme des Insulinbedarfs (Schmitz, Proc Eur Dial Transplant Assoc 1983). Bei den Dialysepatienten besteht somit, insbesondere während der Dialyse mit glukosefreiem Dialysat, ein erhöhtes Hypoglykämierisiko. Bei den Patienten mit CAPD besteht die Möglichkeit, Insulin intraperitoneal (i. p.; im Dialysatbeutel oder über das Schlauchsystem) zuzuführen. Das i. p. Insulinschema scheint der konventionellen subkutanen Insulinsubstitution überlegen zu sein (Almalki et al., Clin Invest Med 2012).
Bei Typ-1-Diabetes ist die funktionelle Insulintherapie (Basis-Bolus-Insulintherapie) die Therapie der Wahl. Insulinanaloga sind bei Patienten mit chronischer Nierenerkrankung von Vorteil (Hasslacher et al., DMW 2007).
Bei insulinpflichtigen Patienten mit Typ-2-Diabetes ist jedes Insulinregime möglich (Tab.). Kombinationen von Insulin und anderen Antidiabetika zur Verbesserung der Insulinresistenz (Glitazone und Inkretintherapeutika) sind auch bei chronischer Nierenerkrankung möglich.
Die PIOren-Studie verglich Pioglitazon versus Placebo bei insulinbehandelten Patienten mit Typ-2-Diabetes (Galle et al., Nephron Extra 2012). Die zusätzliche Gabe von Pioglitazon führte zu einer signifikanten Abnahme des täglichen Insulinbedarfs (–35 % versus –10 % bei Placebo) bei gleichzeitiger HbA1c-Verbesserung.
Inkretintherapeutika (DDP-4-Inhibitoren und GLP-1-Analoga) sind ebenso bei chronischer Nierenerkrankung einsetzbar. Allerdings beträgt die minimal erforderliche Kreatininclearance (CrCl) bei Exenatid (1-mal tgl.) 30 ml/min, bei Exenatid LAR (1-mal wöchentlich) 50 ml/min und bei Liraglutid 60 ml/min.
Für Dialysepatienten sind GLP-1-Analoga nicht zugelassen. Bei Dialysepatienten gibt es unterschiedliche Empfehlungen. Möglich ist die Kombination mit dem Sulfonylharnstoff Gliquidon, der nur zu 5 % renal eliminiert wird; dadurch kann eventuell eine zweite Insulininjektion vermieden werden.