Update Blutdrucktherapie bei Diabetes – 130 bis 135 mmHg systolisch sind für die meisten Patienten optimal
Patienten mit Diabetes haben gegenüber der Normalbevölkerung ein mindestens doppelt so hohes Risiko für kardiovaskuläre Ereignisse (Herzinfarkt, Schlaganfall, periphere arterielle Verschlusskrankheit) und Mortalität. Etwa 70 % versterben an ihrer kardiovaskulären Erkrankung. Ein Teil dieses exzessiven Risikos ist sicher durch den hohen Blutdruck bedingt, der häufig mit der metabolischen Erkrankung einhergeht.
Epidemiologie der Hypertonie bei Diabetes
Beim Typ-1-Diabetes besteht ein klarer kausaler Zusammenhang zwischen Nephropathie und Hypertonie. Der Blutdruck beginnt innerhalb weniger Jahre nach Auftreten der Mikroalbuminurie zu steigen und verschlechtert sich mit Fortschreiten der Nephropathie. Von den Typ-2-Diabetikern sind bereits 40 % bei Diagnosestellung auch ohne Nephropathie hypertensiv. Hier besteht vor allem eine Assoziation mit der Adipositas. Letztendlich kann bei 75 % der Diabetiker eine Hypertonie diagnostiziert werden (Ritz, J Intern Med 1999). Bei Entwicklung einer diabetischen Nephropathie steigt das kardiovaskuläre Risiko weiter deutlich an. Eingeschränkte glomeruläre Filtrationsrate (GFR) und Albuminurie sind dabei unabhängige Risikofaktoren: Jede Halbierung der GFR erhöht das Risiko für kardiovaskuläre Ereignisse um den Faktor 2,2, jede Verzehnfachung der Albuminurie um den Faktor 2,5 (Ninomiya et al., J Am Soc Nephrol 2009).
Pathogenese der Hypertonie bei Diabetes
Neben dem klassischen Faktor diabetische Nephropathie spielen in der Pathogenese auch Hyperinsulinämie, Volumenexpansion und Steifigkeit der arteriellen Gefäße eine Rolle.
Die Hyperinsulinämie als Folge der Insulinresistenz erhöht den Sympathikotonus, stimuliert damit auch das Renin-Angiotensin-Aldosteron-System (RAAS) und führt in der Niere zur Kochsalzretention. Auch die vermehrte Rückresorption von Glukose im proximalen Tubulus erhöht dort die Natriumrückresorption. Die Hyperglykämie führt über nichtenzymatische Glykosylierung und Bildung von AGE (Advanced glycation endproducts) in der Gefäßwand zur Versteifung, welche in der Spätphase durch die Atherosklerose verstärkt wird.
Diskussion um Zielblutdruck bei Diabetikern
Neuere Studienergebnisse haben heftige Kontroversen über den bei Diabetikern anzustrebenden Zielblutdruck entfacht. Außer Zweifel steht, dass jedenfalls eine Absenkung auf unter 140/90 mmHg angebracht ist, da bei höheren Werten das kardiovaskuläre Risiko dramatisch ansteigt (HOT Trial, Hansson et al., Lancet 1998; UKPDS 36, Adler et al., BMJ 2000). Dieser Blutdruckzielwert wird gerade einmal bei ca. 50 % der Patienten erreicht. Erstes und oberstes Ziel der Hochdrucktherapie bei Diabetes muss es daher sein, den Anteil der Patienten mit einem Blutdruck unter 140/90 mmHg zu erhöhen.
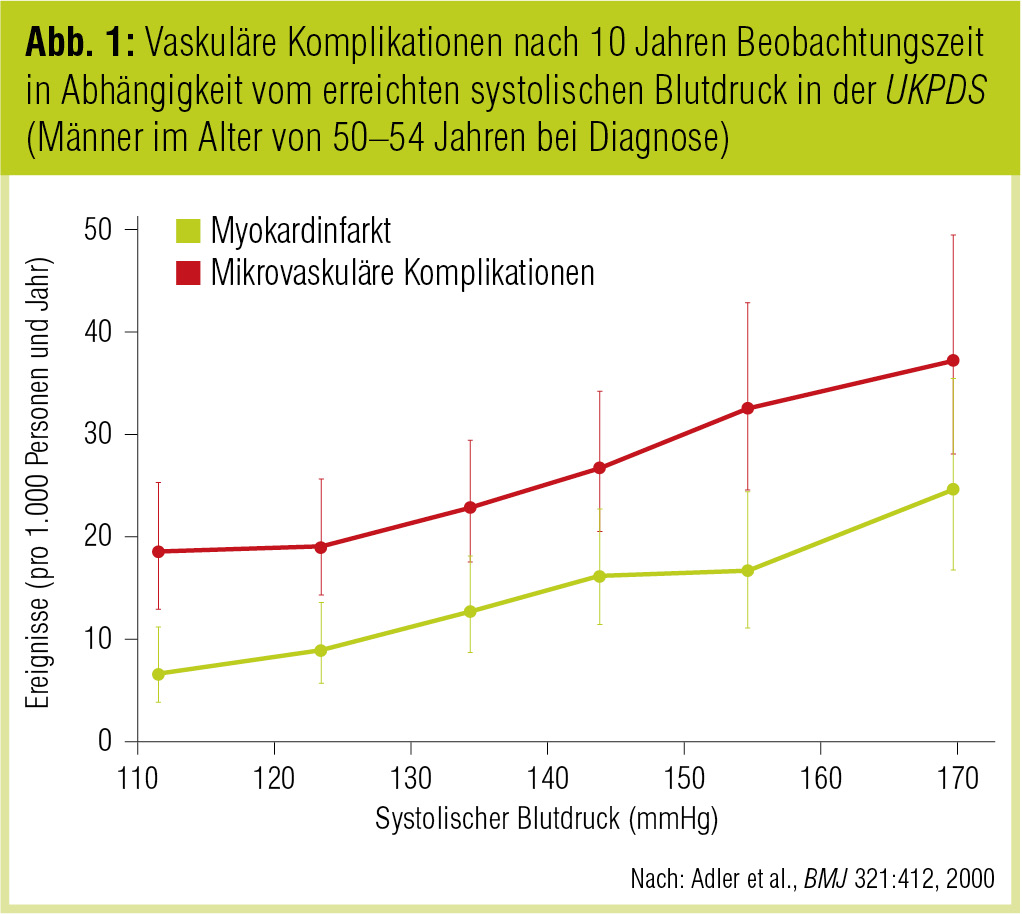
Die Österreichische Diabetes Gesellschaft empfiehlt in ihren noch gültigen „Leitlinien für die Praxis 2009“ einen Zielblutdruck von < 130/80 mmHg, für Patienten mit Nephropathie von < 125/75 mmHg (Schernthaner et al., Wien Klin Wochenschr 2009). Auch im Positionspapier der American Diabetes Association (Diabetes Care 2012) wird angeführt, dass für die meisten Patienten ein Blutdruck unter 130/80 mmHg angebracht sei. Allerdings wird angemerkt, dass für einige Patienten höhere oder niedrigere Werte anzustreben wären. Die relativ strikten Zielwerte basieren vor allem auf den Ergebnissen von UKPDS 36 und HOT (die UKPDS 36 ergab für jede Blutdrucksenkung um 10 mmHg eine Risikoreduktion von 12 % für alle diabetesassoziierten Komplikationen bis zu einem systolischen Blutdruck von 110 mmHg; Abb. 1). Vor allem aufgrund rezenter Studienergebnisse (ACCORD Study Group, New Engl J Med 2010; Cooper-DeHoff et al., JAMA 2010) werden diese Zielwerte von vielen Experten aber heftig kritisiert.
Welchen Effekt hat eine Blutdrucksenkung von 140 mmHg auf 135 mmHg systolisch? In der ADVANCE-Studie (ADVANCE Collaborative Group, Lancet 2007) wurden 11.140 Patienten (mittleres Alter: 66 Jahre, mittlere Diabetesdauer: 8 Jahre, 32 % hatten schwere kardiovaskuläre Vorerkrankungen) über 4,3 Jahre beobachtet. Die Hälfte der Patienten wurde mit einer fixen Kombination von Perindopril und Indapamid im Vergleich zu Placebo behandelt. In der Verumgruppe betrug der Blutdruck im Schnitt 134/74 mmHg, in der Kontrollgruppe 140/76 mmHg. Die Fixkombination (und wahrscheinlich die dadurch erzielte Blutdrucksenkung) reduzierte in dieser Hochrisikopopulation makrovaskuläre und mikrovaskuläre Ereignisse um 9 %, die Mortalität um 14 % und die kardiovaskulären Todesfälle um 18 %.
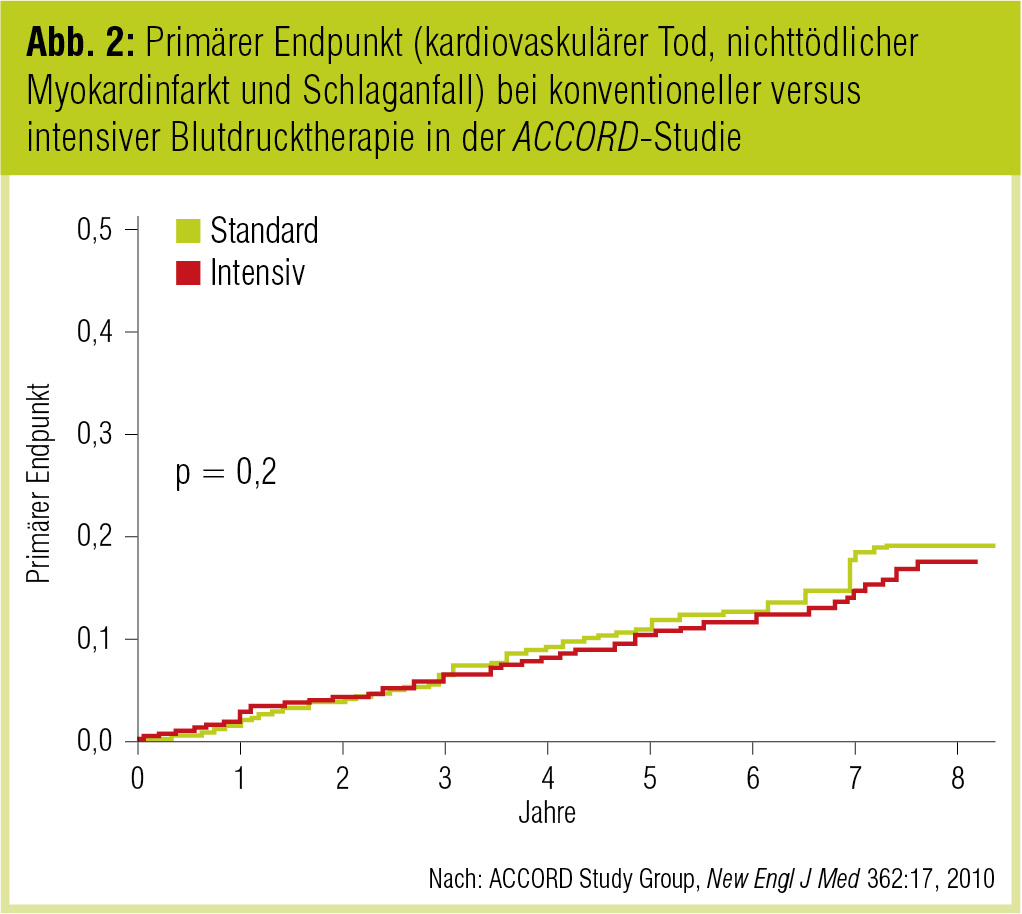
Der Effekt einer noch intensiveren Blutdrucksenkung wurde in der ACCORD-Studie (ACCORD Study Group, New Engl J Med 2010) untersucht. Die Studie inkludierte 4.733 Teilnehmer (mittleres Alter: 62 Jahre, mittlere Diabetesdauer: 10 Jahre), von denen bereits ein Drittel ein kardiovaskuläres Ereignis erlitten hatte; die anderen Patienten hatten zumindest zwei weitere kardiovaskuläre Risikofaktoren. Die Patienten unter intensiver Therapie erzielten einen systolischen Druck von 119 mmHg, die Kontrollpatienten von 133 mmHg. Während der Beobachtungszeit von 4,7 Jahren konnte kein Unterschied im primären Endpunkt (nichttödlicher Herzinfarkt und Schlaganfall, kardiovaskulärer Tod) gefunden werden (Abb. 2). Lediglich das Risiko für Schlaganfall war in der intensiv therapierten Gruppe signifikant niedriger (Hazard Ratio [HR] = 0,59). Für die intensive Blutdrucksenkung wurden durchschnittlich 3,4 Antihypertensiva benötigt, für die weniger intensive Therapie 2,1. Allerdings kam es in der Gruppe mit Blutdruck unter 120 mmHg doch zu einer Zunahme von schweren blutdruckassoziierten Nebenwirkungen (3,3 % vs. 1,3 %) wie Hypotonie, Synkope, Arrhythmie und Verschlechterung der Nierenfunktion.
Ähnliche Ergebnisse brachte eine observationelle Subanalyse von Patienten mit Diabetes und bekannter koronarer Herzkrankheit in der INVEST-Studie (Cooper-DeHoff et al., JAMA 2010). Die Studie beschreibt die kardiovaskuläre Ereignisrate (Tod, nichttödlicher Myokardinfarkt und Schlaganfall) von 6.400 Patienten über einen Beobachtungszeitraum von 3,5 Jahren in Abhängigkeit vom erreichten Blutdruck. Patienten mit unkontrollierter Hypertonie (RR systolisch: > 140 mmHg) hatten dabei eine deutlich höhere Ereignisrate (19,8 %) verglichen mit der konventionellen (RR systolisch: 130–140 mmHg) Gruppe (12,6 %) und der strikt kontrollierten (RR systolisch: < 130 mmHg) Gruppe (12,7 %). Zwischen der konventionell und der strikt eingestellten Gruppe zeigte sich kein Unterschied. Für die Mortalität fand sich sogar eine tendenzielle Zunahme in der strikt kontrollierten Gruppe, die nach 5 weiteren Beobachtungsjahren Signifikanz erreichte (21,8 % vs. 22,8 %; HR = 1,15). Patienten mit einem Blutdruck von 110–115 systolisch hatten eine um 63 % höhere Mortalität (allerdings nicht statistisch signifikant), diejenigen mit einem systolischen Blutdruck von < 110 eine um 118 % signifikant höhere Mortalität.
Ein ähnliches Warnsignal kommt aus der ONTARGET-Studie (Sleight et al., J Hypertens 2009): Die Auswertung von 25.588 Patienten (mittleres Alter: 66 Jahre) mit hohem kardiovaskulärem Risiko (75 % hatten koronare Herzkrankheit, 37 % Diabetes) über 5 Jahre je nach erzieltem Blutdruck zeigte einen signifikanten Anstieg von kardiovaskulären Todesfällen (+111 %) und Myokardinfarkt (+20 %) bei Patienten, die initial einen Blutdruck ≤ 130 mmHg hatten, und bei denen dieser durch die Medikation weiter reduziert wurde.
Gibt es eine vernünftige Interpretation der unterschiedlichen Ergebnisse der oben angeführten Studien? Zumindest eine mögliche Erklärung ist die differente Zusammensetzung der Studienpopulationen: Die Patienten der UKPDS 36 waren zumindest um 10 Jahre jünger. Es handelte sich um neu diagnostizierte Patienten mit Diabetes oder solche mit einer kurzen Erkrankungsdauer. Patienten mit schwerer Gefäßerkrankung waren ausgeschlossen! Im Gegensatz dazu waren die Patienten von ACCORD, INVEST und ONTARGET wesentlich älter und hatten eine längere Dauer ihrer Erkrankung. Eine kardiovaskuläre Erkrankung oder ein sehr hohes kardiovaskuläres Risiko waren Voraussetzung für den Einschluss in diese Studien. Von einer Blutdrucksenkung unter 130 mmHg systolisch dürften somit jüngere Patienten mit kurzer Diabetesdauer und ohne schwere vaskuläre Vorerkrankung profitieren. Ältere Patienten mit längerer Diabetesdauer und schweren Gefäßerkrankungen werden möglicherweise durch eine intensive systolische Blutdrucksenkung unter 130 mmHg einem höheren Risiko für Herzinfarkt oder zu versterben ausgesetzt. Auch ein erhöhtes Schlaganfallrisiko kann allenfalls eine intensivere Blutdrucksenkung rechtfertigen. Bei intensiver Therapie ist jedenfalls die zunehmende Wahrscheinlichkeit für Nebenwirkungen zu beachten. Der diastolische Blutdruck sollte bei allen Patienten nicht unter 75 mmHg gesenkt werden. Eine zu starke Senkung vermindert die diastolische Koronarperfusion und erhöht das Herzinfarktrisiko (Messerli et al., Ann Intern Med 2006).
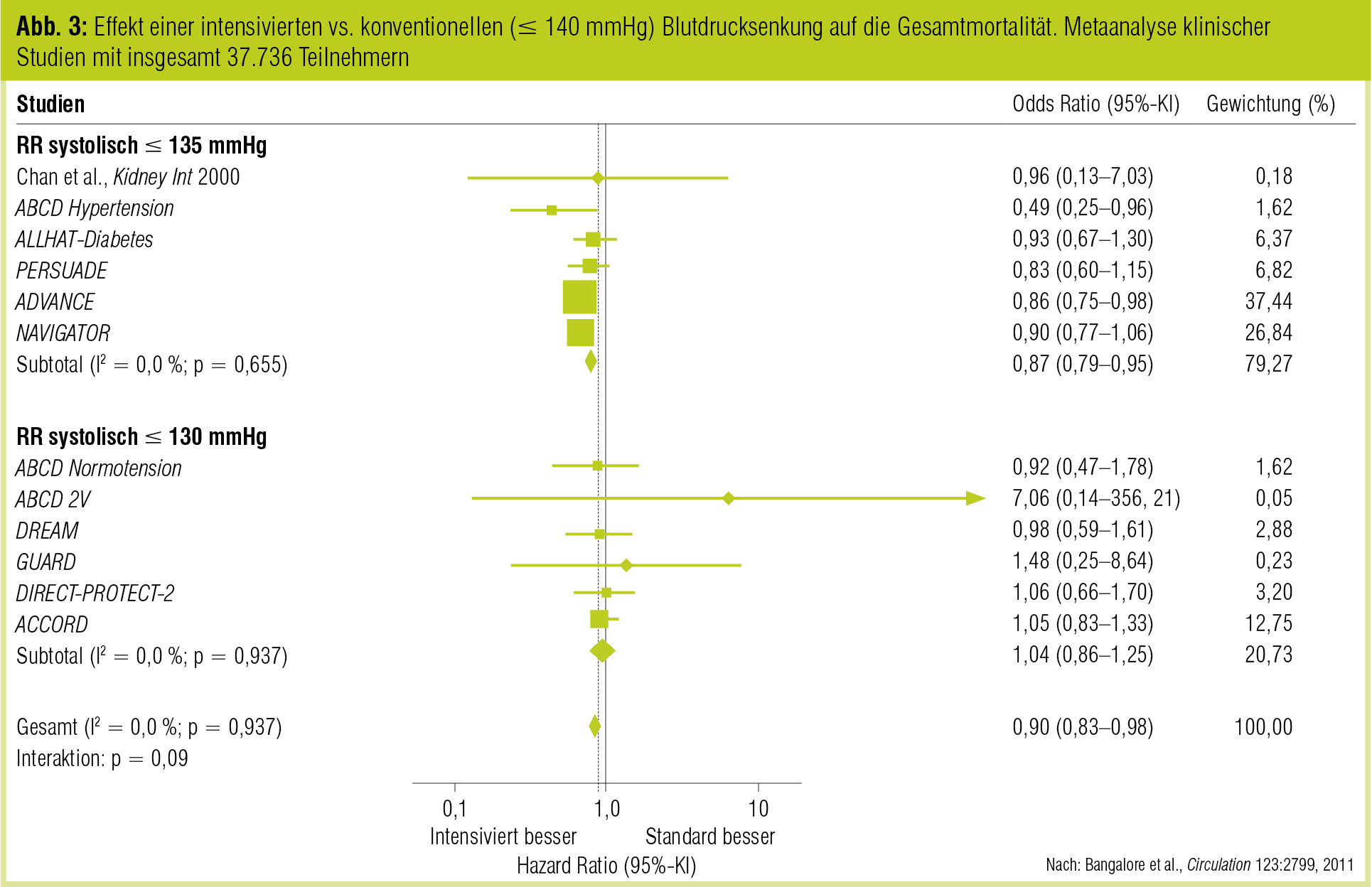
Kürzlich wurde eine Metaanalyse von 13 randomisierten Studien mit insgesamt 37.736 Patienten mit Diabetes oder pathologischer Glukosetoleranz publiziert (Bangalore et al., Circulation 2011). Dabei fand sich im Vergleich zu einer systolischen Blutdrucksenkung von < 140 mmHg bei Werten < 135 mmHg eine Reduktion der Gesamtmortalität um 10 % und des Schlaganfalls um 17 %. Andere makro- und mikrovaskuläre Ereignisse (inklusive Myokardinfarkt) wurden nicht günstig beeinflusst. Die Rate an schwerwiegenden Nebenwirkungen stieg allerdings um 20 %. Bei weiterer Absenkung des systolischen Blutdruckes unter 130 mmHg wurde das Schlaganfallrisiko nochmals gesenkt. Allerdings wurde dies durch eine Zunahme der Nebenwirkungen um 40 % erkauft. Die Autoren schlagen somit für die meisten Patienten einen systolischen Blutdruckzielbereich von 135–130 mmHg vor.
Brauchen Patienten mit Nephropathie niedrigere Blutdruckziele? Wie bereits erwähnt, haben Patienten mit diabetischer Nephropathie ein beträchtlich erhöhtes Risiko für kardiovaskuläre Ereignisse. Die relative Risikoreduktion durch eine Blutdrucksenkung scheint sich dabei nicht wesentlich von der bei Patienten ohne Nephropathie zu unterscheiden. Die ADVANCE-Studie wurde in Hinblick auf die Risikoreduktion in Abhängigkeit vom Stadium der Nephropathie ausgewertet (Heerspink et al., Eur Heart J 2010). Von den insgesamt 10.640 Teilnehmern hatten 2.482 eine chronische Nierenerkrankung (CKD) im Stadium 1 oder 2 und 2.033 eine CKD im Stadium ≥ 3. Unabhängig vom Stadium der Nephropathie lag die relative Risikoreduktion bei Patienten unter Perindopril/Indapamid und einem systolischen Blutdruck von 134/74 mmHg im Vergleich zur Placebogruppe (systolischer Blutdruck 140/76 mmHg) bei etwa 10 %. Bei einer ≥ 3 war die absolute Risikoreduktion allerdings doppelt so hoch, und zwar aufgrund der sehr hohen Ereignisrate in dieser Patientengruppe. In die IDNT-Studie wurden nur Patienten mit manifester Nephropathie und einer Proteinurie über 900 mg/d eingeschlossen. Die 1.590 Patienten wurden mit Irbesartan, Amlodipin oder Placebo behandelt. Die Studie zeigte, dass bei diesen Patienten bis zu einer Blutdrucksenkung auf 120 mmHg systolisch die kardiovaskuläre Mortalität für jede 20-mmHg-Absenkung um 39 % abnimmt (Berl et al., J Am Soc Nephrol 2005). Bei einer weiteren Blutdrucksenkung auf unter 120 mmHg kam es allerdings zu einer dreifachen Zunahme der Gesamtmortalität und einer Vervierfachung der kardiovaskulären Mortalität. Eine Absenkung des diastolischen Blutdrucks unter 85 mmHg erhöhte das Myokardinfarktrisiko um 61 % je 10 mmHg.
In der gleichen Studie wurde auch der Zusammenhang zwischen erreichtem Blutdruck und Progression der Nierenerkrankung (Verdoppelung des Serumkreatinins oder Nierenersatztherapie) untersucht (Pohl et al., J Am Soc Nephrol 2005). Jede Blutdrucksenkung um systolisch 20 mmHg reduzierte renale Endpunkte um 47 % bis zu einem systolischen Blutdruck von 120 mmHg. Unter diesem Wert allerdings kam es zu keiner weiteren Reduktion des renalen Risikos. Sowohl im Hinblick auf renale Endpunkte als auch kardiovaskuläre Mortalität sollte daher bei Patienten mit einer diabetischen Nephropathie Stadium ≥ 3 der systolische Blutdruck keinesfalls unter 120 mmHg gesenkt werden.
In der ADVANCE-Studie wurde der Einfluss einer Therapie mit Perindopril/Indapamid und der damit erreichten Blutdrucksenkung auf Frühstadien der diabetischen Nephropathie untersucht (de Galan et al., J Am Soc Nephrol 2009). 19 % der Patienten hatten eine GFR unter 60 ml/min, 26 % eine Mikroalbuminurie und 4 % eine Makroalbuminurie. Durch die Behandlung wurde das Neuauftreten einer Mikroalbuminurie um 21 % vermindert, das Risiko für eine neue Makroalbuminurie um 31 % und die Progression einer Albuminurie um 22 % gesenkt. Auf eine Verdoppelung des Serumkreatinins oder Dialysepflichtigkeit zeigte sich, wohl aufgrund der kurzen Beobachtungsdauer von 4,3 Jahren, kein Einfluss. Die Inzidenz aller renalen Endpunkte sank mit abnehmendem Blutdruck ohne Schwelle nach unten. Das niedrigste Risiko für renale Endpunkte hatten Patienten mit einem systolischen Blutdruck unter 110/65 mmHg. Die Metaanalyse von Bangalore et al. (Circulation 2011) findet eine Risikoreduktion für manifeste Nephropathie bei RR < 135 mmHg um 27 %, bei RR < 130 mmHg um 36 % im Vergleich zu konventioneller Therapie.
Neuere Untersuchungen zeigen, dass etwa 50 % aller Diabetiker mit eingeschränkter Nierenfunktion keine Albuminurie und somit keine mikroangiopathische Nephropathie haben. Diese Form ist wahrscheinlich durch eine Schädigung der präglomerulären Gefäße bedingt und mit einer hohen Prävalenz kardiovaskulärer Erkrankungen assoziiert (Penno et al., J Hypertens 2011). Der klinische Verlauf dieser Erkrankung ist unklar. Mit einer aggressiven Blutdrucksenkung sollte bei diesen Patienten aber eher Zurückhaltung geübt werden (cave akute Nierenfunktionsverschlechterung, vor allem bei RAAS-Blockade).
Welche Antihypertensiva verwenden?
Generell ist die erzielte Blutdrucksenkung sicher wichtiger als die Art des verwendeten Antihypertensivums. Eine Subgruppenanalyse von Patienten mit Diabetes in ALLHAT zeigte eine Äquipotenz von Lisinopril, Amlodipin und Chlortalidon bezüglich der Risikoreduktion von kardiovaskulären Todesfällen und nichttödlichem Myokardinfarkt (ALLHAT Collaborative Research Group, JAMA 2002). Dennoch werden ACE-Inhibitoren (ACEI) und Angiotensinrezeptorblocker (ARB) als Mittel der ersten Wahl empfohlen. Sie haben möglicherweise Vorteile im Hinblick auf kardiovaskuläre Ereignisse, wie in der LIFE-Substudie bei Diabetikern gezeigt wurde (Lindholm et al., Lancet 2002). Gesichert ist ihr Vorteil in der Progressionshemmung bei diabetischer Nephropathie. Da für die Erreichung eines systolischen Blutdruckes unter 140 mmHg meist zwei, für einen Blutdruck unter 130 mmHg drei bis vier Antihypertensiva notwendig sind, wird für die meisten Patienten eine Kombinationstherapie notwendig sein. Als Kombinationspartner für RAAS-Blocker eignen sich vor allem Thiaziddiuretika und Kalziumantagonisten. In der ACCOMPLISH-Studie war die Kombination Benazepril/Amlodipin der Kombination Benazepril/Hydrochlorothiazid sowohl für kardiovaskuläre als auch renale Risikoreduktion überlegen (Jamerson et al., New Engl J Med 2008; Bakris et al., Lancet 2010). Eine Kombinationstherapie von ACEI und ARB oder Aliskiren wird nicht mehr empfohlen. Für Patienten mit koronarer Herzerkrankung und Herzinsuffizienz sind natürlich auch Betablocker geeignet, wobei hier Carvedilol oder Nebivolol wegen ihrer Stoffwechselneutralität der Vorzug zu geben ist.