Die Rolle des Ultraschalls in der rheumatologischen Praxis
Seit Jahren ist der diagnostische Ultraschall in mehreren Subdisziplinen der Inneren Medizin wie der Kardiologie oder Gastroenterologie fest etabliert. In der Rheumatologie ist die Sonographie vergleichsweise noch wenig verbreitet. Der rasche technische Fortschritt und die Entwicklung von Schallköpfen mit einer Frequenz von bis zu 18 MHz ermöglichen eine detaillierte Befundung bei verschiedenen muskuloskelettalen Fragestellungen und die Sonographie bietet wertvolle zusätzliche Informationen zur Anamnese, klinischen Untersuchung, konventionellen bildgebenden Diagnostik und Laboruntersuchung1.
Sonographie in der Diagnose rheumatischer Erkrankungen
Die aktuelle Literatur belegt eine hohe Sensitivität und Spezifität der Ultraschalluntersuchung zur Detektion entzündlicher Veränderungen bei Gelenk- und Sehnenerkrankungen2. Zudem ist diese Technik auch zur Diagnose von Großgefäßvaskulitiden, beim Karpaltunnelsyndrom, bei der Sklerodermie und beim Sjögren-Syndrom hilfreich.
Am wertvollsten ist die Sonographie in klinisch unklaren Situationen, in denen durch charakteristische Befunde die Diagnose gestellt oder zumindest stärker vermutet werden kann1. Allerdings kann durch die Ultraschalluntersuchung nicht immer ein spezifisches Ergebnis erzielt werden.
Die Rolle der Sonographie in aktuellen Klassifikationskriterien
Die neuen ACR-EULAR-Klassifikationskriterien der Polymyalgia rheumatica (PMR) sind die ersten Kriterien, bei denen der Ultraschall als optionaler Parameter eingesetzt wird3. Die Sonographie der Schulter und/oder Hüften verbessert die Sensitivität und Spezifität der Kriterien gegenüber der klinischen Beurteilung zwar nur wenig, die Aufnahme der Sonographie in die Kriterien unterstreicht aber die zunehmende Bedeutung der Methode in der Rheumatologie.
In den ACR-EULAR-Klassifikationskriterien 2010 der rheumatoiden Arthritis (RA) wurde die Sonographie zwar noch nicht berücksichtigt, in der Diskussion der Arbeit wird allerdings auf die Möglichkeit der Bestätigung eines „betroffenen“ Gelenkes mittels Ultraschall hingewiesen4. In einer Studie an Patienten mit Verdacht auf RA wurde gezeigt, dass die Zahl der entzündeten Gelenke im Ultraschall meist höher ist als klinisch vermutet5. Zudem zeigte sich, dass Patienten, die nicht nur die ACR-EULAR-Klassifikationskriterien 2010 erfüllten, sondern auch ein positives Sonographieergebnis aufwiesen, im Follow-up häufiger auch die (für die RA spezifischeren) 1987 ACR-Kriterien erfüllten, als Patienten mit negativem Ultraschallbefund5.
Charakteristische Ultraschallbefunde in der rheumatologischen Diagnostik
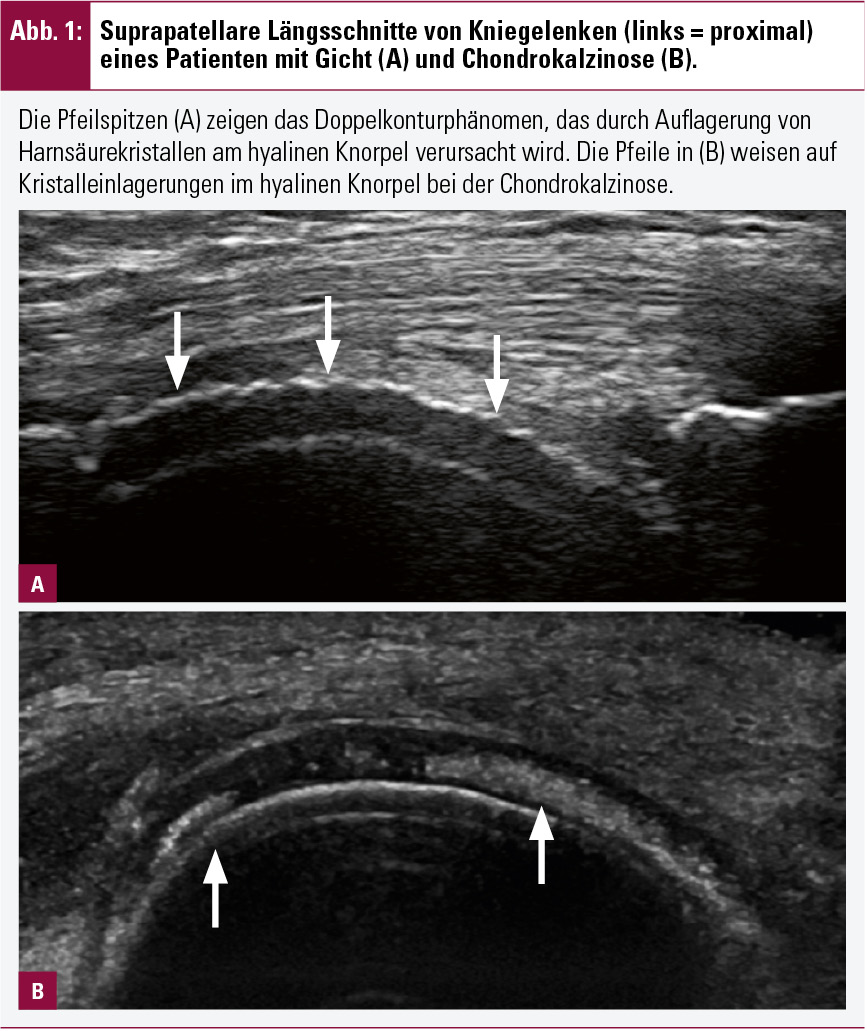
Charakteristische Ultraschallbefunde ermöglichen bei verschiedenen Arthritisformen eine spezifische Zuordnung. So stellen auch die aktuellen EULAR-Empfehlungen zur Diagnose der Chondrokalzinose fest, dass der Nachweis von Kalziumpyrophosphat-Kristallen im hyalinen Knorpel zur Diagnose der Pseudogicht herangezogen werden kann6. Bei der Gicht hingegen sind Harnsäureauflagerungen am hyalinen Knorpel (mit Ausbildung des sog. Doppelkonturphänomens) charakteristisch (Abb. 1)7. Bei Verdacht auf Psoriasisarthritis kann der sonographische Befund der Perisynovitis, einer Entzündung der Weichteile um die Extensorensehne am Metakarpophalangealgelenk, die Diagnose unterstützen8. Erosionen, Synovitis und Tendosynovitis der Sehne des Musculus extensor carpi ulnaris sprechen hingegen für das Vorliegen einer RA.
In der Abklärung der Riesenzellarteriitis (RZA) ist die Anwendung der Sonographie bereits seit Längerem etabliert9, 10. In einigen Zentren wird bei charakteristischer Klinik und Vorliegen eines für die RZA typischen Ultraschallbefundes, dem sog. „Halo“ (das einer echoarmen Verdickung der Gefäßwand entspricht), auf eine Biopsie der Arteria temporalis sogar verzichtet7.
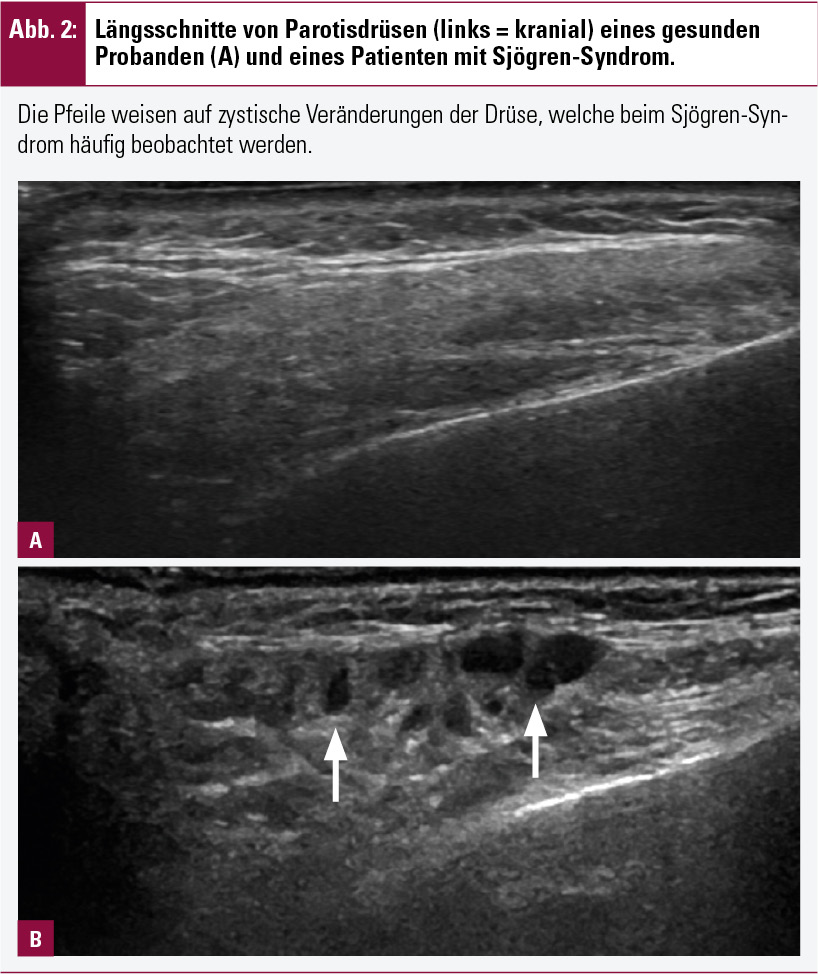
Die Speicheldrüsensonographie kann bei Verdacht auf das Sjögren-Syndrom Parenchyminhomogenitäten mit echoarmen und/oder echoreichen Arealen zeigen (Abb. 2), ein pathologischer Befund ersetzt bis dato aber noch nicht die Autoantikörperdiagnostik bzw. Speicheldrüsenbiopsie11.
Bei Patienten mit Sklerodermie eignet sich die Pleurasonographie zum Screening einer möglichen Lungenfibrose, und bei Patienten mit Verdacht auf Karpaltunnelsyndrom ist die Sonographie des Nervus medianus sensitiv und spezifisch für die Diagnose12, 13.
Ultraschall im Follow-up rheumatischer Erkrankungen
Die Aktivität rheumatischer Gelenkerkrankungen wird meist mit Hilfe klinischer Composite Scores (DAS, CDAI etc.) beurteilt, welche meist gut validiert sind und eine prognostische Einschätzung des Patienten ermöglichen14. Schwierig ist allerdings die Krankheitserfassung bei Vorliegen von Begleiterkrankungen, zum Beispiel bei Fibromyalgie oder Sekundärarthrosen15. Bei diesen Patienten besteht oft trotz effektiver entzündungshemmender Therapie ein hoher Composite Score, verursacht durch eine hohe Zahl an schmerzhaften Gelenken und schlechter subjektiver Beurteilung durch den Patienten. In einer retrospektiven Analyse an 149 RA-Patienten konnten wir zeigen, dass mehr als 20 % der Patienten trotz erhöhter klinischer Scores keine entzündliche Aktivität in der Sonographie aufwiesen16, 17. Umgekehrt ist bei fast der Hälfte der RA-Patienten in klinischer Remission eine subklinische Entzündung im Ultraschall zu beobachten18. Diese Patienten weisen im Vergleich zu Patienten, die auch in sonographischer Remission sind, ein erhöhtes Risiko für einen klinischen Relaps und strukturelle Progression auf19–21. Aktuell wird in prospektiven klinischen Studien untersucht, ob zur Therapieentscheidung bei RA-Patienten nicht nur die klinische Untersuchung, sondern auch der Ultraschallbefund herangezogen werden sollte (TURA‑, IMPERA-Studie).
Die Rolle der Sonographie für das Monitoring nicht gelenkbezogener rheumatischer Erkrankungen ist derzeit unklar. Bei der RZA wurde zwar beobachtet, dass der Halo an der Arteria temporalis nach Einleiten der Kortikosteroidtherapie verschwindet, im Bereich der Axillararterien und anderer großer Gefäße blieben die Veränderungen aber über Monate und Jahre bestehen. Beim Karpaltunnelsyndrom ist bislang umstritten, ob sich ein Therapieerfolg auch im Ergebnis der Ultraschalluntersuchung widerspiegelt, und für den Lungenschall und die Speicheldrüsensonographie sind bisher keine entsprechenden Follow-up-Daten verfügbar2.
Ultraschallgezielte Gelenkpunktion
In mehreren Studien wurde die Überlegenheit der sonographiegezielten Punktion verglichen mit der rein klinisch-anatomisch gezielten Gelenkpunktion in Bezug auf Treffsicherheit, Menge der aspirierten Synovialflüssigkeit und Schmerzreduktion gezeigt2. Besonders bei der Punktion der Schulter- und Hüftgelenke ist die Zuhilfenahme der Sonographie vorteilhaft, sie kann aber auch bei anderen Gelenken, insbesondere bei kleinen Ergussmengen das Risiko einer punctio sicca reduzieren. Auch die Infiltration von Sehnenscheiden oder Bursen kann mit Hilfe der Sonographie ausgezeichnet gesteuert werden.
Prinzipiell kann bei der sonographiegezielten Punktion zwischen einer direkten und einer indirekten Methode unterschieden werden: Bei der direkten Methode wird die Nadelspitze unter Ultraschallsicht in den Gelenkinnenraum eingebracht. Dabei kann die korrekte Position der Nadel durch die Injektion einer kleinen Menge Luft kontrolliert werden22. Bei der indirekten Methode erfolgt zuerst die Sonographie mit Markierung der Einstichstelle und Ausmessen der Distanz zwischen Hautoberfläche und Gelenkkapsel. Anschließend wird die Punktion ohne Ultraschallsicht durchgeführt. Welche der beiden Methoden sich in der Praxis besser bewährt wurde bisher noch nicht systematisch untersucht.
Limitationen des Ultraschalls
Die am häufigsten kritisierte Unsicherheit der Sonographie ist die Reproduzierbarkeit des Ultraschallergebnisses. Aktuellen Studien zufolge scheint diese Sorge aber unberechtigt zu sein, da die Befunde auch bei mehr als zwei Untersuchern übereinstimmten2. Einzelne Berichte deuten sogar darauf hin, dass die Reproduzierbarkeit der Sonographie höher ist als die der klinischen Untersuchung23. Internationale Richtlinien zur Durchführung der Sonographie, standardisierte Beschreibung von Pathologien und Empfehlungen der EULAR zur Durchführung von Ultraschallkursen sollen die Qualität der Ultraschallbefunde noch weiter verbessern24–26.
Eine weitere Limitation der Sonographie ist die fehlende Penetration der Schallwellen in den Knochen. Knochenmarksödeme beispielsweise können mit dem Ultraschall nicht erfasst werden. Auch Teile der Karpalknochen und der Metakarpalköpfchen sind mit dem Ultraschall leider nicht einsehbar.