JAK-Inhibitoren: neue Daten, neue Indikationen
JAK-Inhibitoren gehören zu der Gruppe der „targeted synthetic diseases-modifying anti-rheumatic drugs“ (tsDMARDs). Sie stellen nach den Biologika (bDMARDs) die letzte Entwicklung im Bereich der gezielten („targeted“) Therapieansätze in der Rheumatologie dar.
In der letzten Aktualisierung der Therapieempfehlung der EULAR zur rheumatoiden Arthritis (RA) werden JAK-Inhibitoren nach dem Versagen einer Therapie mit konventionellen synthetischen (cs) DMARDs in ihrem Einsatz den biologischen (b) DMARDs gleichgestellt.
Wie wirken JAK-Inhibitoren?
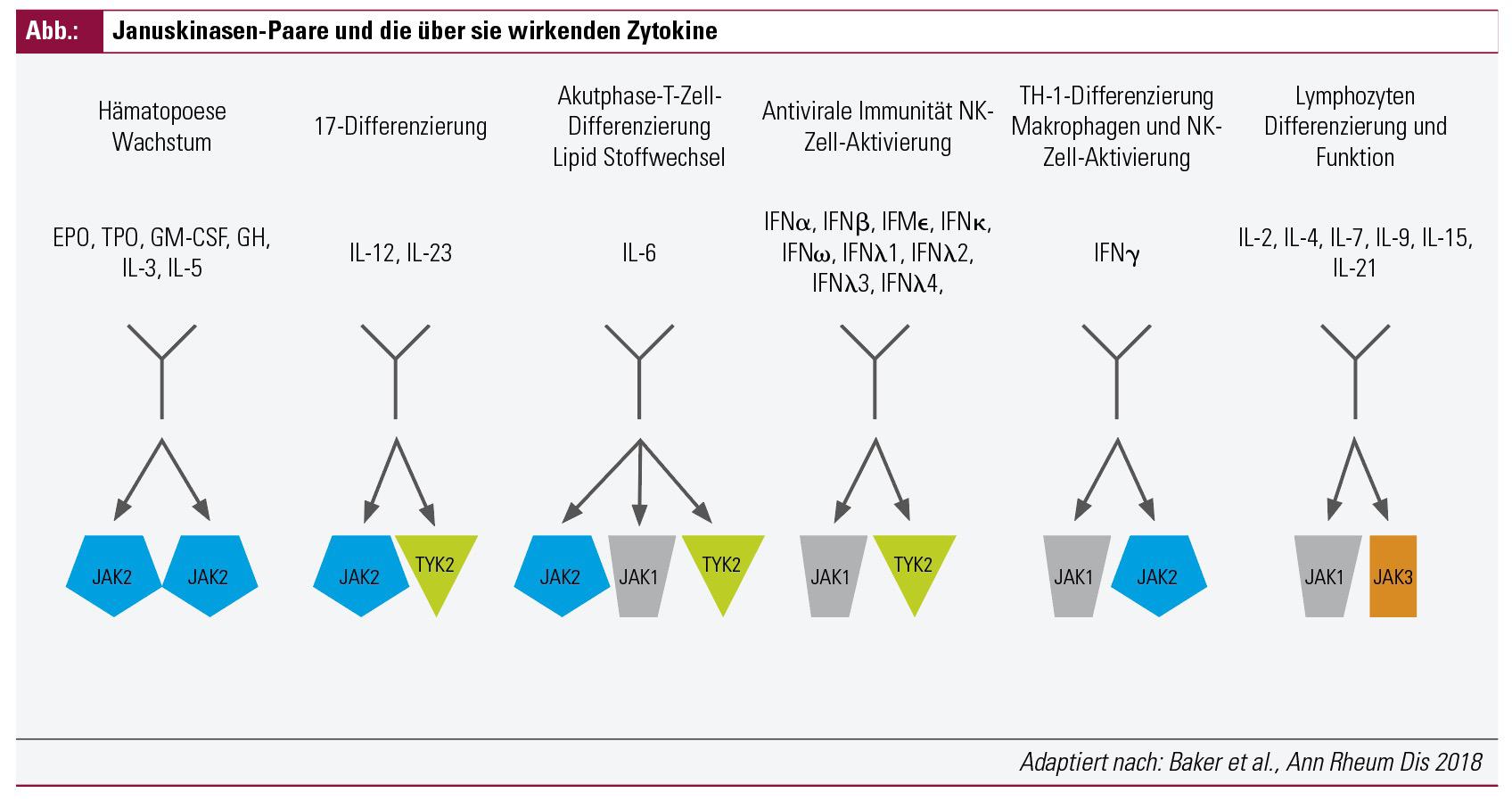
JAK-Inhibitoren greifen gezielt in den „JAK-STAT pathway“ („Janus kinase“ [JAK], „signal transducer and activator of transcription“ [STAT]) ein, über den verschiedene fundamentale biologische Prozesse, darunter die Signalübertragung zahlreicher Zytokine, gesteuert werden. Innerhalb des JAK-STAT-Weges unterscheidet man vier verschiedene JAKs (JAK1–3 und „tyrosine kinase“ 2, TYK2) sowie sieben STATs (STAT1- 5a/b, 6). Nach Bindung von Zytokinen an ihren membranständigen Rezeptor erfolgt die Wirkung über Januskinasen paarweise.
Die Abbildung zeigt eine Übersicht über die unterschiedlichen Januskinasen-Paare und die jeweiligen Zytokine, die über sie wirken.
Nach der Aktivierung eines JAK-Paares durch ein Zytokin auto/transphosphorylieren JAK-Phosphotransferasen die jeweils anderen Tyrosin-Residuen und erlauben dadurch die Bindung und Rekrutierung von STAT-Molekülen. Die anschließende Phosphorylierung von STATs durch JAKs führt zu deren Hetero- oder Homodimerisierung und anschließender Translokation in den Zellkern. Im Zellkern kommt es zur Bindung an die Promoter-Elemente und zur Transkription der jeweiligen Zielgene.
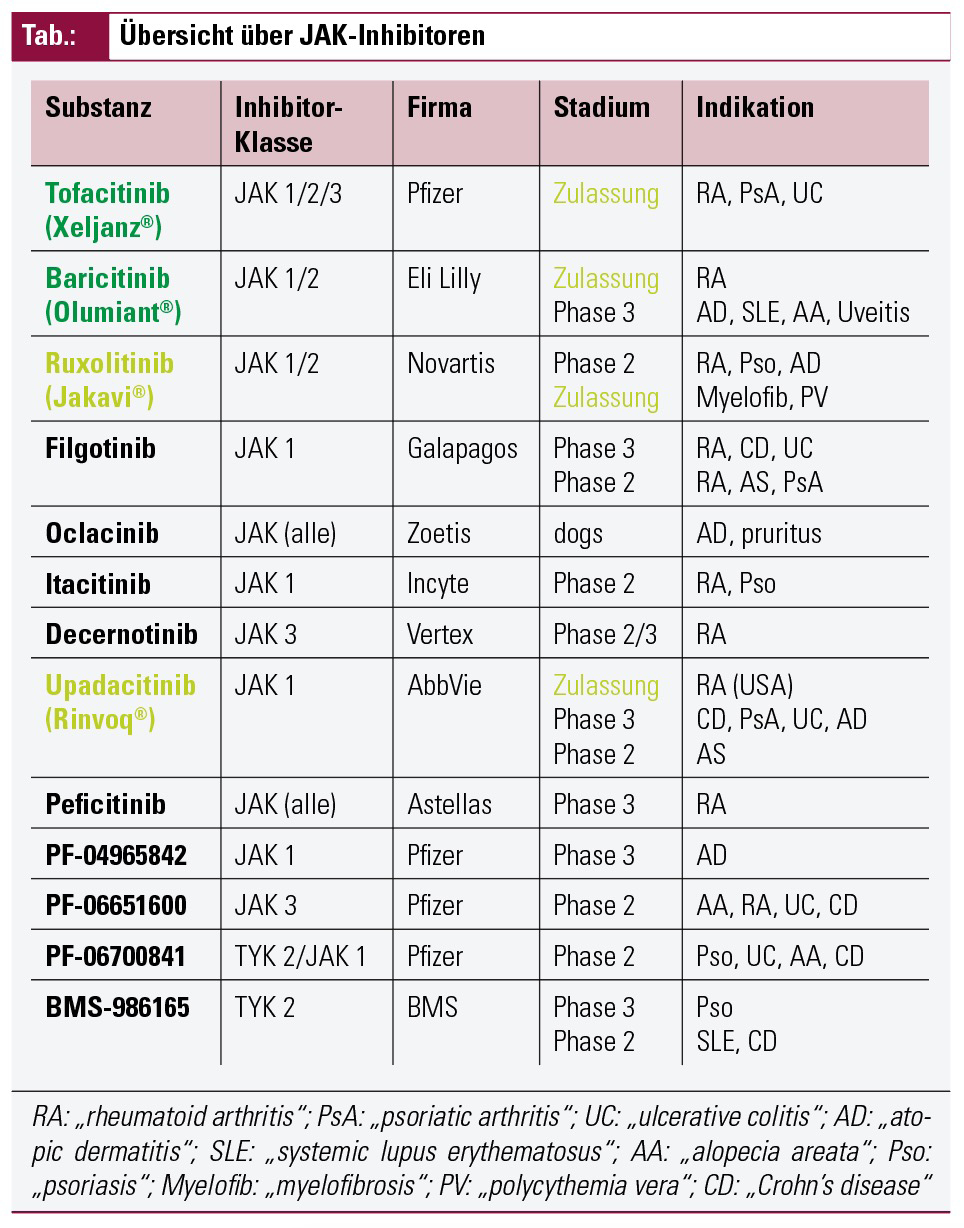
Die Tabelle zeigt eine Übersicht über die derzeit zugelassenen JAK-Inhibitoren und über JAK-Inhibitoren, die sich in klinischen Studien befinden oder im Zulassungsprozess. Im
Folgenden sollen neue Daten bzgl. des Einsatzes einzelner JAK-Inhibitoren in der Rheumatologie diskutiert werden.
Tofacitinib
Tofacitinib blockiert in absteigender Spezifität JAK3, JAK1 und JAK2 und hat eine Zulassung in den Indikationen rheumatoide Arthritis (RA), Psoriasisarthritis (PsA) und Colitis ulcerosa (UC).
Tofacitinib bei RA. Aufgrund einer relativ kurzen Halbwertszeit von ca. drei Stunden muss Tofacitinib zweimal täglich verabreicht werden und im Bereich der RA mit Methotrexat (MTX) kombiniert werden. Bei Vorliegen von Kontraindikationen gegen MTX kommt auch der Einsatz als Monotherapie in Frage.
Tofacitinib bei PsA. Tofacitinib ist derzeit als einziger JAK-Inhibitor für die Therapie der PsA zugelassen. Basis dafür waren zwei Phase-III-Studien bei PsA-Patienten: OPAL Broaden (Mease et al., 2017) und OPAL Beyond (Gladman et al., 2017). In OPAL Broaden wurde Tofacitinib bei Patienten mit einer aktiven PsA und einem inadäquaten Ansprechen auf eine Therapie mit einem csDMARD untersucht. Die ACR20-Ansprechrate war in beiden Dosierungen von Tofacitinib (5 mg: 50 %; 10 mg: 61 %) nach drei Monaten signifikant höher als unter Placebo (33 %). Die ACR20 Response Rate betrug im Vergleichsarm mit Adalimumab 52 %. In OPAL Beyond wurde Tofacitinib bei Patienten mit einer aktiven PsA und mit einem inadäquaten Ansprechen auf eine Therapie mit einem TNF-Inhibitor untersucht. Ähnlich wie in OPAL Broaden war auch in dieser Studie die ACR20 Response in beiden Dosierungen von Tofacitinib (5 mg: 50 %; 10 mg: 47 %) signifikant höher als im Placebo- Arm (24 %). OPAL Balance ist eine kürzlich beendete LTE- (Long-term extension-)Studie zur Sicherheit und Wirksamkeit von Tofacitinib bei Patienten aus den OPAL-Broaden- und OPAL-Beyond-Studien (NCT01976364).
Studien bei JIA. Tofacitinib wurde weiters bei der juvenilen idiopathischen Arthritis (JIA) in einer Phase-III-Studie bei JIA-Patienten mit aktiver Erkrankung und einem inadäquaten Ansprechen auf ein csDMARD untersucht (NCT02592434). Erste Ergebnisse der Studie wurden im Rahmen des letzten ACR Meetings 2019 in Atlanta präsentiert. Ein signifikant höherer Anteil der Patienten erreichte in der Studie unter Tofacitinib eine JIA ACR30 Response im Vergleich zum Placebo-Arm.
Studien in anderen Indikationen. Daneben wird Tofacitinib derzeit in einer Phase II/III bei Patienten mit einer axialen Spondyloarthritis (SPA) untersucht (NCT03738956), in einer Phase-I/II-Studie bei Patienten mit einer systemischen diffusen Sklerose (NCT03274076) sowie in Phase-I-Studien bei Patienten mit einer Dermatomyositis (NCT03002649) und einem diskoidem/systemischen Lupus erythematodes (NCT03159936).
Zum Einsatz von Tofacitinib in der Behandlung der Alopecia areata (AA) kommt eine rezente Metaanalyse zum Ergebnis, dass Tofacitinib ein wirksame Therapiestrategie darstellt (Guo et al., 2019). Bei ca. 54 % der Patienten kommt es demnach zu einem guten oder kompletten neuen Haarwuchs und bei zumindest 26 % der Patienten zu einem teilweisen Therapieerfolg. Derzeit befindet sich eine Phase-IV-Studie bei Patienten mit AA in der Rekrutierungsphase (NCT03800979).
Baricitinib
Baricitinib bei RA. Baricitinib ist ein JAK1/2-Inhibitor und seit 2017 zur Therapie der mittelschweren bis schweren aktiven RA nach Versagen eines csDMARDs in einer Dosis von 4 mg tgl. zugelassen. Bei chronischen Infekten, mittelschweren Nierenschäden bzw. anhaltender Kontrolle der Krankheitsaktivität kann auch eine Dosis von 2 mg tgl. verabreicht werden.
Im Rahmen des ACR Meetings 2019 wurde über die 7-Jahre- Langzeit-Sicherheitsdaten zum Einsatz von Baricitinib in der RA berichtet. Baricitinib zeigte dabei ein ähnliches Sicherheitsprofil wie in den vorhergehenden Studien bei Beibehaltung seiner Wirksamkeit (Genovese et al., Abstract-Nummer: 847).
Studien bei SLE. Weiters wurden Daten der Phase-II-Studie von Baricitinib bei SLE-Patienten präsentiert (Wallace et al., Abstract-Nummer: 970) (siehe auch Wallace et al., 2018). Dabei zeigte sich, dass ein signifikant höherer Prozentsatz an Patienten (67 %) unter einer Therapie mit Baricitinib 4 mg täglich nach 24 Wochen den primären Endpunkt (definiert als SLEDAI-2K-Arthritis oder Rash) im Vergleich zur Placebo-Gruppe (53 %) erreichte. Zusätzlich wurde ein höherer Prozentsatz im SLE-Responder-Index unter 4 mg Baricitinib (64 %) im Vergleich zur Placebogruppe (48 %) erreicht.
Für die 2-mg-Dosis von Baricitinib konnte im Vergleich zu Placebo jedoch kein signifikanter Effekt festgestellt werden. Alle Patienten erhielten Baricitinib zusätzlich zu einer immunsuppressiven Standard-Therapie.
Dörner et al. untersuchten den Effekt von Baricitinib auf die in SLE-Patienten erhöhte Interferon-(IFN-)alpha-Signatur und konnten zeigen, dass Baricitinib in beiden Dosierungen (2 mg: –20 %; 4 mg: –24 %) zu einer signifikanten Reduktion im Vergleich zu Placebo führt (Dörner et al., Abstract-Nummer: 1849). Allerdings konnte keine Korrelation zwischen der Reduktion der IFN-alpha-Signatur und der klinischen Verbesserung in der Arthritis oder einem Rash gemessen anhand des SLEDAI-2K festgestellt werden.
Der Langzeiteffekt von Baricitinib und das Sicherheitsprofil wird bei SLE-Patienten derzeit in einer Phase-III-Studie (SLE-BRAVE-X) untersucht (NCT03843125), in die Patienten aus den Vorläuferstudien I4V-MC-JAHZ (NCT03616912) oder I4V-MC-JAIA (NCT03616964) aufgenommen werden. Die Studien I4V-MC-JAHZ und I4V-MC-JAIA, beide Phase III, befinden sich derzeit in der Rekrutierungsphase.
Studien in anderen Indikationen. Baricitinib konnte auch in anderen Interferonopathien wie der „chronic atypical neutrophilic dermatosis“ (CANDLE) und der STING-assoziierten „vasculopathy with onset during infancy“ (SAVI) zeigen, dass es in der Lage ist, das „IFN signaling“ zu blockieren (Kim et al., Abstract-Nummer: 1893). Zu ähnlichen Ergebnissen kam auch eine zweite Forschungsgruppe (Montealegre Sanchez et al., Abstract-Nummer: 2758)
Im Rahmen eines „Compassionate Use“-Programms wurde Baricitinib bei vier Patienten mit einer juvenilen Dermatomyositis getestet (Kim et al., Abstract-Nummer: 390). Dabei zeigte sich eine Verbesserung im „symptom daily diary score“, der die Komponenten Muskelschwäche, Fatigue, muskuloskelettaler Schmerz und Rash erfasst.
Laufende Studien. JAK-Inhibitoren zeigen generell eine zumindest gleichwertige Wirksamkeit wie bDMARDs (Anti-TNF, Anti-IL6, Abatacept und Rituximab). In manchen Studien wird jedoch von einer vermehrten Wirkung auf „patient-reported outcomes“ (PRO), insbesondere auf die Domänen Schmerz und Fatigue, berichtet. Eine Metaanalyse von 1.488 Artikeln und 33 randomisierten kontrollierten klinischen Studien kam jedoch zum Ergebnis, dass sich die Wirkung von JAK-Inhibitoren auf Schmerz und Fatigue nicht von jener der bDMARDs unterscheidet (Odriozola et al., Abstract-Nummer: 1401).
Derzeit laufende klinische Phase-III-Studien mit Baricitinib werden in Indikationen atopische Dermatitis (NCT03559270), JIA-assoziierte Uveitis (NCT04088409) und Alopecia areata (NCT03899259) durchgeführt.
Phase-II-Studien finden derzeit in den Indikationen Riesenzellarteriitis (NCT03026504), primäre biliäre Cholangitis (NCT03742973), Psoriasis (NCT01490632), Aicardi Goutieres Syndrom (NCT03921554), diabetische Nephropathie (NCT01683409) und Polymyalgia rheumatica (NCT04027101) statt. Eine Phase-I/II-Studie läuft bei Patienten mit einer chronischen „graft versus host disease“ (NCT02759731).
Next-Generation-JAK-Inhibitoren: Bedeutung der Selektivität
Nach Tofacitinib und Baricitinib wurden JAK-Inhibitoren entwickelt, die sich durch eine höhere Selektivität gegenüber einer einzelnen JAK auszeichnen sollen. Obwohl für diese Next- Generation-JAK-Inhibitoren eine hohe Selektivität in vitro nachgewiesen werden konnte, ist diese Selektivität nicht absolut. Das Ausmaß der Selektivität und ihre Bedeutung ist insbesondere unter klinischen Bedingungen in vivo nicht vollständig geklärt. Darüber hinaus waren selektive und nichtselektive JAK-Inhibitoren in klinischen Studien mit RA-Patienten bisher annähernd gleich wirksam. Dasselbe muss aber nicht unbedingt auch für andere immunmediierte Erkrankungen gelten. Beispielsweise ist Filgotinib, ein JAK-1-selektiver Inhibitor, wirksam bei Patienten mit Morbus Crohn, während Tofacitinib bei dieser Patientengruppe keine Wirkung zeigt. Demnach könnte eine präferenzielle Inhibition einer JAK gegenüber einer anderen für gewisse immunmediierte Erkrankungen eine ausreichende Wirkung zeigen, während es für andere Erkrankungen notwendig ist, mehrere JAK zu blockieren („reviewed in“ [Schwartz et al., 2018]).
Upadacitinib
Upadacitinib ist ein JAK-Inhibitor, der in den USA bereits zur Therapie der RA zugelassen ist. Upadacitinib zeigte in biochemischen und zellulären Assays eine 74-fach höhere Selektivität für JAK1 über JAK2 und eine 58-Fache über JAK3. In Europa befindet sich Upadacitinib im Zulassungsverfahren (EMA: „positive opinion“ im Oktober 2019).
Upadacitinib bei RA. Upadacitinib wurde in einer Phase-III-Studie bei Patienten mit einem inadäquaten Ansprechen auf eine Therapie mit MTX (SELECT-COMPARE Study) untersucht (Fleischmann et al., 2019). Der primäre Endpunkt einer ACR20 Response wurde bei einem signifikant höheren Prozentsatz (71 %) von Patienten im Vergleich zu Placebo (36 %) erreicht. Auch die radiologische Progression konnte im Vergleich zu Placebo signifikant besser gebremst werden. Die Studie war außerdem von ihrem statistischen Design her in der Lage, eine Überlegenheit von Upadacitinib gegenüber Adalimumab gemessen an einer ACR50 Response, am Erreichen eines DAS28- CRP Scores von < 3,2, an einer Verbesserung im Schmerz- Score und einer Verbesserung im HAQ-Index nachzuweisen. Von seinem Nebenwirkungsprofil war Upadacitinib vergleichbar zu Adalimumab.
Das weitere Studienprogramm von Upadacitinib in der RA umfasst weiters die SELECT-BEYOND-Studie in der Upadacitinib in zwei Dosierungen (15 und 30 mg) bei Patienten mit einem inadäquaten Ansprechen auf eine Therapie mit einem bDMARD untersucht wurde (Genovese et al., 2018). Es konnte mit beiden Dosierungen (15 mg: 65 %; 30 mg: 56 %) im Vergleich zu Placebo (28 %) eine signifikant höhere ACR20 Response Rate beobachtet werden. Ein Effekt von Upadacitinib auf eine Progression der radiologischen Gelenkveränderungen wurde in dieser Studie nicht untersucht. In der SELECT-NEXT-Studie wurde Upadacitinib im Vergleich zu Placebo bei Patienten mit einem inadäquaten Ansprechen auf ein beliebiges csDMARD untersucht (Burmester et al., 2018). Auch hier ergab sich für Upadacitinib mit beiden Dosierungen (15 mg: 64 % und 30 mg: 66 %) ein signifikant höhere ACR20 Response als im Vergleich zu Placebo (35 %).
Das weitere Studienprogramm zu Upadacitinib umfasst die SELECT-MONOTHERAPY-Studien. In dieser Studie wurde ein Wechsel auf Upadacitinib als Monotherapie bei Patienten mit einem inadäquaten Ansprechen auf eine Therapie mit MTX im Vergleich zu einer Fortsetzung der Therapie mit MTX untersucht (Smolen, 2019). Hier zeigte sich der Wechsel auf Upadacitinib überlegen gegenüber einer Fortsetzung der Therapie mit MTX. Zwei weitere Studien zu Upadacitinib bei RA-Patienten befinden sich derzeit noch in der Durchführung. In der SELECT-EARLY-Studie wird bei MTX-naive Patienten die Gabe von Upadacitinib als Monotherapie im Vergleich zu MTX als Monotherapie untersucht (NCT02706873). In der SELECT-CHOICE-Studie erhalten RA-Patienten, die auf eine Therapie mit einem bDMARD ein ungenügendes Ansprechen zeigten, eine Therapie mit Upadacitinib im Vergleich zu Abatacept; jeweils in Kombination mit einem csDMARD (NCT03086343). Daten aus der SELECT-EARLY-Studie wurde im Rahmen des ACR Meetings 2019 präsentiert (Abstract-Nummer: 512). Upadacitinib zeigte sich dabei als Monotherapie bei Patienten mit einer RA und einer Krankheitsdauer von unter drei Monaten gegenüber einer Monotherapie mit MTX hinsichtlich des Erreichens einer niedrigen Krankheitsaktivität oder Remission überlegen.
Studien bei axSpA. Neben der RA wurde Upadacitinib in einer Phase-II/III-Studie bei Patienten mit einer axialen Spondyloarthritis (SpA) mit einem ungenügenden Ansprechen auf eine Therapie mit NSAR oder Kontraindikationen gegen NSAR untersucht (van der Heijde MD et al., 2019). Die Studie erreichte ihren primären Endpunkt einer ASAS40 Response in der Woche 14 (52 % in der Upadacitinib Gruppe im Vergleich zu 26 % in der Placebo-Gruppe).
Studien in anderen Indikationen. Phase-III-Studien zu Upadacitinib werden derzeit in den Indikationen Ulcerative Colitis (NCT03006068, NCT02819635 und NCT03653026), axiale SPA (NCT04169373), atopische Dermatitis (NCT03607422, NCT03569293, NCT03568318, NCT03661138 und NCT03738397), Takayasu Arteriitis (NCT04161898), Morbus Crohn (NCT03345836), Riesenzellarteriitis (NCT03725202) und PsA (NCT03104374, NCT03104400) durchgeführt.
Phase-II-Studien laufen in den Indikationen Morbus Crohn (NCT02782663) und SLE (NCT03978520); Phase-I-Studien in der atopischen Dermatitis (NCT03646604) und der JIA (NCT03725007).
Filgotinib
In-vitro-Assays zeigen für Filgotinib eine selektive Inhibition von vorwiegend JAK1 und JAK2 vor JAK3 und TYK2. In Vollblut-Analysen konnte in vitro eine ca. 30-fach höhere Selektivität für JAK1 über JAK2 nachgewiesen werden. Filgotinib befindet sich neben Upadacitinib in einem ebenfalls fortgeschrittenen Entwicklungsstadium.
Studien bei RA. In der Phase-III-Studie FINCH 2 wurde Filgotinib in RA-Patienten mit einem ungenügenden Ansprechen auf eine bDMARD-Therapie untersucht. Nach 12 Wochen zeigte ein signifikant höherer Anteil der Patienten eine ACR20 Response mit einer Dosis von 200 mg (66 %) oder 100 mg (57 %) im Vergleich zu Placebo (31 %) (Genovese et al., 2019).
Studien bei SpA. Filgotinib wurde bisher in zwei Phase-II-Studien bei Patienten mit unterschiedlichen Formen einer Spondyloarthritis untersucht. In der EQUATOR-Studie waren Patienten mit einer aktiven Psoriasisarthritis und einem Versagen auf eine Therapie mit einem csDMARD oder einem bDMARD eingeschlossen (Mease et al., 2018). Signifikant mehr Patienten erreichten unter einer Therapie mit Filgotinib eine ACR20 Response (80 %) im Vergleich zur Placebo-Gruppe (33 %). In der TORTUGA-Studie wurden Patienten mit einer ankylosierenden Spondylitis und einen inadäquaten Ansprechen auf eine Therapie mit NSAR untersucht (van der Heijde et al., 2018). Der primäre Endpunkt in der Studie war eine Änderung im „ankylosing spondylitis disease activity score“, die für Filgotinib mit –1,47 signifikant höher ausfiel im Vergleich zu –0,57 in der Placebo-Gruppe.
Phase-III-Studien zu Filgotinib laufen in den Indikationen Morbus Crohn (NCT02914600) und Colitis ulcerosa (NCT02924535); Phase-II-Studien finden in den Indikationen Uveitis (NCT03207815), membranöse Lupus-Nephropathie (NCT03286711), kutaner Lupus erythematodes (NCT03134222) und Sjögren-Syndrom (NCT03100942) statt.
Ruxolitinib
Der vierte (wenn man Upadacitinib schon dazu rechnet) derzeit zugelassenen JAK-Inhibitor ist Ruxolitinib, eine JAK1- und JAK2-Inhibitor, der zur Behandlung nichtrheumatologischer Erkrankungen wie der Myelofibrose und der Polycythaemia vera eingesetzt werden kann. Für Ruxolitinib laufen Phase-II-Studien bei rheumatoider Arthritis (NCT00550043), der Psoriasis (NCT00617994) und der atopischen Dermatitis (NCT03920852).
Nebenwirkungen von JAK-Inhibitoren
Zytokine spielen in der Abwehr von Infektionen eine wichtige Rolle. Das vermehrte Auftreten von Infektionen unter einer JAK-Inhibition war demnach zu erwarten. Schwere Infektionen und opportunistischen Infektionen sind unter einer JAK-Inhibitor-Therapie erhöht, allerdings ist die Rate vergleichbar mit der von bDMARDs, inklusive der von TNF-Blockern.
Herpes Zoster. Die häufigste infektiöse Komplikation unter JAK-Inhibitoren ist die Reaktivierung einer Varicella-Zoster- Virus-Infektion, die ungefähr doppelt so häufig auftritt wie unter einer bDMARD-Therapie. Das Risiko steigt außerdem bei einem gleichzeitigen Einsatz von Glukokortikoiden und unter einer Kombination mit MTX. In Anbetracht der antiviralen Wirkung von Interferonen ist der Anstieg von Herpes Zoster nicht überraschend, es ist allerdings unklar, warum speziell diese virale Infektion bevorzugt auftritt.
Blutbildveränderungen betreffen das Auftreten von Anämien, eine Abnahme der Anzahl von Lymphozyten, NK-Zellen, neutrophilen Granulozyten und Blutplätten. Auch diese Nebenwirkung erklärt sich aus der insbesondere über JAK2 vermittelten Wirkung von Zytokinen (z. B. Erythopoietin, Thrombopoietin) auf die Hämatopoiese. Veränderungen in der Zahl der Lymphozyten und neutrophilen Granulozyten korrelieren allerdings nicht mit einem gehäuften Auftreten von Infekten.
Thromboembolische Ereignisse. Berichte über das gehäufte Auftreten von thromboembolischen Ereignissen gab es erstmals im Zuge der klinischen Studien zur Wirkung von Baricitinib. Während die Rate von thromboembolischen Ereignissen bei RA-Patienten generell über der von Gesunden liegt, ist die Zuordnung dieser Komplikation zur Wirkungsweise einer Gruppe von Zytokinen nicht einfach. Eine Inhibition von JAK2 interferiert zwar mit Signalübertragung von Thrombopoietin und der Plättchenhomöostase, ein direkter kausaler Zusammenhang mit Thrombosen lässt sich daraus allerdings nicht ableiten. Die bei Patienten unter eine JAK-Inhibition häufig beobachtete Thrombopenie ist nicht das Ergebnis einer direkten JAK2-Blockierung in Thrombozyten, sondern vielmehr durch eine Wirkung auf Stammzellen und Vorläuferzellen zu erklären. Eine gepoolte Datenanalyse aus 9 klinischen Studien von Baricitinib bei RA-Patienten konnte rezent keine Assoziation zwischen einer Baricitinib-Therapie und dem Auftreten schwerer kardiovaskulärer Ereignisse, arterieller Thrombosen oder einer Herzinsuffizienz feststellen. Hinsichtlich des Auftretens tiefer Beinvenenthrombosen oder Pulmonalembolien fand sich ein Ungleichgewicht in der anfänglichen 24 Wochen placebokontrollierten Periode im Sinne eine Auftretens von thromboembolischen Ereignissen in der 4-mg-Baricitinib-Gruppe – jedoch nicht in der Placebo-Gruppe. Die Anzahl der Events war jedoch sehr klein und wiederholte sich danach in der 24-Wochen-Periode bei Patienten, die von einem Placebo auf 4 mg Baricitinib wechselten, nicht. In der anschließenden Langzeitbeobachtungsperiode war die Inzidenzrate von venösen thrombotischen Ereignissen zwischen den verschiedenen Baricitinib-Dosierungen nicht unterschiedlich, sondern konstant über die Zeit und vergleichbar mit den in der Vergangenheit bei RA-Patienten beschriebenen Raten (Taylor et al., 2019).
Derzeit befindet sich eine Phase-IV-Post-Marketing-Studie zur Sicherheit von zwei verschiedenen Dosierungen von Baricitinib im Vergleich zu einem TNF-Inhibitor hinsichtlich des Auftretens von venösen thromboembolischen Ereignissen bei RA-Patienten in der Durchführung (NCT04086745).
Im Februar 2019 veröffentlichte die FDA eine Sicherheitswarnung bezüglich eines vermehrten Auftretens von thromboembolischen Ereignissen unter einer Therapie mit Tofacitinib in der 2-mal-täglich-10-mg-Dosierung anhand von Daten einer Sicherheitsstudie bei Patienten mit RA (NCT02092467). Die Dosierung wurde in dieser noch laufenden Studie infolge auf 2-mal täglich 5 mg herabgesetzt. Die 2-mal-täglich-10-mg-Dosierung von Tofacitinib ist derzeit nur für die Therapie der Colitis ulcerosa in der Einleitungsphase für 8 Wochen und als Langzeittherapie nur unter besonderen Umständen, nicht aber für die Therapie der RA oder der PsA zugelassen.
Derzeit gelten FDA „black box warnings“ für Tofacitinib, Baricitinib und auch Upadacitinib aufgrund des Verdachts eines Klasseneffekts für alle JAK-Inhibitoren, obwohl in den klinischen Studien sogar niedrigere Raten von venösen thromboembolischen Ereignissen unter Upadacitinib im Vergleich zu Placebo und Adalimumab beobachtet wurden. Auch für Filgotinib wird ein ähnlicher Sicherheitsvermerk erwartet.
Für das vermehrte Auftreten maligner Erkrankungen unter einer JAK-Inhibitor-Therapie gibt es anhand klinischer Studien bisher keinen Hinweis. Langzeitstudien werden hier in Zukunft jedoch notwendig sein.
Resümee und offene Fragen
JAK-Inhibitoren stellen zweifellos eine wertvolle zusätzliche Therapieoption in verschiedenen entzündlichen rheumatologischen Erkrankungen dar. Eine Reihe von Fragen bezüglich ihres Einsatzes bedürfen aber noch einer weiteren Klärung:
- In welchem Stadium einer Erkrankung sollten JAK-Inhibitoren am besten eingesetzt werden, um einen möglichst großen therapeutischen Benefit zu erzielen?
- Führt die breite Blockade von Zytokinen im Gegensatz zur monospezifischen Blockade durch bDMARD auch zu einem verstärkten immunmodulatorischen Effekt?
- Wird durch eine selektive Inhibition einzelner JAK innerhalb der JAK-Familie ein besserer therapeutischer Effekt erreicht?
- Wie gestaltet sich das Nebenwirkungsprofil anhand derzeit laufender Sicherheitsstudien, und steht es in einem akzeptablen Gleichgewicht mit der therapeutischen Wirkung?
Es ist zu erwarten, dass diese Fragen anhand klinischer Studien und zunehmender Daten aus Registern in Zukunft weitgehend beantwortet werden können und zu einem sinnvollen Einsatz dieser Präparate beitragen werden.
tients With Rheumatoid Arthritis and an Inadequate Response to Methotrexate: Results of a Phase III, Double-Blind, Randomized Controlled Trial. Arthritis & Rheumatology, 9(59), pp.789–13.