Sonografie in der Rheumatologie
Lunge und Pleura
Das wichtigste medizinische Thema im Jahr 2020 war unbestritten die COVID-19-Pandemie. In diesem Zusammenhang hat der Einsatz von Ultraschall zur Beurteilung der Pleura und der Lunge als schnelles, bettseitiges Verfahren erhöhte Aufmerksamkeit erlangt.1 Während in der Vergangenheit der Ultraschall für die Bildgebung der Lunge als Tabu galt, ist anzumerken, dass seine Verwendung für die Untersuchung des akuten Lungenversagens seit über einem Jahrzehnt beschrieben und seitdem konsequent in der Notaufnahme eingesetzt wird.
Der Lungenultraschall hat seine Nützlichkeit bei der Erkennung eines breiten Spektrums von Pathologien bewiesen, einschließlich der Veränderung der Struktur des Lungenparenchyms durch Lungenödem, Pneumothorax, interstitielle Fibrose und andere Krankheiten, die durch eine Abnahme des Luftgehalts in der Lunge und durch eine Veränderung des Verhältnisses von Gewebe, Luft und Flüssigkeit gekennzeichnet sind. Im Hinblick auf die letztgenannten Veränderungen hat er schnell die Aufmerksamkeit auch von Rheumatologen gewonnen, die nach einem „Bedside-test“ Bildgebungsverfahren (im englischsprachigen Raum Point-of-Care Ultrasound = POCUS) zur Beurteilung interstitieller Lungenerkrankungen suchten, die bei rheumatischen Erkrankungen häufig auftreten.
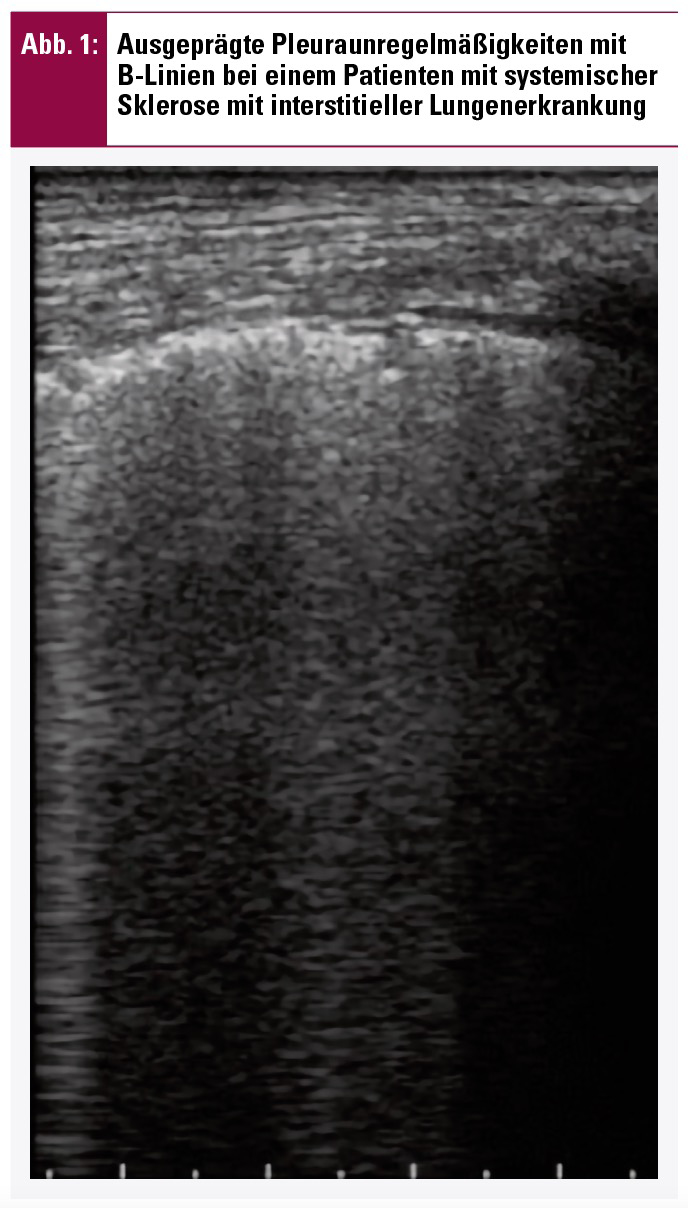
Unter normalen Bedingungen kann das Gleiten der parietalen und viszeralen Pleura zusammen mit dem möglichen Vorhandensein von so genannten A-Linien, die den Nachhall der Pleura widerspiegeln, erkannt werden. Die interstitielle Lungenerkrankung (ILD) ist durch den Verlust der peripheren Lungenbelüftung gekennzeichnet, weshalb der Ultraschallstrahl reflektiert wird, wodurch Nachhallartefakte, so genannte B-Linien, sowie pleurale Unregelmäßigkeiten entstehen. Leider sind B-Linien nicht spezifisch für ILD und können unter anderem bei kardiogenem Lungenödem oder bei akutem Lungenversagen (ARDS) gesehen werden. Eine kürzlich durchgeführte systematische Literaturrecherche (SLR) der OMERACT-Ultraschall-Arbeitsgruppe ergab, dass der Lungenultraschall eine valide Untersuchung ist, es gibt jedoch keine ausreichenden Belege für Zuverlässigkeit und Veränderungssensitivität.2 Daher führte die Gruppe eine Delphi-Konsensus- sowie eine webbasierte Reliabilitätsübung durch und einigte sich auf Definitionen für Pleuraunregelmäßigkeiten und B-Linien, wobei die webbasierte Übung eine moderate Interreader-Reliabilität für beide zeigte3 (Abb. 1).
Große Gefäße
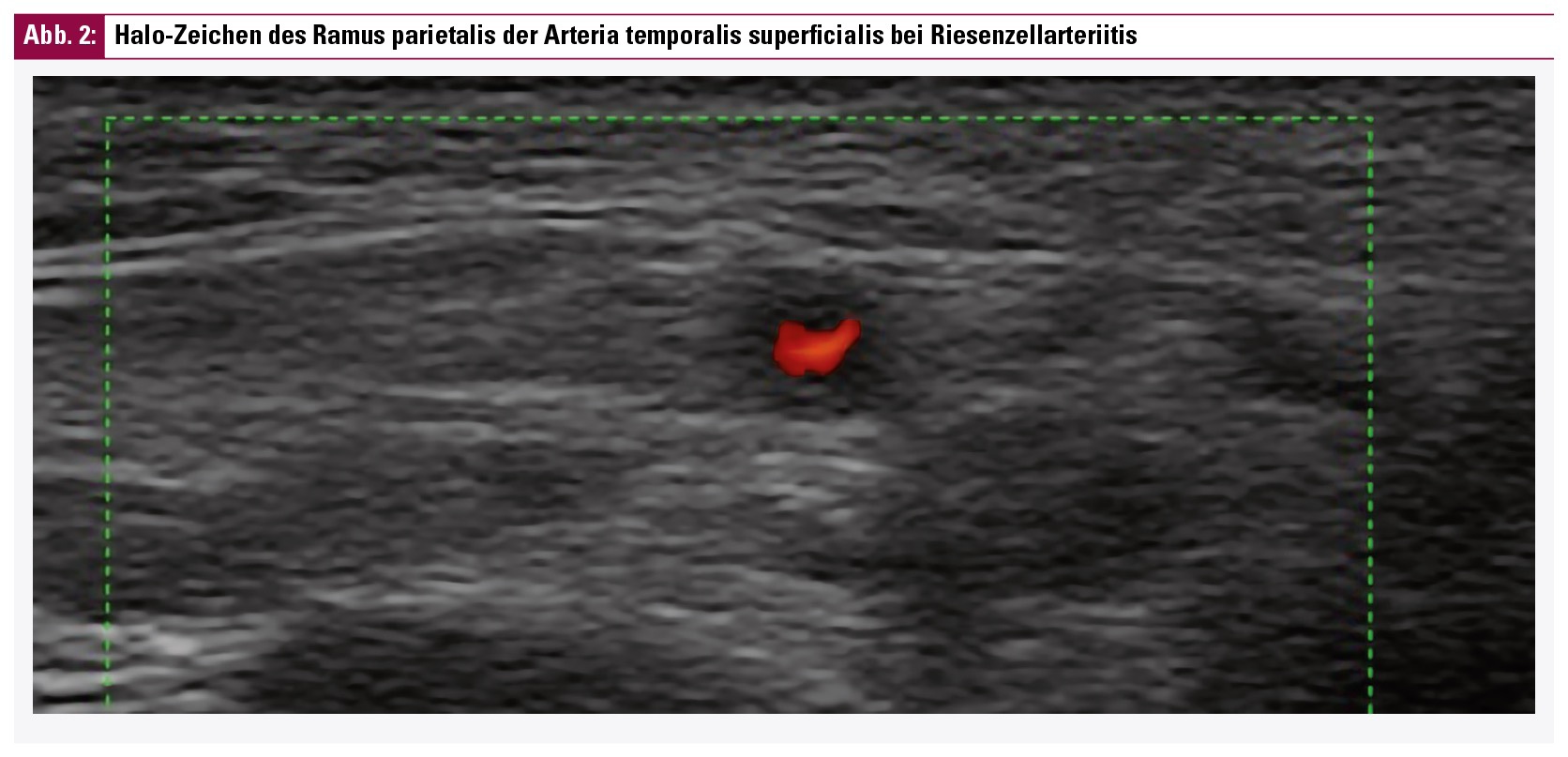
In den letzten Jahren hat sich die Ultraschalluntersuchung der Schläfenarterien als diagnostische Methode der Wahl für die Indikation einer Vaskulitis der großen Gefäße etabliert. Ultraschall ist eine kostengünstige Methode zur Untersuchung mittlerer und großer Gefäße und liefert hochauflösende Bilder der oberflächlichen Blutgefäße. Bei dieser Indikation erscheint die lokalisierte Intima-Media-Verdickung, die häufig bei Riesenzellarteriitis (GCA) auftritt, als hypoechoischer Rand um das Gefäß, der als Halo-Zeichen bezeichnet wird (Abb. 2).
Eine Stenose kann durch die Visualisierung der arteriellen Lumenverengung im Graustufen- oder Dopplerfluss bestätigt werden. Eine aktuelle Studie hat Magnetresonanzangiografie (MRA) und Ultraschall bei GCA verglichen.4 Insgesamt zeigte der Ultraschall sowohl bei neu aufgetretener als auch bei chronischer Erkrankung häufiger für eine Vaskulitis typische Veränderungen als die MRA. Im Vergleich zur kontrastverstärkten MRA war der Ultraschall empfindlicher bei der Erkennung vaskulitischer Veränderungen in den großen Arterien, einschließlich der Arteria axillaris, der Arteria carotis und der Arteria subclavia. Bei der Beurteilung der kranialen Gefäße schnitt der Ultraschall ähnlich gut ab wie die MRA. Weniger als die Hälfte der Patienten mit aktiver Arteriitis zu Beginn der Untersuchung, d. h. mit Halo-Zeichen auf dem anfänglichen US, hatten bei der Nachuntersuchung nach 5 Monaten eine Auflösung der Symptome. Ultraschallzeichen persistierten häufiger in der Arteria axillaris und subclavia und veränderten sich eher in der Arteria temporalis superficialis.5 Diese Daten unterstützen die Empfehlung, dass Ultraschall als Erstuntersuchung bei Patienten mit Verdacht auf GCA in Betracht gezogen werden sollte.
Differenzialdiagnose bei Früharthritis
Die Differenzialdiagnose bei Früharthritis ist nach wie vor eine Herausforderung, und es sollte nicht überraschen, dass schon von Anfang an Hoffnungen in die Bildgebung gesetzt wurden. Die Früharthritis ist nach wie vor eine der Hauptanwendungen des muskuloskelettalen Ultraschalls, doch seine genaue Rolle bei der Unterstützung der Diagnose ist noch nicht klar definiert. Eine kürzlich durchgeführte systematische Literaturübersicht, die die häufigsten rheumatischen Erkrankungen umfasste, befasste sich mit dieser Frage und schloss relevante, bereits veröffentlichte SLRS (systematische Literaturrecherchen) zur diagnostischen Rolle des Ultraschalls bei den einzelnen Erkrankungen ein.6 Während die Zuverlässigkeit für einzelne Ultraschallveränderungen als gut befunden wurde und eine konsistente Menge an Literatur die diagnostische Anwendung des Ultraschalls untersuchte, war seine diagnostische Leistung über die verschiedenen Erkrankungen hinweg äußerst variabel. Nur in einer Minderheit der Fälle wurde sein zusätzlicher Wert gegenüber der klinischen Diagnose getestet. Dieses Ergebnis unterstreicht die Notwendigkeit von Studien mit einem pragmatischen Design, um die Platzierung des Ultraschalls im diagnostischen Pfad der neu auftretenden Arthritis zu identifizieren.
Strukturelle Schäden
Noch bevor sich eine frühe Arthritis bemerkbar macht, wird die Bildgebung und damit der Ultraschall eingesetzt, um das Vorhandensein einer Synovitis (und Tenosynovitis) bei Risikopersonen zu bestätigen (typischerweise definiert als Patienten mit Anti-CCP- oder Rheumafaktor-Antikörpern ohne klinische Synovitis, mit oder ohne Arthralgie). Eine Reihe von Studien in den letzten Jahren hat den Wert des Ultraschalls bei der Vorhersage der Progression zu einer entzündlichen Arthritis bei solchen Personen gezeigt.7, 8 Neben der Synovitis sind strukturelle Schäden ein charakteristisches Merkmal der rheumatoiden Arthritis, wobei letztere bis vor kurzem so etwas wie ein Stiefkind in Sachen Ultraschall war. Dies lag zum einen an der einfachen und weit verbreiteten Anwendung der konventionellen Röntgenuntersuchung und zum anderen an der Fokussierung auf entzündliche Veränderungen, die als klarer Vorteil der sonografischen Methode im Vergleich zum konventionellen Röntgen gesehen wurde und wird. Anstatt entzündliche Veränderungen zu untersuchen, fand eine neuere Studie heraus, dass Ultraschall-Erosionen in den Füßen (ein seit langem anerkanntes Gebiet für die frühe Entwicklung von Erosionen) das Fortschreiten zu einer entzündlichen Arthritis vorhersagen.9 Strukturelle Schäden, einschließlich Knorpelverlust und Erosionen, können jedoch auch eine Rolle bei der Erklärung der Gelenkschmerzen spielen, insbesondere bei Patienten mit fortgeschrittener Erkrankung.10
Kalziumpyrophosphat-Kristallarthropathie
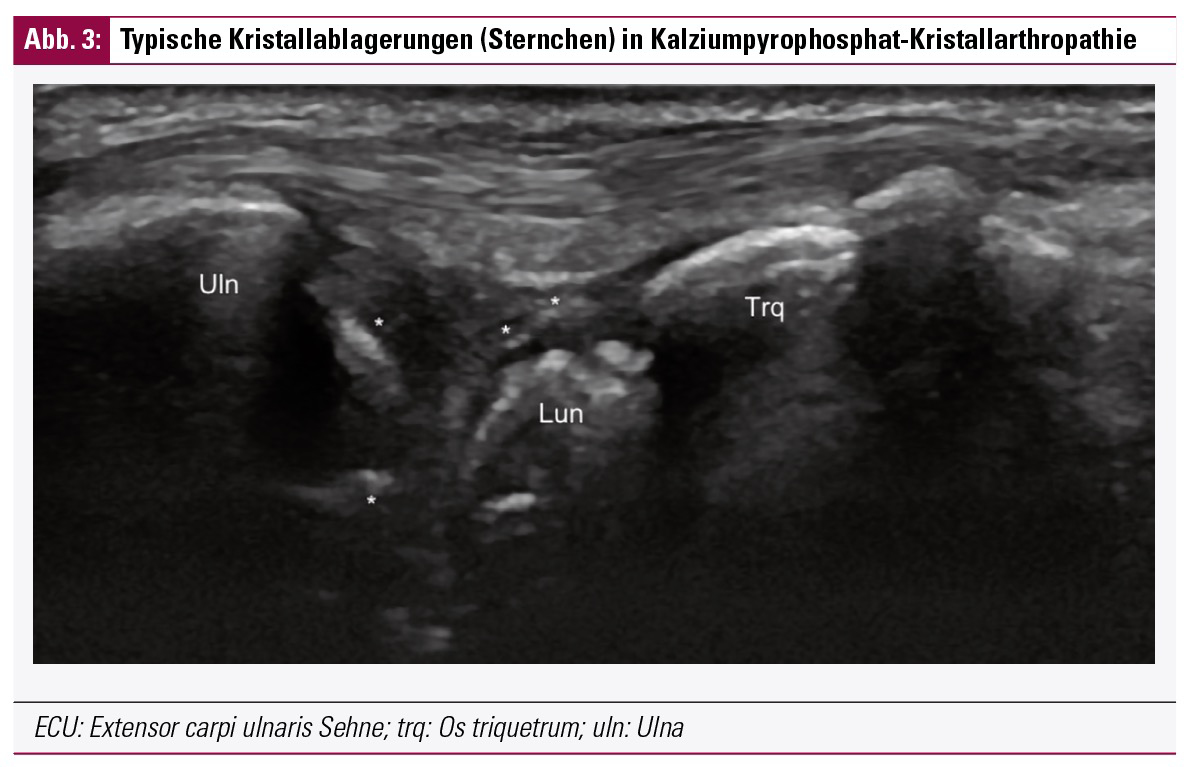
Die Kalziumpyrophosphat-Kristallarthropathie (Kalziumpyrophosphat-Dihydrat-Ablagerungskrankheit, CPPD) ist eine komplexe Erkrankung mit einem breiten Spektrum an klinischen und bildgebenden Manifestationen.10 Seit langem als eine Indikation von besonderem Interesse in Bezug auf den Ultraschall betrachtet, führte die OMERACT Ultrasound Task Force eine Studie zur Unterscheidungsfähigkeit des Ultraschalls durch, wobei die mikroskopische Analyse der Menisken und des hyalinen Knorpels des Knies als Referenzstandard verwendet wurde. In dieser großen, multizentrischen Studie lag die diagnostische Gesamtgenauigkeit des Ultraschalls für CPPD bei 75 %, wobei die beste Sensitivität und Spezifität durch die Beurteilung des medialen Meniskus und des Knorpels des medialen Femurkondylus erreicht wurde.11 Interessanterweise wurden keine Unterschiede in Bezug auf Ultraschall-Entzündungszeichen zwischen Patienten mit Arthrose mit oder ohne CPPD gefunden. Traditionelle Untersuchungsbereiche außerhalb des Kniegelenks sind der trianguläre fibrokartilaginäre Komplex (TFCC, Discus triangularis) des ulnaren Handgelenks (Abb. 3), wobei neuere Studien weitere Regionen wie das Ligamentum scapholunatum und die Gelenklippe des Hüftgelenkes (Labrum acetabulare) hervorheben.12–14
- Lepri G, Orlandi M, Lazzeri C, et al.: The emerging role of lung ultrasound in COVID-19 pneumonia. Eur J Rheumatol 2020; 7(Suppl. 2): S129–S133
- Gutierrez M, Soto-Fajardo C, Pineda C, et al.: Ultrasound in the Assessment of Interstitial Lung Disease in Systemic Sclerosis: A Systematic Literature Review by the OMERACT Ultrasound Group. J Rheumatol 2020 Jul 1; 47(7): 991–1000
- Delle Sedie A, Terlsev L, Bruyn GAW et al.: Definition and standardization of interstitial lung disease assessment by ultrasound: results from a Delphi process and web-reliability exercise by the OMERACT Ultrasound Working Group (WG). Ann Rheum Dis 2020; 78(Suppl. 2): 834.1
- Yip A, Jernberg ET, Bardi M. et al.: Magnetic resonance imaging compared to ultrasonography in giant cell arteritis: a cross-sectional study. Arthritis Res Ther 2020; 22:247
- Ford JA, DiIorio MA, Huang W, Sobiesczcyk P, Docken WP, Tedeschi SK: Follow-up vascular ultrasounds in patients with giant cell arteritis. Clin Exp Rheumatol 2020; 38 (Suppl. 124[2]): 107–111
- Sakellariou G, Scirè CA, Adinolfi A, et al.: Differential Diagnosis of Inflammatory Arthropathies by Musculoskeletal Ultrasonography: A Systematic Literature Review. Front Med (Lausanne) 2020; 7:141
- Nam JL, Hensor EM, Hunt L, et al.: Ultrasound findings predict progression to inflammatory arthritis in anti-CCP antibody-positive patients without clinical synovitis. Ann Rheum Dis 2016; 75: 2060–7
- van Beers-Tas MH, Blanken AB, Nielen MMJ, et al.: The value of joint ultrasonography in predicting arthritis in seropositive patients with arthralgia: a prospective cohort study. Arthritis Res Ther 2018; 19(20): 279
- Di Matteo A, Mankia K, Duquenne L, et al.: Ultrasound erosions in the feet best predict progression to inflammatory arthritis in anti-CCP positive at-risk individuals without clinical synovitis. Ann Rheum Dis 2020; 79(7): 901–907
- Gessl I, Popescu M, Schimpl V, et al.: Role of joint damage, malalignment and inflammation in articular tenderness in rheumatoid arthritis, psoriatic arthritis and osteoarthritis. Ann Rheum Dis 2021 Jan 12; doi: 10.1136/annrheumdis-2020-218744. Online ahead of print.
- Filippou G, Filippucci E, Mandl P, Abhishek A: A critical review of the available evidence on the diagnosis and clinical features of CPPD: do we really need imaging? Clin Rheumatol 2020 Nov 24; doi: 10.1007/s10067-020-05516-3
- Filippou G, Scanu A, Adinolfi A, et al.: Criterion validity of ultrasound in the identification of calcium pyrophosphate crystal deposits at the knee: an OMERACT ultrasound study. Ann Rheum Dis 2021; 80(2): 261–267
- Cipolletta E, Smerilli G, Mashadi Mirza R, et al.: Sonographic assessment of calcium pyrophosphate deposition disease at wrist. A focus on the dorsal scapho-lunate ligament. Joint Bone Spine 2020; 87(6): 611–617
- Di Matteo A, Filippucci E, Cipolletta E, et al.: Hip Involvement in Patients With Calcium Pyrophosphate Deposition Disease: Potential and Limits of Musculoskeletal Ultrasound. Arthritis Care Res (Hoboken) 2019; 71(12): 1671–1677