Anthrazyklintherapie gynäkologischer Malignome – Volle Wirksamkeit auch bei Risikofaktoren und nach Vorbehandlung
Iden 1980er-Jahren wurden randomisierte, kontrollierte Studien initiiert, um die Rolle der Anthrazykline im adjuvanten Setting zu evaluieren. „Es handelt sich um außerordentlich effektive Zytostatika, die bei vielen Tumoren aktiv sind, insbesondere bei gynäkologischen Karzinomen“, konstatierte Prof. Dr. Christian Marth, Univ.-Klinik für Frauenheilkunde, Medizinische Universität Innsbruck. Vor allem bei HER2-positiven Mammakarzinom-Patientinnen lassen sich ausgezeichnete Ergebnisse erzielen.
Schwachstelle Herz
Ein generelles Problem der Anthrazyklintherapie resultiert allerdings aus der Kardiotoxizität der Substanzen. Zu den möglichen Komplikationen zählen Arrhythmien, ischämische Komplikationen (Angina pectoris, Herzinfarkt), Hypertonie, Thromboembolie und als wichtigste Entität die dilatative Kardiomyopathie. Einschlägige Risikofaktoren umfassen hohe kumulative Anthrazyk – lindosis, hohe Einzeldosen, kurze Infusionsdauer/Bolusgabe, kardiale Vorerkrankungen/Risikofaktoren, gleichzeitige oder vorangegangene Mediastinalbestrahlung und hohes (oder sehr junges) Alter. Neben den Anthrazyklinen können auch andere für die Behandlung des Mammakarzinoms relevante Substanzen wie Trastuzumab oder Paclitaxel das Herz schädigen. Marth: „Gleichzeitig besteht derzeit aber ein Trend zur Kombination von Anthrazyklinen mit zielgerichteten Therapien.“
Zu einer wesentlichen Reduktion der Kardiotoxizität kann die Aufbereitung des Wirkstoffs in liposomaler Form beitragen. Dabei wird die Substanz in kolloidale Partikel verpackt, die aus einer Lipiddoppelschicht und einem wässrigen inneren Milieu bestehen. „Im intakten Blutgefäß prallen die Liposomen an den Endothelzellen ab, wodurch der Wirkstoff nicht freigesetzt wird“, erklärte Marth. Anders verhält es sich bei einem gestörten Gefäßsystem mit größeren Poren, wie es in Tumoren vorliegt. „Das Resultat ist eine Anreicherung in neoplastischen Zellen unter Schonung des gesunden Gewebes.“
Pharmakologische Alternativen
Liposomal verkapselte Formulierungen von Doxorubicin stehen in der Gynäkologie als Myocet® (nicht-pegyliertes liposomales Doxorubicin, NPLD) und Caelyx® (pegyliertes liposomales Doxorubicin) zur Verfügung. NPLD ist für die Erstlinientherapie des metastasierten Mammakarzinoms zugelassen. Als präklinische Eigenschaften dieser Formulierung nannte Marth die geringere Kardiotoxizität und herabgesetzte gastrointestinale Toxizität sowie die verringerte Neutropenie. Gleichzeitig reichert sich NPLD im Tumor und an Metastasenlokalisationen (z. B. Leber und Knochenmark) an. Ein von Batist et al. durchgeführter Direktvergleich mit konventionellem Doxorubicin bestätigt die wesentlich reduzierte Kardiotoxizität von NPLD1.
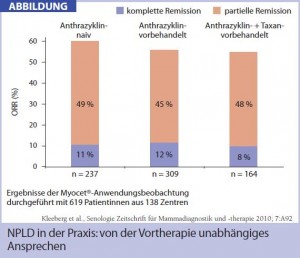
Neben dieser Studie beinhalten zwei weitere mit NPLD durchgeführte Phase-III-Untersuchungen Head-to-Head-Vergleiche in der metastatischen Situation beim Mammakarzinom. Harris et al. setzten konventionelles Doxorubicin im Kontrollarm ein2, Chan et al. Epirubicin (jeweils zusammen mit Cyclophosphamid) 3. „Die Gesamtansprechraten waren jeweils vergleichbar, bei Patientinnen nach Anthrazyklin-Vorbehandlung fanden sich jedoch in den experimentellen Armen höhere Responseraten als in den Vergleichsarmen“, berichtete Marth. Auch eine andere Studie von Batist et al. belegte bei Anthrazyklin-vorbehandelten Teilnehmerinnen im Vergleich zu konventionellem Doxorubicin eine signifikant höhere Ansprechrate (31 % vs. 11 %; p = 0,04) und eine längere Zeitspanne bis zum Therapieversagen (4,2 vs. 2,1 Monate p = 0,01)4. In einer Anwendungsbeobachtung mit NPLD bei 619 Patientinnen zeigten die Gesamtansprechraten keine Variation in Abhängigkeit von einer eventuellen Vortherapie mit Anthrazyklinen und Taxanen (Abb.).5
Universelle Einsetzbarkeit
„Eine wiederholte Behandlung mit Anthrazyklinen macht definitiv Sinn, da mit einem guten Ansprechen gerechnet werden kann“, betonte Marth. „Natürlich können aber konventionelle Anthrazykline kein zweites Mal verwendet werden, da sonst eine kardiotoxische Dosis erreicht wird.“ Durch die Verfügbarkeit von NPLD eröffnet sich bei diesen Patientinnen die Chance auf eine neuerliche Anthrazyklin-Exposition, ebenso bei älteren Personen sowie bei Patientinnen mit kardialer Vorbelastung. Vorteilhaft gestaltet sich weiters die gute Kombinationsfähigkeit der Substanz mit kardiotoxischen Partnern. Als außerordentlich effektives Schema bei HER2-positiven Patientinnen nannte Marth die Kombination aus NPLD, Trastuzumab und Paclitaxel. In der Studie von Cortés et al. konnte damit ein Ansprechen bei fast allen Teilnehmerinnen und eine beachtliche Zeit bis zur Progression von 22,1 Monaten erreicht werden6. „Dabei blieb die linksventrikuläre Auswurffraktion konstant“, unterstrich der Experte. Verglichen mit der konventionellen Formulierung lassen sich unter NPLD insgesamt geringere Raten an Neutropenien und Diarrhöen sowie Übelkeit/Erbrechen feststellen.7 Bedeutsam für die Lebensqualität ist weiters das Fehlen schwerer Hautreaktionen. Ebenso wie für konventionelles Doxorubicin gelten Dosisempfehlungen von 60–75 mg/m2 alle drei Wochen, wobei Myelosuppression bei beiden Formulierungen die dosislimitierende Toxizität darstellt. Pegyliertes liposomales Doxorubicin weist hingegen neue dosislimitierende Toxizitäten wie Hand- Fuß-Syndrom und Stomatitis/Mukositis auf.
Ausblick: neoadjuvantes Setting, Ovarialkarzinom
Angesichts der guten Wirksamkeits- und Verträglichkeitsdaten drängt sich ein frühzeitigerer Einsatz der Therapie im Behandlungskonzept auf. Zwei Untersuchungen evaluieren NPLD in diesem Kontext (Kasten). Während eine Studie mit zwei Armen gerade läuft, wird die 4-armige ABCSG-32 demnächst in Österreich gestartet. „Diese wird zeigen, ob durch die Kombination eines optimalen Chemotherapieschemas mit einem optimalen biologischen Schema die schon jetzt sehr guten kompletten Remissionsraten noch verbessert werden können“, so Marth. In der Therapie des Ovarialkarzinoms erleben die Anthrazyk – line derzeit ein Revival. „Zweifellos ist NPLD auch in dieser Indikation aktiv“, erklärte Marth. Eine italienische Studie erbrachte einen klinischen Benefit von 55 % bei platinresistentem Ovarialkarzinom.8 Die unter vergleichbaren Bedingungen durchgeführte Untersuchung von Eichbaum ergab in insgesamt 20 % eine partielle bzw. komplette Remission.9 Marth: „Das sieht man bei diesem schwer vorbehandelten Patientengut nicht sehr häufig.“ In der derzeit rekrutierenden randomisierten Phase-II-Studie AGO-10 kommt NPLD in Kombination mit Gemcitabin im Vergleich zu NPLD alleine bei platinrefraktärem bzw. -resistentem Ovarialkarzinom zum Einsatz.
Zukunftsperspektive Endometriumkarzinom
Eine Entität mit Zukunftspotenzial im Zusammenhang mit der NPLD-Therapie stellt das Endometriumkarzinom dar. In einer Phase-II-Studie der AGO konnte bei Patientinnen mit fortgeschrittener oder rezidivierter Erkrankung eine exzellente Ansprechrate unter NPLD und Carboplatin demonstriert werden.10 Marth: „48 % erzielten bei vertretbarer Toxizität einen klaren Benefit.“ Im Vergleich zu Daten mit anderen Anthrazyklin-Studien in der Literatur resultierten sehr günstige Toxizitätsraten mit geringen Inzidenzen im Bereich von Leukopenie, Thrombopenie und Anämie. „Letztlich kam es auch kaum zum Auftreten von neutropenischem Fieber und nicht-hämatologischen Toxizitäten.“ Es wurden keine kardialen und renalen Toxizitäten verzeichnet. „Ich gehe davon aus, dass das Endometriumkarzinom eine wichtige zukünftige Indikation für NPLD ist, möglicherweise auch in der adjuvanten Situation“, schloss Marth.
Quelle: Vortrag im Rahmen der XX. Wissenschaftlichen Tagung der Arbeitsgemeinschaft
für gynäkologische Onkologie, 5.-7. Mai 2011, Salzburg
1 Batist G. et al., J Clin Oncol 2001; 19 (5):1444-1454
2 Harris L. et al., Cancer 2002; 94:25-36
3 Chan S. et al., Ann Oncol 2004; 15:1527-1534
4 Batist G. et al., Anticancer Drugs 2006; 17:587-595
5 Kleeberg et al., Senologie – Zeitschrift für Mammadiagnostik und -therapie 2010; 7:A92
6 Cortés J. et al., Clin Cancer Res 2009; 15 (1):307-314
7 Van Dalen E.C. et al., Cochrane Database Syst Rev 2010; 5:CD005006
8 Perniola G. et al., Int J Gynecol Cancer 2007; 17:88-93
9 Eichbaum et al., 58. Kongress der Deutschen Gesellschaft für Gynäkologie und
Geburtshilfe, 2010, PO-Onko 01.99
10Volgger B. et al., 14th Biennial Meeting of the International Gynecologic Cancer
Society 2010; Abstr 2010_628