ASCO 2012: Ernüchterung zu PARP-Inhibitoren beim Mamma- und Ovarialkarzinom
Den großen Hoffnungen, die vor einigen Jahren in PARP-Inhibitoren gesetzt worden sind, ist Ernüchterung gewichen. Dieser Artikel soll einen Überblick über die Entwicklungsgeschichte der wichtigsten PARP-Inhibitoren geben, wichtige Studien aufzeigen und Neuigkeiten vom diesjährigen ASCO präsentieren.
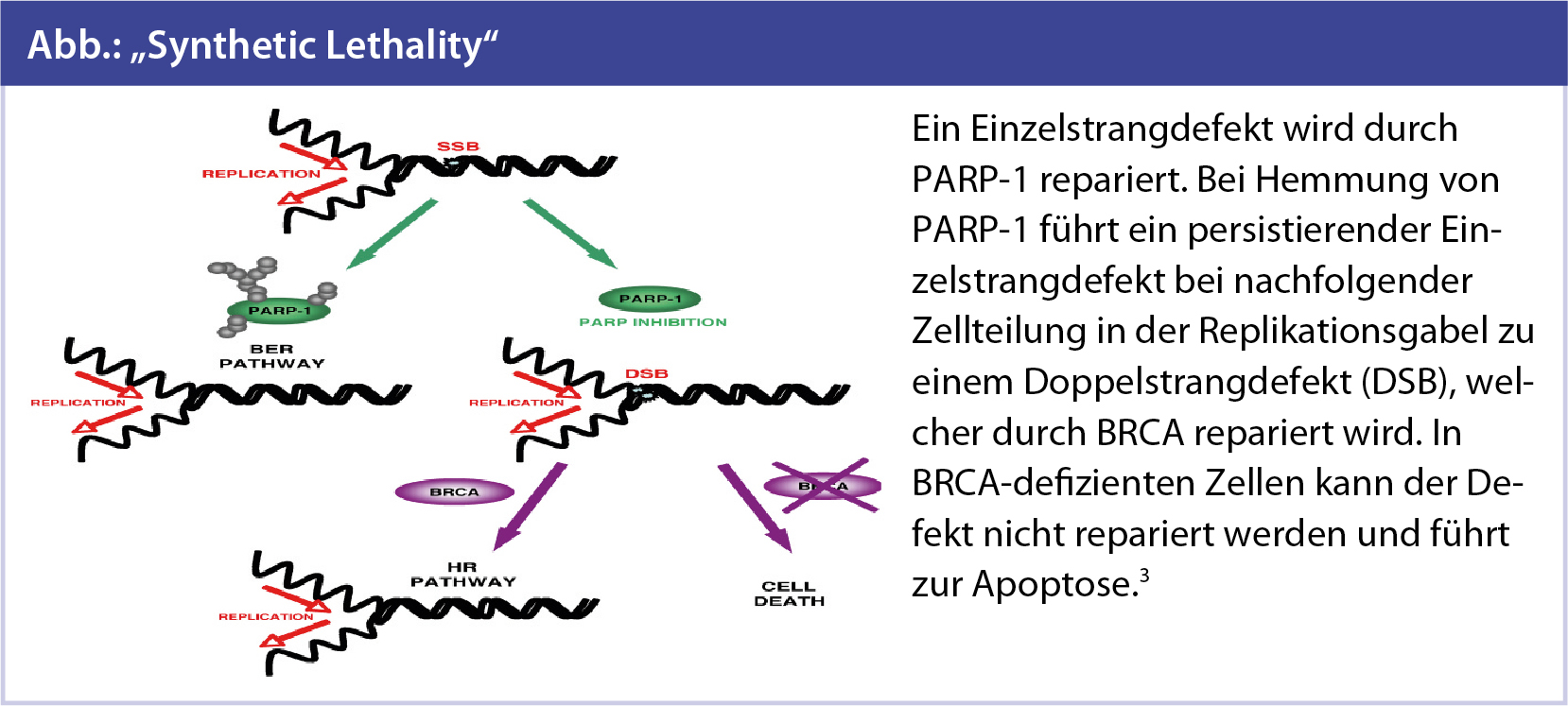
Theorie dahinter: „Synthetic Lethality“
Die Bewahrung des genetischen Codes ist von zentraler Bedeutung für das Überleben einer Zelle. Die Zelle verfügt über effiziente DNA-Reparaturmechanismen, die die Integrität der Erbsubstanz gewährleisten.
Dafür benötigt die Zelle Einzel- und Doppelstrang-Reparatursysteme, um sich vor Mutationen, entstanden durch Umwelteinflüsse, durch endogene Stoffwechselprozesse oder durch fehlerhafte DNA-Replikation zu schützen. Mutationen in diesem Sicherheitssystem der Zelle können zur Anhäufung mutierter DNA und zur Entstehung maligner Zellen führen.
Die Enzyme der PARP-Familie (Poly-ADP-Ribose-Polymerase), erstmals vor 40 Jahren beschrieben, sind beteiligt an unterschiedlichsten Signalwegen, doch vor allem die Enzyme PARP-1 und PARP-2 sind für das Aufdecken und die Reparatur von DNA-Einzelstrangbrüchen verantwortlich.
Es wurde der Begriff der „Synthetic Lethality“ geprägt. Dies beschreibt ein Therapiekonzept, in dem der Funktionsverlust eines Gens nicht zur Apoptose führt, die Kombination zweier defekter Gene von DNA-Reparatursystemen für die Tumorzelle jedoch zytotoxisch ist. Die Inhibition von PARP führt zur Anhäufung von DNA-Doppelstrangbrüchen in der Zelle. In Zellen mit Mutationen in DNA-Doppelstrangreparaturmechanismen, wie wir es in BRCA-1/-2-assoziierten Tumoren finden, führt dies zum Kollaps und bedeutet für die Tumorzellen den Zelltod.
Basierend auf präklinischen Daten wurden mehrere PARP-Inhibitoren entwickelt und vor allem ihr Einsatz in der Therapie hereditärer BRCA-1/-2-assoziierter Malignome weckte Hoffnungen für die Behandlung dieser aggressiven Erkrankungen.1, 2
Einsatz bei Mammakarzinom
Oleparib: Einer der ersten Vertreter der PARP-Inhibitoren, der in die klinische Testung gelangte, war Olaparib. Fong et al. (2009) testeten Olaparib in einer Phase-I-Dosisfindungsstudie bei Patienten mit unterschiedlichen BRCA-1/-2-assoziierten Malignomen. Man konnte in der Subgruppenanalyse der BRCA-Mutationsträger ein objektivierbares Ansprechen anhand der Recist-Kriterien sehen. Es wurde über ein gutes Verträglichkeitsprofil berichtet, die Nebenwirkungen, generell reversibel, waren dosisabhängig, vor allem Fatiguesymptomatik und Nausea.
Nach diesen ersten vielversprechenden Daten aus Phase-I-Studien wurde der Einsatz von Olaparib in einer Phase-II-Studie bei Patienten mit BRCA-1/-2-assoziiertem Brustkrebs untersucht. In der Studie, präsentiert von Tutt et al., bekamen 54 mehrfach vorbehandelte Patienten entweder 100 oder 400 mg Olaparib 2-mal täglich. In der 400-mg-Gruppe sah man eine Ansprechrate von 41 % im Vergleich zu 22 % in der 100-mg-Gruppe, die mittlere Zeit zur Progression betrug 5,7 im Vergleich zu 3,8 Monaten. Zum jetzigen Zeitpunkt liegen keine Daten aus Phase-III-Studien über den Einsatz von Olaparib beim Mammakarzinom vor. Es befinden sich weitere Phase-I/-II-Studien, die Olaparib in Kombination mit Chemotherapie untersuchen, in der Rekrutierung.4
Veliparib: Ein weiterer Vertreter der PARP-1/-2-Inhibitoren ist Veliparib. Isakoff et al. konnten in der Kombination mit dem Chemotherapeutikum Temozolomid ein objektivierbares Ansprechen bei Patienten mit Mammakarzinom erkennen, jedoch beschränkt auf BRCA-1/-2-positive Patienten.2
Beim diesjährigen ASCO präsentierten Somlo et al. erste Daten einer Phase-I-Studie über den Einsatz von Veliparib plus Carboplatin beim metastasierten BRCA-1/-2-positiven Mammakarzinom. Sowohl Nebenwirkungsprofil als auch Antitumoraktivität waren zufriedenstellend. Eine Phase-II-Studie zur besseren Evaluierung ist in Planung. Im Gegensatz dazu konnte in einer weiteren Studie mit Veliparib in Kombination mit Cyclophosphamid kein Vorteil in der Kombination gefunden werden.5
Über Veliparib liegen derzeit sicher die meisten Daten vor, jedoch sind auch hier aktuell keine Phase-III-Studien beim Mammakarzinom geplant.
Iniparib: Ursprünglich war auch Iniparib ein vielversprechender Vertreter der PARP-Inhibitoren. Jedoch in Untersuchungen, publiziert Anfang des Jahres, zeigte sich, dass Iniparib nicht PARP-1/-2 hemmt, sondern über andere Methoden in die DNA-Reparaturmechanismen eingreift, also nicht zu dieser Gruppe zu zählen ist. Doch gerade mit Iniparib in der Therapie des triplenegativen Mammakarzinoms zeigten sich anfangs große Erfolge und es entstand initial ein regelrechter Hype um den Einsatz von PARP-Inhibitoren.
O’Shaugnessy et al. untersuchten die Wirkung von Iniparib in Kombination mit Chemotherapie versus Chemotherapie allein an metastasierten triplenegativen Mammakarzinomen. Diese Tumoren ähneln in ihrem aggressiven Verhalten, dem Fehlen von Östrogen-, Progesteron- und HER2-Rezeptoren und in ihrer Sensitivität für platinhaltige Chemotherapie dem hereditären BRCA-1/-2-assoziierten Mammakarzinom. Man fasste diese Eigenschaften unter dem Begriff „BRCAness“ zusammen. In diesen Tumorzellen findet man einen hohen Grad an genomischer Instabilität, unter anderem Defekte in DNA-Reparaturmechanismen wie der homologen Rekombination zur Reparatur von Doppelstrangbrüchen.
In der Studie von O’Shaugnessy et al. erhielten die Patientinnen die Kombinationstherapie Carboplatin/Gemcitabine plus Iniparib bzw. Chemotherapie alleine. In dieser Studie konnte eine statistisch signifikante Verbesserung des Gesamtüberlebens und des progressionsfreien Überlebens für die Kombinationstherapie gesehen werden.
Diese Ergebnisse führten zur Initialisierung einer weiterführenden Phase-III-Studie mit demselben Therapieprotokoll. Die Daten wurden mit Spannung erwartet und am ASCO 2011 präsentiert. Trotz der vielversprechenden Ergebnisse der Phase-II-Studie zeigte sich keine statistische Signifikanz, weder in der Verbesserung des Gesamtüberleben noch des progressionsfreien Überlebens. Als Ursache wurde unter anderem eine Unausgeglichenheit in der Randomisierung diskutiert. In ungeplanten Einzelauswertungen der Second- bzw. Third-Line-Patienten konnte statistische Signifikanz im progressionsfreien und im Gesamtüberleben gesehen werden. Ob dieses Ansprechen jedoch nur für einen noch nicht definierten Subtyp des triplenegativen Karzinoms gilt oder ob die Zahl der Vortherapien eine Rolle spielt, bleibt zurzeit noch unklar. Weiter im Dunkeln bleibt auch der eigentliche Wirkmechanismus von Iniparib bzw. die Zuordnung dieses Wirkstoffs zu einer Substanzklasse.2, 3, 6 Es sind derzeit keine weiteren Studien über den Einsatz von Iniparib beim Mammakarzinom gelistet.
Einsatz bei Ovarialkarzinom
Auch bei einem weiteren gynäkologischen Malignom wurde der Einsatz von PARP-Inhibitoren untersucht. Trotz vieler neuer Therapieoptionen ist das Ovarialkarzinom das gynäkologische Malignom mit der höchsten Mortalität. Die operative radikale Tumorreduktion gefolgt von platinhaltiger Chemotherapie mit Bevacizumab stellt die Therapie der Wahl dar und trotz guten Ansprechens auf die First-Line-Therapie rezidiviert ein Großteil der Patienten. Die Zeit bis zur Progression nach Gabe von Chemotherapie ist ein wichtiger Prognosefaktor für das weitere Überleben der Patientin. Kommt es innerhalb der ersten 6 Monate zu einem Rezidiv, so spricht man von platinresistenten Tumoren, bei einem Intervall zur Progression länger als 6 Monate ist eine erneute Therapie mit platinhaltigen Chemotherapeutika möglich.
Eine Mutation im BRCA-1- bzw. BRCA-2-Gen führt neben dem hohen Risiko, an einem Mammakarzinom zu erkranken, auch zu einem 60%- bzw. 20%-Risiko für Ovarialkarzinome.7 Doch nur in einem kleinen Teil aller Karzinome liegt eine Keimbahnmutation im BRCA-1 oder B
RCA-2-Gen zugrunde. Der größte Teil der Ovarialtumoren entsteht sporadisch.
Doch auch beim serösen Grad-3-Ovarialkarzinom existiert der Begriff der „BRCAness“, der in sporadischen Tumoren den Verlust von Doppelstrangreparaturmechanismen, wie der homologen Rekombination, beschreibt, z. B. durch epigenetische Veränderungen in BRCA-Promotoren. Diese Tumoren sind sensibel auf DNA-schädigende Substanzen, die DNA-Doppelstrangbrüche hervorrufen, wie PARP-Inhibitoren oder platinhaltige Chemotherapie.7, 8
Olaparib in Monotherapie: In den ersten Studien wurden PARP-Inhibitoren als alleinige Monotherapie getestet. Es konnte ein Ansprechen von Olaparib in BRCA-1/-2-mutierten Ovarialkarzinomen gezeigt werden. Audeh et al. konnten in 61 % entweder ein partielles oder ein komplettes Ansprechen auf Olaparib in einer Dosierung von 400 mg täglich feststellen.7
Doch auch beim sporadischen „BRCAness“-Ovarialkarzinom konnte ein objektivierbares Ansprechen auf Olaparib als Monotherapie gesehen werden.
Eine interessante Phase-II-Studie von Ledermann et al., im NEJM publiziert, untersuchte den Einsatz von Olaparib als Erhaltungstherapie nach platinhaltiger Rezidivtherapie bei platinsensitiven, serösen, hochmalignen Tumoren. So zeigte der Einsatz von Olaparib in einer Dosis von 400 mg 2-mal täglich im Vergleich zu Placebo ein signifikant verbessertes progressionsfreies Überleben (8,4 vs. 4,8 Monate). Ein verbessertes Gesamtüberleben konnte zum jetzigen Zeitpunkt nicht festgestellt werden.9
Iniparib in Kombinationen: Der nächste Schritt folgte mit der Untersuchung von PARP-Inhibitoren in der Kombinationstherapie. Iniparib in Kombination mit Carboplatin und Gemcitabine bewirkte bei 41 an platinsensitivem, hochmalignem, serösem Ovarialkarzinom erkrankten Patienten in 65 % Antitumoraktivität. Parallel dazu führte dieselbe Kombinationstherapie bei platinresistenten Patienten zu keinem wesentlichen Ansprechen. Gerade in der Kombination mit Chemotherapie wurde eine erhebliche Nebenwirkungsrate beobachtet: 71 % Fatiquesymptomatik, 72 % Grad-3–4-Thrombo- oder Neutropenien. Dies führte zu Dosisreduktionen in 85 % der Patienten.10
Beim diesjährigen ASCO-Meeting präsentierten verschiedene Gruppen Ergebnisse zur Kombinationstherapie von PARP-Inhibitoren mit Chemotherapie.
Oza et al. zeigten in einer Studie mit 156 Patienten mit platinsensitivem serösen Ovarialkarzinom, dass eine Kombinationstherapie mit Carboplatin (AUC 4, d1)/Taxol® (175 mg/m2, d1) plus Olaparib 200 mg 2-mal täglich gefolgt von Olaparib-Erhaltungstherapie vs. Carboplatin (AUC 6) und Taxol® (175 mg/m2) gefolgt von Placebo zu einem signifikant verbesserten progressionsfreien Überleben führt. Im Gesamtansprechen zeigte sich kein Unterschied. Für das Gesamtüberleben liegen derzeit noch keine Daten mit auszureichender Nachbeobachtungszeit vor.11
FAZIT UND AUSBLICK: Somit muss gesagt werden, dass die in diese Substanzgruppe gesetzten Erwartungen nicht erfüllt wurden. Man erwartete sich von PARP-Inhibitoren eine ähnliche Erfolgsgeschichte wie die des Herceptin® beim HER2+-Mammakarzinoms. Doch im Gegensatz zu Herceptin®, einem Antikörper mit definiertem Zielantigen, ist die Wirkungsweise der PARP-Inhibitoren viel komplexer. Die Enzyme PARP-1 und PARP-2 sind durch verschiedene Mechanismen in der Reparatur von DNA-Einzelstrangbrüchen beteiligt. Weiters wirken PARP-Inhibitoren vor allem in Kombination in Zellen mit defizienten DNA-(Doppelstrang-)Reparaturmechanismen. Hier könnte die maßgeschneiderte onkologische Therapie zu spezifisch sein.
Beim BRCA-1/-2-positivem Mammakarzinom konnte ein deutliches Ansprechen auf die Therapie mit dem PARP-Inhibitor Olaparib nachgewiesen werden. Trotzdem erfüllte das Ergebnis die Erwartungen nicht, wodurch auch seitens der akademischen Gemeinschaft und der Pharmafirmen das Interesse an diesem Wirkstoff sank.
Ähnlich verlief auch die Karriere von Iniparib beim triplenegativen Mammakarzinom, eine Tumorentität, die dem hereditären Mammakarzinom in vielen Eigenschaften ähnelt. Auch hier spielen defiziente DNA-(Doppelstrang-)Reparaturmechanismen eine Rolle in der Tumorentstehung, nach bisherigem Wissensstand eine Voraussetzung für das Wirken von PARP-Inhibitoren. Die nach ersten positiven Daten mit Spannung erwarteten Ergebnisse von O’Shaugnessy et al. konnten jedoch in der Phase-III-Studie nicht bestätigt werden.
Aus den bisherigen Studien lässt sich eines herauslesen: PARP-Inhibitoren zeigen gewisses Potenzial in der onkologischen Therapie, jedoch nur in sehr spezifischen Tumorentitäten, die es zu identifizieren gilt. Genau dies stellt die Herausforderung im zukünftigen Einsatz dar. Lassen sich anhand von speziellen Biomarkern oder Genprofilen die richtigen Patienten herausfiltern? Gelingt es, ähnlich den in der Klinik zur Anwendung kommenden Genassays zur Risikoprofilerstellung, das Ansprechen auf Chemotherapie bzw. auf PARP-Inhibitoren vorauszusagen?
Ein weiteres Problem liegt sicher auch im teilweise erheblichen Anstieg der Nebenwirkungen in Kombination mit Chemotherapie. Hier muss die richtige Kombination evaluiert werden. Wenn eine Dosisreduktion notwendig ist, soll die Dosis der Chemotherapie oder die des PARP-Inhibitors reduziert werden? Da derzeit vor allem Phase-I/II-Studien geplant sind, die sich mit der optimalen Kombinationstherapie beschäftigen, sollten diese Fragen zu beantworten sein.
Momentan am interessantesten erscheint derzeit die Anwendung von PARP-Inhibitoren in der Therapie des Ovarialkarzinoms. Gerade beim Ovarialkarzinom, wo die hohe Rezidivrate ein großes Problem darstellt, wäre eine Erhaltungstherapie ein großer Fortschritt. Die Studie von Ledermann et al. präsentiert vielversprechende Daten im Vergleich zu Placebo bei tolerierbarem Nebenwirkungsprofil von Olaparib in der Erhaltungstherapie.
Auch beim diesjährigen ASCO fanden sich ausschließlich einzelne Posterpräsentationen über den Einsatz von PARP-Inhibitoren beim Ovarialkarzinom. Neuere Daten beim Mammakarzinom gibt es wenige. Dies spiegelt das sinkende Interesse an PARP-Inhibitoren wider. Da jedoch die Theorie und der Wirkungsmechanismus hinter den PARP-Inhibitoren sehr elegant und schlüssig erscheinen, sollte man das Kapitel der PARP-Inhibitoren nicht verfrüht schließen. Es bleibt zu hoffen, dass der optimale Einsatz dieser Substanzgruppe noch gefunden wird.