Die Rolle der Ernährung in der Hämato-Onkologie
Nahrungsbedarf und Definition der Mangelernährung bei Tumorpatienten: Der tägliche Energiebedarf liegt bei 25-35 Kilokalorien pro Kilogramm Körpergewicht und Tag.
Bei Tumorpatienten ist in der Regel eine tägliche Eiweißzufuhr von 1,2 ± 1,5 g pro kg Körpergewicht sinnvoll. Auf eine ausreichende Versorgung mit Mikronährstoffen (Vitaminen, Spurenelementen) ist zu achten; als Minimum sollten die Zufuhrempfehlungen für die künstliche Ernährung gesunder Personen eingehalten werden.1 Wir sprechen von Mangelernährung bei Patienten mit einem Gewichtsverlust von mehr als 10% innerhalb der letzten 6 Monate bzw. mehr als 5% innerhalb eines Monats oder einem BMI von unter 18,5 (Abb. 1). Diese Parameter können schnell und einfach bei der Aufnahme von Patienten erhoben werden. Eine genauere Abschätzung kann mittels verschiedener standardisierter Screeningverfahren (SGA, MNI, MNA, NRI etc.) erfolgen, wobei beim NRI (Nutritional Risk Index) neben dem Körpergewicht auch noch der Albumingehalt mit einbezogen wird.
Tumorkachexie: Bei Tumorpatienten können der Tumor selbst sowie die Nebenwirkungen der lokalen bzw. systemischen Therapien den Ernährungszustand des Patienten negativ beeinflussen (Tab.). Zwischen 30 und 80%2,3 der Patienten haben als erstes Symptom ihrer Tumorerkrankung einen klinisch relevanten Gewichtsverlust von mehr als 10% ihres Ursprungsgewichts.
Der Tumor kann unzählige metabolische Effekte auslösen. Es kommt zu einer gesteigerten Lipolyse, Inappetenz mit erhöhtem Ruheumsatz und durch eine systemische inflammatorische Reaktion des Körpers auf den Tumor mit katabol wirkenden appetithemmenden und proinflammatorischen Zytokinen schließlich zur Tumorkachexie.4 Der Begriff “konsumierende Erkrankung” beschreibt dieses Zustandsbild sehr gut. Bei Patienten mit Pankreaskarzinom z.B. können – durch Krankheit und Katabolismus bedingt – die Aktivitäten auf die eines bettlägerigen Patienten absinken, was zu einem Eiweißverlust von ca. 300 g pro Woche führt.
Erhöhtes CRP und reduziertes Albumin sind als Indikator dieser systemischen inflammatorischen Reaktion ein unabhängiger Prognosefaktor (Glasgow-Index).
Das Abschätzen des Ernährungszustandes adipöser Tumorpatienten ist naturgemäß schwieriger. Ein Patient mit einem BMI von 30 kann 20% seines Körpergewichts abnehmen, um normalgewichtig zu werden, und würde erst bei einem BMI von unter 18,5 nach dem BMI als untergewichtig gelten. Dies würde bedeuten, dass ein 170 cm großer, 95 kg schwerer Patient erst nach einer Gewichtsabnahme von 35 kg einem Ernährungsteam vorgestellt wird. Die Kombination von reduzierter Nahrungsaufnahme und tumorassoziierter inflammatorischer Reaktion führt aber nicht zu einem Abbau der Fettmassen wie beim gesunden Fastenden, sondern zu einem Verlust von Körpereiweiß5 des funktionellen Körpergewebes6 wie Muskelmasse sowie Albumin. Auch verschiebt sich intrazelluläre Flüssigkeit in den extrazellulären Raum, und es kann zu einer Insulinresistenz mit Glukoseintoleranz im Spätstadium kommen.
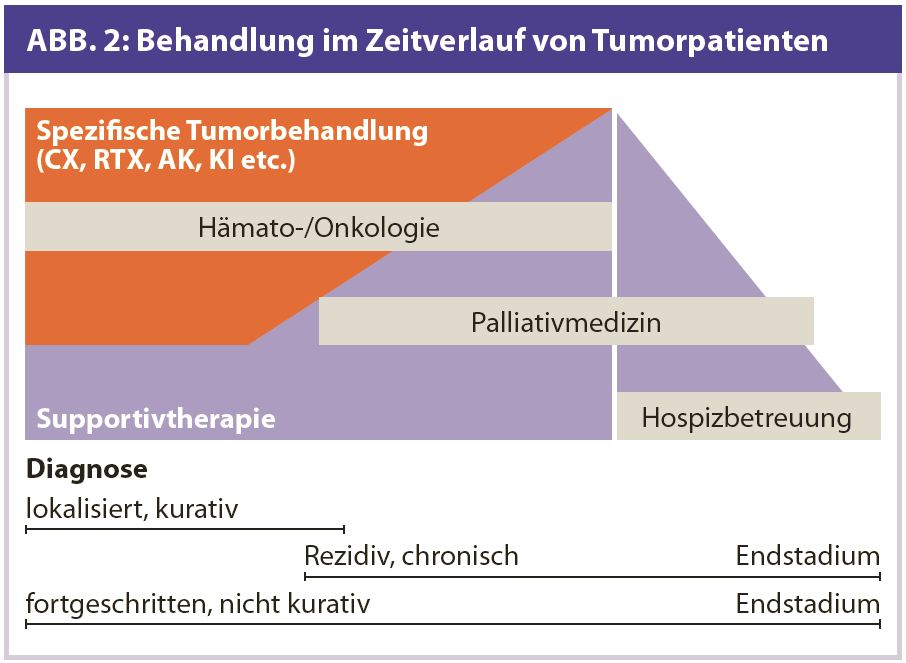
Behandlungsoptionen im Krankheitsverlauf: Gerade bei Tumorerkrankten ist die spezifische antitumoröse Therapie zeitlich limitiert und wird immer von supportivmedizinischen Maßnahmen begleitet. Patienten mit metastasiertem Kolorektalkarzinom mit einer Krankheitsdauer von 2-3 Jahren werden vor allem im höheren Alter oder bei Komorbiditäten nur circa 6 bis 12 Monate spezifisch mit Chemotherapie und/oder Antikörpern therapiert. In Europa sind 40% aller Patienten mit diagnostiziertem Kolorektalkarzinom über 75 Jahre alt (Eurocare), eine Population, die in keinen randomisierten Studien vertreten ist und die wahrscheinlich wegen bestehenden Komorbiditäten und erhöhten Nebenwirkungen der Therapien von einer zusätzlichen Ernährungstherapie profitieren könnte.
Prognostische Bedeutung des Gewichtsverlusts bei Tumorpatienten: Patienten mit Gewichtsverlust haben eine ungünstigere Prognose als Patienten, die ihr Gewicht stabil halten können.7,8 Weiters werden mehr behandlungsbedingte Nebenwirkungen bei Patienten, die an einem Gewichtsverlust leiden, beobachtet. Circa 30% der Patienten versterben an tumorbedingter Kachexie und Erschöpfung. Somit ist die Mangelernährung ein prognostischer Faktor, der die Lebensqualität und Tolerabilität von Chemotherapien negativ beeinflusst.9-12
Nach der Sepsis ist die Tumorkachexie die häufigste Todesursache bei Patienten, die an Tumoren erkranken.13 Interessanterweise ist z.B. der Eiweißgehalt des Körpers ein sehr aussagekräftiger Prädiktor für Neutropenie nach Chemotherapie bei Patientinnen mit Mammakarzinom.14 Es ist nicht klar, ob die Unterernährung per se oder die primär zugrunde liegende Erkrankung für die schlechte Prognose der Patienten verantwortlich ist.
Gerade bei Patienten mit HNO-Tumoren15, Pankreaskarzinomen16, Magenkarzinomen und Ösophaguskarzinomen spielt die Mangelernährung eine große Rolle. HNO-Tumorpatienten erreichen während der Lokaltherapie oft ein tägliches Kaloriendefizit von bis zu 900 Kilokalorien pro Tag – gerade hier kann eine Mangelernährung zum Abbruch einer potenziell kurativen Therapie führen.
Supportive Ernährungstherapie
Bezügliche supportiver Ernährungstherapie wird der behandelnde Arzt im klinischen Alltag mit folgenden Fragen befasst:17 Kann eine enterale/parenterale Ernährung den Ernährungszustand von Tumorpatienten aufrechterhalten oder verbessern, und kann diese die Lebensqualität der betroffenen Patienten verbessern? Eine konsequente Ernährungsberatung und Therapie kann den Ernährungszustand der betroffenen Patienten verbessern18 und scheint darüber hinaus die Lebensqualität und das Überleben mancher Tumorpatienten verbessern zu können.19-22
Es scheint aber wichtig zu sein, frühzeitig mit der Ernährungstherapie zu beginnen.23 Patienten im Endstadium ihrer Erkrankung, mit massiver diffuser Entzündungsreaktion und erheblichem Gewichtsverlust, können von einer Ernährungstherapie nur noch wenig profitieren. Leider ist die Datenlage bezüglich randomisierter Studien limitiert, und die meisten Empfehlungen beruhen auf klinische Erfahrungen oder Empfehlungen von Expertengremien.
Gibt es eine spezifischen Ernährung für Tumorpatienten? Es gibt keine Daten von kontrollieren Studien, die den Wert einer spezifischen enteralen Ernährung belegen. Gerade hier muss der Patient ausführlich aufgeklärt werden, um ihn vor extremen Ernährungsformen zu schützen. Es gibt aber Hinweise, dass die Glukosetoleranz bei Tumorpatienten verschlechtert sein kann. Allerdings ist die Anzahl der Studien, die lipidfreie und lipidhältige enterale Ernährung vergleichen, limitiert. Im Prinzip sollte der Tumorpatient eine ausgewogene Ernährung mit 1-1,2 g Eiweiß pro Tag und Kilogramm Körpergewicht erhalten.24 Ob die Zugabe von Omega-3-Fettsäuren sinnvoll ist, ist unklar.25
Wann sollte eine enterale Ernährungstherapie begonnen werden? Eine enterale Ernährungstherapie sollte begonnen werden, wenn der Patient mangelernährt ist (Definition siehe oben) oder auch wenn der Patient über eine längere Periode (10 Tage) weniger als 60% der benötigten Ernährung zu sich nehmen kann. Dies gilt speziell bei Radio-Chemotherapien, um therapieassoziierte Gewichtsverluste primär schon zu verhindern, z.B. bei gastrointestinalen oder HNO-Tumoren, ebenso bei Patienten, die an einer schweren Mukositis leiden.
Kann die metabolische Situation durch Appetitanreger oder andere therapeutische Interventionen gebessert werden? Steroide können kurzzeitig den Appetit steigern,26 die Übelkeit senken und damit auch die Nahrungsaufnahme insgesamt erhöhen, haben aber keinen Langzeitaffekt auf die fettfreie Körpermasse bzw. die Muskelmasse. Auch der Wert der Androgene ist hier bescheiden. Wesentlich und gut belegt ist der Wert der Prophylaxe von therapieinduziertem Erbrechen und Übelkeit.
Gibt es eine Indikation für eine enterale Therapie während einer Chemotherapie? Diesbezüglich gibt es keine klaren Daten27, es ist aber sinnvoll, die allgemeinen supportiven medizinischen Regeln wie Prophylaxe von Emesis, Mukositis etc. einzuhalten und auf den Ernährungszustand des Patienten während der Chemotherapie zu achten, um frühzeitig einen Gewichtsverlust zu erkennen. Gibt es eine Indikation für enterale Ernährungstherapie während einer autologen oder allogenen Stammzelltransplantation? Hier gibt es keine klare Indikation.28
Wie soll bei Patienten im Endstadium einer Erkrankung ernährt werden? Bei Patienten, die zumindest eine Lebenserwartung von 2-3 Monaten haben, kann eine Ernährungstherapie sinnvoll sein.29,30 Es sollte eine Ernährungstherapie schon frühzeitig bei Gewichtsverlust eingeleitet werden, weil Interventionen im Endstadium von Tumorerkrankungen zumeist zu spät kommen. Hier ist eine Ernährungstherapie von fraglichem Wert31 und sollte keinesfalls zu invasiven Maßnahmen verleiten (PEG-Sonde, Port-a-Cath). Es ist darauf zu achten, dass dem Patienten ausreichend Flüssigkeit zugeführt wird. Hierbei kann man sich bei Schluckstörungen auch mit subkutanen Infusionen behelfen.32 Meistens wird eher das subjektive Gefühl einer Mundtrockenheit für die Patienten als äußerst störend empfunden, währenddessen das Hungergefühl primär nicht im Vordergrund steht.
Gibt es Hinweise dafür, dass eine Ernährungstherapie das Tumorwachstum stimuliert? Es gibt keinerlei Daten, die einen Hinweis darauf geben, dass eine enterale Ernährung das Überleben von Tumorpatienten verkürzt.33,34 Solche theoretischen Überlegungen sollten keinen Einfluss auf eine sinnvolle Ernährungstherapie haben, und es scheint klinisch wenig sinnvoll zu sein, einem Patienten mit erhöhtem Ruheumsatz und kataboler Stoffwechsellage nicht ausreichend zu ernähren.
Parenterale Ernährung
Wann sollte eine parenterale Ernährung begonnen werden?
- Eine parenterale Ernährung ist indiziert, wenn beim Patienten eine orale/enterale Nahrungszufuhr < 500 kcal/Tag für 3-5 bzw. mehr als 5 Tage zu erwarten ist.
- Wenn über eine Periode von 10-14 Tagen eine orale enterale Ernährung < 60% des Bedarfs erwartet wird.
- Wenn eine orale Ernährung über längere Zeit nicht zu einer ausgeglichenen Energiebilanz führt.
- Wenn parenterale Ernährung sowohl die Nebenwirkungen und auch die Compliance von aktiven systemischen Therapien verbessern kann.
Im Prinzip sollte die parenterale Ernährung nur Ergänzung einer unzureichenden enteralen/oralen Ernährung sein, in jedem Fall sollte diese aber frühzeitig auch unterstützend eingesetzt werden.
Meistens wird die parenterale Ernährung für eine limitierte Zeit zur Überbrückung verwendet, bis wieder eine volle enterale/orale Ernährung des Patienten möglich ist.
Spezielle Supplementierung der PE: Es gibt keinerlei Daten, ob die Supplementierung der parenteralen Ernährung mit speziellen Substanzen wie z.B. Insulin oder Omega-3-Fettsäuren irgendeinen Effekt haben. Theoretisch wäre eine Insulinsupplementierung bzgl. der Insulinresistenz sinnvoll, dennoch zeigen sich hier keine signifikanten positiven Ergebnisse – es ist daher wahrscheinlich wichtiger, die zugeführte Glukose von vornherein möglichst einzusparen/zu reduzieren.
Parenterale Ernährung bei Patienten mit fortgeschrittenen Tumorerkrankungen: In einigen Studien wurde der Wert der parenteralen Ernährung als supportive Therapie bei mangelernährten Patienten mit fortgeschrittenen Tumorerkrankungen untersucht. Zumeist wurden die Patienten ergänzend zu einer enteralen Ernährung parenteral unterstützt und ca. 30% des Ernährungsbedarfes intravenös zugegeben.
Es zeigten sich positive Ergebnisse, was das Überleben, die Lebensqualität und auch die Therapietoleranz dieser Patientengruppe betraf. Zusätzlich zeigten sich auch Verbesserungen im BMI, beim Albumin, der Lebensqualität, des Appetits und der physischen Belastbarkeit.35-37 Diese Ergebnisse sind interessant, müssten allerdings in größeren Phase-III-Studien belegt werden, da eine parenterale, nächtliche Substitution mittels “Homecare” zwar machbar, aber doch aufwändig ist. Auffällig bei den Studien von Shang und Hasenberg ist, dass die Patienten in der Kontrollgruppe ausreichend enteral ernährt wurden und dass in beiden Gruppen kein Ernährungsdefizit bestand. Dennoch schnitt die Gruppe mit der parenteralen supportiven Ernährung besser ab als die vollenteral ernährte Patientengruppe.
Gerade Patienten, die eine Radiochemotherapie erhalten, leiden im Verlauf der Therapie zunehmend an Übelkeit, Diarrhö, Hautreaktionen und Mukositis, die eine Nahrungsaufnahme erschweren.38-40 In der Regel können nur zwischen 40 und 70% der Patienten eine geplante Radiochemotherapie bei HNO-Tumoren ohne Unterbrechung abschließen. Gerade hier ist bezüglich Heilung eine konsequente Durchführung der Therapie sinnvoll und auch bei dieser Patientengruppe scheint eine Ernährungstherapie auch während einer kurativen Therapie sinnvoll zu sein.41,42
Bei Patienten mit bestehender schwerer Mangelernährung und bestehenden Toxizitäten, die die enterale Nahrungsaufnahme erschweren, ist eine randomisierte Ernährungsstudie aus ethischen Gründen schwer durchzuführen.43
Homecare und Komplikationen: Eine andauernde PE setzt eine funktionierende Heimbetreuung voraus, da eine monatelange PE nicht im Krankenhaus durchgeführt werden kann und soll. Dies setzte die Implantation von permanenten Kathetern wie Hickman oder Port-a-Cath-Systeme voraus, und Erfahrung im Management dieser Systeme ist essenziell. Weiters sind auch das Umfeld des Patienten mit der Unterstützung durch niedergelassene Kollegen, mobile Krankenschwestern sowie Einschulung betreuender Angehöriger entscheidend.44 Es ist z.B. in der mobilen Palliativversorgung durchaus möglich, dass Angehörige die parenterale Ernährungstherapie nach Einschulung über
nehmen, es muss hierbei jedoch mit einer gewissen Komplikationsrate von 2 bis 9% gerechnet werden45 (z.B. Kathetersepsis), jedoch waren keine Todesfälle durch eine parenterale Ernährung zu verzeichnen.
Weiters ist auf die Leberfunktion zu achten46,die Menge der infundierten Fettlösung sollte 1 g/kg KG nicht überschreiten. Das optimale Verhältnis von Fett und Kohlenhydraten ist zwar umstritten, der Fettanteil kann aber ohne Nachteil bei über 35% der Gesamtenergiezufuhr liegen.
Tumorwachstum und PE: Wie bei der enteralen Therapie gibt es auch hier keine Hinweise darauf, dass durch eine parenterale Ernährung das Tumorwachstum stimuliert wird. In einer Metaanalyse wurde in 12 Publikationen bei insgesamt 140 Patienten, die parenterale Unterstützung erhielten, vs. 84 Kontrollpatienten kein Hinweis bezüglich einer Tumorstimulation erbracht.
Zusammenfassung: Die Ernährungstherapie muss möglichst frühzeitig im Verlauf der Erkrankung durchgeführt und nicht erst bei massiven Mangelerscheinungen initiiert werden. Dies setzt allerding voraus, dass bei onkologische Patienten bereits bei Diagnosestellung der Ernährungszustand genau beurteilt wird. Die Richtlinien der klinischen Ernährungsmedizin sollten bei Diagnose bereits beachtet werden und nicht erst im Endstadium einer Erkrankung invasive ernährungstherapeutische Maßnahmen, wie parenterale Ernährung, PEG-Sonde etc., gesetzt werden.
Da gerade bei fortgeschrittenen Kolorektalkarzinomen, Mammakarzinomen etc. die Fortschritte der spezifischen onkologischen Therapien zwar kontinuierlich, aber noch immer nicht dramatisch sind, sollte der Wert von unterstützenden Therapien wie Ernährungstherapie nicht außer Acht gelassen und in weiteren Studien untersucht werden.
Es ist zu hoffen, dass in Zukunft auch gut konzipierte, durchführbare klinische Studien entwickelt werden, um den Wert der Ernährungstherapie bei hämatoonkologischen Patienten exakt zu beurteilen. Hierbei ist sicher zu beachten, dass die unterschiedlichen Patientengruppen (kurative Behandlung [intensive systemische oder Lokaltherapie], palliative Behandlung [chronisch erkrankte Patienten]) unterschiedliche Therapien und auch Ernährungstherapien benötigen (Abb. 2).
1 Stratton R. et al., Wallingford: CABI Publishing; 2003
2 Esper D. et al., Nutr Clin Pract 2005; 20:369-376
3 Persson C. et al., Clin Nutr 1999; 18:71-77
4 Fearon K. et al., Surg Oncol Clin N Am 2001; 10:109-126
5 Tisdale M.J., Science 2000; 289:2293
6 McMillan D.C. et al., Clin Nutr 2000; 19:403-406
7 Andreyev H.J.N. et al., Eur J Cancer 1998; 34 (4):503-509
8 van Bokhorst-de et al., Cancer 1999; 86:519-527
9 Ravasco P. et al., Support Care Cancer 2004; 12:246-252
10 Ravasco P. et al., Radiother Oncol 2003; 67:213-220
11 Ravasco P. et al., Clin Oncol 2003; 15:443-450
12 Ravasco P. et al., J Clin Oncol 2005; 23:1431-1438
13 Ambrus J.L. et al., J Med 1975; 6 (1):61-64
14 Aslani A. et al., Cancer 2000; 88:796-803
15 Collins M.M. et al., Ann Royal Coll Surg 1999; 81 (6):376-381
16 Wigmore S.J. et al., Br J Cancer 1997; 75 (1):106-109
17 Braga M. et al., Clin Nutr 2009; 28:378-386
18 Baldwin C. et al., Clin Nutr 2004; 23 (6):1267-1279
19 Ravasco P. et al., J Clin Oncol 2005; 23 (7):1431-1438
20 Gogos C.A. et al., Cancer 1998; 82:395-402
21 Tandon S. et al., Indian J Med Res 1984; 80:180-188
22 Druml W. et al., 3rd ed. Vienna: Arbeitsgemeinschaft Klinische Ernährung (AKE); 2004
23 Bozzetti F. et al., J Parenter Enteral Nutr 1989; 13 (4):406-420
24 Nitenberg G. et al., Crit Rev Oncol Hematol 2000; 34 (3):137-168
25 Fearon K.C. et al., Gut 2003; 52 (10):1479-1486
26 Ottery F.D. et al., Sem Oncol 1998; 25 (Suppl. 6):35-44
27 Klein S. et al., Nutr Clin Pract 1994; 9:91-100
28 Muscaritoli M. et al., Am J Clin Nutr 2002; 75 (2):183-190
29 Bozzetti F. et al., Clin Nutr 2003; 22 (2):109-111
30 Howard L. et al., Nutrition 2000; 16:625-628
31 Jonkers-Schuitema C.F., Clin Nutr 2004; 23 (6):1253-1255
32 Bruera E. et al., Support Care Cancer 1996; 4 (2):147-150
33 Rossi Fanelli F. et al., Clin Nutr 1991; 10:228-232
34 Bozzetti F. et al., Tumori 1999; 85 (3):163-166
35 Lundholm K. et al., Cancer 2004; 100:1967-1977
36 Hasenberg T. et al., Colorectal Dis 2010 Oct; 12
37 Shang E. et al., J Parenter Enteral Nutr 2006; 30:222-230
38 Van der Schueren M.A.E.B. et al., Cancer 1999; 86:519-527
39 Shang E. et al., J Parenter Enteral Nutr 2006; 30:222-230
40 Finocchiaro E. et al., Nutr Ther Metab 2007; 25:31-39
41 Van Bokhorst-de S.M. et al., Am J Clin Nutr 2001; 73:323-332
42 Ravasco P. et al., Head Neck 2005; 27:659-668
43 Freedman B. et al., NEJM 1987; 317:141-145
44 Messing B. et al., Gastroenterology 2006; 130:S43-S51
45 Kuizon D. et al., Arch Intern Med 2001; 161:406-410
46 Quigley E.M. et al., Gastroenterology 1993; 104:286-301