Therapiekomplikation Neutropenie – Einsatz von G-CSF bei Brustkrebspatientinnen
Definition der Neutropenie
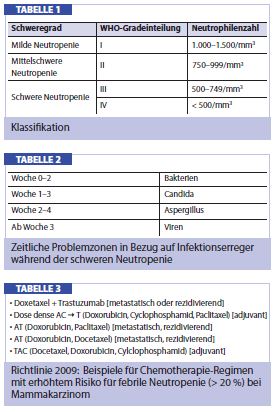
Unter der Neutropenie versteht man einen Mangel an peripher zirkulierenden neutrophilen Granulozyten. Nach der WHO-Klassifikation unterscheidet man vier Grade (Tab. 1), wobei vor allem die schwere Neutropenie unmittelbar eine Intervention indiziert.
Während einer schweren neutropenischen Phase ist das subjektive Patientenempfinden dem Zustand einer Anämie ähnlich, es ist gekennzeichnet durch Müdigkeit, Schwäche und Lethargie. Ein zusätzlicher und wesentlicher Begleitfaktor ist jedoch die erhöhte Suszeptibilität für Keime der endogenen bakteriellen Flora (z. B. Staphylococcus aureus der Haut, gramnegative Organismen des gastrointestinalen oder urogenitalen Traktes). Insbesondere bei länger währender schwerer Neutropenie führen nosokomiale und fungale Keime aufgrund der Immunsuppression zu potenziell lebensgefährlichen Infektionen mit Sepsis (Tab. 2).
Von febriler Neutropenie spricht man, wenn zusätzlich eine erhöhte Körpertemperatur von über 38,2 °C auftritt bzw. von über 38,0 °C für mindestens eine Stunde bzw. wenn innerhalb einer Zeitspanne von 12 Stunden 2-mal eine Körpertemperatur von > 38,0 °C gemessen wird. Die febrile Neutropenie stellt aufgrund des damit assoziierten erhöhten Mortalitätsrisikos eine Indikation zur raschen Hospitalisierung zwecks Isolation und sofortiger Einleitung einer antibiotischen Therapie dar.
Chemotherapie-bedingte sekundäre Neutropenie
Weitaus häufiger als angeborene Faktoren für Neutropenie (z. B. myelodysplastisches Syndrom, Agammaglobulinämie oder idiopathische zyklischer Neutropenie) sind erworbene Ursachen. Eine laufende bzw. rezent abgeschlossene Chemotherapie ist dabei ein wesentlicher pathogenetischer Faktor für eine sekundäre Neutropenie.
Regimen mit erhöhtem Risiko: In mehreren Vergleichsstudien konnte nachgewiesen werden, dass es unter Taxan-hältigen Chemotherapie-Regimen zu einer höheren Rate an Fällen mit Grad-3- und Grad-4-Neutropenie kommt, verglichen mit Anthrazyklin-basierten Schemata. So zeigt eine prospektive, randomisierte Studie mit 1.491 Patientinnen mit metastasiertem Mamma karzinom, dass die Inzidenz von Grad-3- oder Grad-4-Neutropenien nach 6 Zyklen TAC (Docetaxel/Doxorubicin/Cylcophos phamid) 65,5% betrug, hingegen in der Parallelgruppe mit FAC (Fluorouracil/Doxorubicin/Cyclophosphamid) nur 49,3% (p < 0,001). Ebenso fanden sich im TAC-Regimen weitaus mehr Episoden einer febrilen Neutropenie als unter FAC (24,7 % versus 2,5%, p < 0,001).
Vom National Comprehensive Cancer Network® (NCCN), das internationale, evidenzbasierte Richtlinien für die Behandlung von onkologischen (Begleit-) Erkrankungen erstellt, wurden Beispiele für Zytostatika in der adjuvanten Brustkrebsbehandlung, die mit einem erhöhten Risiko (> 20%) für eine febrile Neutropenie assoziiert sind, aufgelistet (Tab. 3).
Supportivtherapie mit G-CSF
Eine unbehandelte Myelosuppression unter zytostatischer Behandlung würde eine zeitliche Verschiebung der folgenden Chemotherapiezyklen bzw. eine Dosisreduktion der Therapie notwendig machen, um eine hämatologische Restitution zu gewährleisten. Dazu ist fest zustellen, dass die Ergebnisse von randomisierten klinischen Studien darauf hin weisen, dass eine Dosisreduktion und Therapieverzögerung der adjuvanten systemischen Brustkrebstherapie mit einem sub optimalen Ergebnis vergesellschaftet sind.
In den letzten Jahren haben aufgrund ihrer klinisch gesicherten Wirksamkeit rekombinante Wachstumsfaktoren das Spektrum der Supportivmaßnahmen im Umgang mit Neutropenie stark bereichert, sodass heute bei rechtzeitigem Einsatz von Granulozyten-stimulierenden Faktoren (G-CSFs) eine Therapieverzögerung in vielen Fällen vermieden werden kann.
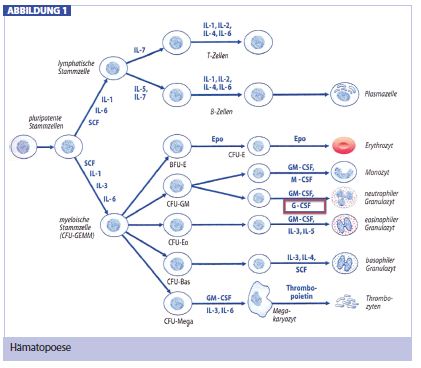
Physiologische Funktion von G-CSF: Unter dem Einfluss von Zytokinen und hämatopoetischen Wachstumsfaktoren (Interleukine, Colony-stimulating Factors) können sich Stammzellen aus dem hämatopoetischen Gewebe in weitere Formen differenzieren (Abb. 1). Die Heranreifungszeit der neutrophilen Granulozyten (und der Monozyten) aus der Colony-forming Unit (CFU-GM) beträgt ungefähr 7 Tage. Der Faktor, der den Ausreifungsprozess unterstützt, ist der Granulocyte-stimulating Factor (G-CSF).
Rekombinante G-CSF: Seit den späten 1980er-Jahren gibt es gentechnisch hergestellte GCSF, die meist aus E.-coli-Bakterien gewonnen werden. Unter dem Einfluss von rekombinanten G-CSFs kommt es zu einer Reduktion der Reifungszeit der neutrophilen Granulozyten von 7 auf 1,5 Tage. Rekombinante G-CSF fördern auch die Proliferation und Differenzierung der eosinophilen und basophilen Granulozyten, diese können innerhalb der ersten 24 Stunden nach Verabreichung der G-CSF im peripheren Blut gering ansteigen. Nach Beendigung der Behandlung fallen die Blutwerteinnerhalb von 2 Tagen wieder auf ungefähr die Hälfte ab und erreichen innerhalb von ungefähr 7 Tagen wieder einen normalen Wert.
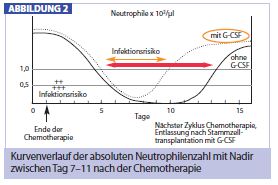
Halbierte Restitutionszeit: Unter der Einwirkung von Zytostatika kommt es schon ab dem 3. Tag nach Abschluss der Behandlung zu einem Abfall der peripher zirkulierenden neutrophilen Granulozyten, die innerhalb von 10 bis 14 Tagen den Tiefstwert erreichen, den sog. Nadir (Abb. 2). Unbehandelt werden erst nach 3-4 Wochen wieder normale Neutrophilenzahlen erreicht, bis dahin weist der Patient ein stark erhöhtes Infektionsrisiko auf (roter Pfeil). Die Zeit bis zur hämatologischen Restitution kann mithilfe von G-CSF nachweislich um fast die Hälfte verkürzt werden (oranger Pfeil), sodass es unter G-CSF zu einer geringeren Inzidenz von febriler Neutropenie kommt sowie seltener zu Infektionen, Krankenhausaufenthalten und der Notwendigkeit einer Antibiotikatherapie.
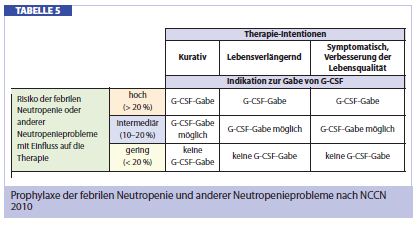
Wer profitiert von G-CSF prophylaktisch? Die NCCN hat hinsichtlich der febrilen Neutropenie ein Risikoprofil derjenigen Patientengruppe erstellt, welche von einer prophylaktischen G-CSF-Gabe am meisten profitieren würde (Tab. 4).
Als initiale Prophylaxe bietet sich G-CSF nach einer mäßig myelotoxischen zytostatischen Chemotherapie an, wenn ein Neutropenie-Risiko von > 20% besteht (Tab. 3 und 5). Als sekundäre Prophylaxe ist G-CSF nach einer zytostatischen Therapie indiziert, wenn nach dem ersten Zyklus bereits eine Neutropenie aufgetreten ist. Für die Prophylaxe einer febrilen Neutropenie (Tab. 4) und Behandlung einer schweren Neutropenie sind primär zwei Formen von G-CSF in Verwendung:
-
Filgrastim (Neupogen®, Biosimilar: Ratiograstim®): 5 mcg/kg Körpergewicht 1-mal täglich subkutan
-
und dessen konjugierte “pegylierte” Form Pegfilgrastim (Neulasta®): 6 mg 1-mal pro Zyklus, 24 h nach zytostatischer Chemotherapie
Beide Präparate sind in ihrer Verträglichkeit und Wirkungseffektivität gleichwertig. Da Neulasta® jedoch nur 1-mal pro Zyklus verabreicht wird (und zwar mindestens 24 Stunden nach und frühestens 2 Wochen vor dem nächsten Chemotherapiezyklus), eignet es sich nicht bei Fällen mit wöchentlicher Chemotherapie-Verabreichung. Neupogen® wird im Gegensatz dazu täglich so lange ver abreicht, bis die neutrophilen Granulozyten wieder auf > 500/mm3 (bei Infektionen über 1.500/mm3) angestiegen sind.
Als Nebenwirkungen werden von den Patienten vorwiegend Knochenschmerzen, bedingt durch die gesteigerte Hämatopoese im roten Knochenmark, angegeben (vermehrt unter Neulasta®) sowie Gelenk- und Muskelschmerzen, seltener Müdigkeit und Fieber.
Zusammenfassend ist festzustellen, dass dem adäquaten Einsatz im Rahmen von G-CSF bei Fällen mit erworbener Neutropenie ein hoher Stellenwert im Rahmen von Prävention und Therapie zukommt. Einerseits kann durch Vermeidung bzw. Stabilisierung von Episoden mit febriler Neutropenie, andererseits durch die Möglichkeit der Einhaltung eines planmäßigen Chemotherapie-Regimes ein Benefit in Bezug auf die Morbidität bzw. Mortalität erzielt werden.