Ein Projekt der ARGE QS der Österreichischen Gesellschaft für Zytologie und der Österreichischen Gesellschaft für Pathologie* – Leitlinie zur Qualität in der gynäkolgischen Zytologie
Die mikroskopische Beurteilung von histologischen und zytologischen Materialien ist eine subjektive, erfahrungsabhängige Methode und unterliegt einer Inter- und Intraobservervarianz. Daher kann nur eine angemessene Balance zwischen bestmöglicher Patientenversorgung, qualitätssichernden Maßnahmen im Laborbereich und Kosteneffektivität angestrebt werden. Die Vorsorgeuntersuchung zur Vermeidung bzw. die Untersuchung zur Abklärung von Neoplasien der Zervix uteri umfasst stadienabhängig die gynäkologische Zytologie, Kolposkopie, HPV-Testung und Histopathologie. Im folgenden Teil wird ausschließlich auf qualitätssichernde Maßnahmen des zytologischen Screenings eingegangen.
Angaben zur Struktur zytologischer Laboreinheiten
Allgemein: Zytologische Laboreinheiten sollten eine jährliche Mindestanzahl an gyn.-zytologischen Abstrichen begutachten. Da es keine ausreichend evidenzbasierten Studien zu diesem Thema gibt, schlagen die Autoren der Leitlinie folgende Zahlen vor:
in der Vorsorgemedizin pro Labor/Laborgruppe 15.000 Abstriche
in der kurativen Medizin pro Labor/Laborgruppe 1.000 Abstriche
Laborleitung: Facharzt/Fachärztin mit der Berechtigung für zytologische Diagnostik gemäß der letztgültigen Ärzteausbildungsordnung.
Zytologisch tätige AssistentInnen: Die European Guidelines fordern eine entsprechende Ausbildung. In Österreich werden zwar seit 2008 entsprechende FH-Lehrgänge angeboten, jedoch ist eine einheitliche Spezialausbildung in Zytodiagnostik derzeit gesetzlich nicht festgelegt.
Der Arbeitsaufwand für das Durchmustern eines gynäkologischen Abstriches ist im Normrichtwertekatalog der ÖGP mit 6 min angegeben. Die Musterungsarbeit soll im Mittel 10 Ausstriche pro Stunde nicht überschreiten, nach 2 Stunden ist eine Unterbrechung der Mikroskopiertätigkeit einzulegen. Die angegebene Zeit pro Abstrich inkludiert weder vorbereitende, administrative, noch qualitätssichernde Maßnahmen. Die Dokumentation von korrelierenden histologischen Befunden und ergänzenden Untersuchungen wie z.B. HPV-Testung ist zur Qualitätssicherung vorzusehen und ebenfalls zeitlich einzubeziehen.
Angaben zum Prozess
Allgemein: Im Labor einlangende Proben müssen mit eindeutigen Patientinnen-Kenndaten beschriftet und von einem Anforderungsschein oder einer elektronischen Zuweisung begleitet sein.
Eine vollständige Begleitinformation enthält:
Patientendaten
Tag der Abnahme
Name des Einsenders
Präparatdaten (Präparatart, Entnahmeort, Entnahmegerät)
klinische Fragestellungen mit wesentlichen anamnestischen Daten wie Information über Blutungsanamnese, die hormonelle Situation, etwaige kolposkopische Befunde, vorangegangene gynäkologische Operationen (z. B. Konisation, Hysterektomie) sowie durchgeführte relevante Therapien (Bestrahlungen, Chemotherapien, Zytostatika) und eventuell den HPV-Status.
Empfehlungen betreffend Abnahmegeräte für konventionelle Zytologie: Die European Guidelines empfehlen drei Entnahmegeräte für die Abnahme des konventionellen Pap-Abstrichs:
„Cervical Broom“ (z. B. Cervex-Brush®)
Kombination aus Spatel und endozervikaler Bürste (z. B. Cytobrush®)
„Extended Tip Spatula“ (z. B. Szalay-Spatel)
Bei der Zellabnahme sollte man darauf achten, die gesamte Zirkumferenz der Transformationszone bis hin zum Endozervixepithel (Zylinderepithel) abzustreichen, die Zellen rasch auf einen Objektträger aufzubringen und die Zellen sofort zu fixieren, um Trocknungsartefakte zu vermeiden. Die Fixierung des Zellmaterials am Objektträger erfolgt mittels Spray oder Einstellen in 96 % Alkohol (mindestens 10 Minuten, Alkoholküvette zumindest täglich erneuern) bzw. vergleichbaren Fixationsmitteln für gynäkologische Zytologie.
Die Zellgewinnung mit dem Wattestäbchen sollte nur bei besonderen Umständen erfolgen (z. B. Atrophie), wobei der Watteträger vor dem Abstrich mit 0,9 % NaCl-Lösung anzufeuchten ist.
Angaben zum Ergebnis
Präparatbeurteilung: Die Präparatbeurteilung erfolgt stufenweise („stepwise screening“).
Die Erstbeurteilung geschieht in der Regel durch zytologisch tätige AssistentInnen, wobei auffällige Stellen zu kennzeichnen sind. Das Ergebnis der Erstbeurteilung soll bereits entsprechend den Leitlinien zur Befundwiedergabe dokumentiert werden, weiters Angaben zur Materialqualität inkludieren und mit der Erkennung des Erstbegutachters abgeschlossen werden.
Zweit-/Endbefundung: Unauffällige Abstriche sind der internen Qualitätssicherung zuzuführen, wobei folgende Abstriche eine Zweitbegutachtung durch einen Facharzt mit Kompetenz in gynäkologischer Zytodiagnostik benötigen:
alle von den vormusternden Fachkräften als auffällig ein gestuften Päparate
Ausstriche/Proben von Frauen mit zytologisch positiven Vorbefunden (innerhalb der letzten 5 Jahre) oder auffälligen klinischen Angaben (z. B. _ Pap III oder HPV-Positivität)
Für die Endbefundung ist der Facharzt verantwortlich. Alle Ergebnisse sollen eine Plausibilitätskontrolle durchlaufen.
Beurteilung der Abstrichqualität: Die beurteilten Abstriche sind einer der folgenden drei Gruppen zuzuordnen, wobei die Kriterien für eingeschränkte Qualität in Anlehnung an die entsprechenden Kriterien des Bethesda-Systems definiert werden:
Qualität: „Gut beurteilbar und repräsentativ“: Alle der im Weiteren aufgezählten Kriterien müssen erfüllt sein:
entsprechende Abstrich-Kennzeichnung zur Identifikation
ausreichende klinische Information
Zylinderepithelzellen und/oder Metaplasiezellen bei Patientinnen mit Portio
entsprechende Zahl an gut erhaltenen und gut sichtbaren Plattenepithelzellen
Qualität: „Beurteilbar, aber …“: In diesen Fällen fehlen entweder wesentliche klinische Informationen und/oder werden die o. a. Repräsentativkriterien nicht erfüllt.
Weitere Kriterien, die möglicherweise nicht erfüllt sind, betreffen
schlechte Fixierung
leichte bis mäßige Zellschädigungen durch Ausstreichartefakte (Quetschartefakte)
Überdeckung von 50–75 % der epithelialen Zellkom – ponente durch Blut, Entzündungszellen, dicke Zelllagen, Kontamination
Qualität: „Nicht beurteilbar (Pap 0)“: Eines der folgenden Kriterien liegt vor:
Identifikation des Abstrichpräparates bzw. Zuordnung zu einer Anweisung nicht möglich, da Präparat z. B. zerbrochen oder nicht vorhanden ist
betrifft Repräsentativkriterien, Kriterien der Methodik und technischen Verarbeitung:
nicht ausreichende plattenepitheliale Zellkomponenten
zu schlechte oder keine Fixierung; Lufttrocknungsartefakte
Überdeckung von mehr als 75 % der epithelialen Zellkomponente durch Blut, Entzündung, dicke Zelllagen, Kontamination
ausgeprägte Zellschädigung durch Ausstreichartefakte (Quetschartefakte)
Fehlen von Zylinderepithelzellen und Metaplasiezellen in Kombination mit weiteren Parametern einer eingeschränkten Aussagekraft wie unter „Qualität: ,Beurteilbar, aber …‘“ angeführt.
Angaben zur Repräsentativität sind bei allen Fällen, insbesondere bei Pap II durchzuführen. In manchen Fällen kann es sinnvoll sein, Angaben zur eingeschränkten Repräsentativität/Beurteilung zu machen. In Fällen, bei denen nicht zweifelsfrei zwischen Pap 0 und Pap III entschieden werden kann, soll „Pap 0, Material ungeeignet für Diagnose“ verwendet werden. Pap I verlangt einen repräsentativen Abstrich.
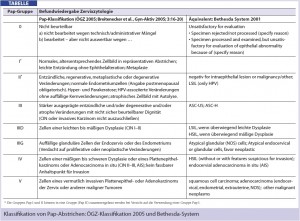
Ergebnisnomenklatur: Grundlage für die Erstellung eines zytologischen Befundes ist die Anwendung einer verbindlichen Nomenklatur und Klassifikation auf nationaler und internationaler Ebene. Soweit wie möglich soll eine Korrelation zur Bethesda- Klassifikation hergestellt werden. Abweichungen zur Bethesda- Klassifikation bestehen bei HPV-assoziierten Veränderungen ohne Dysplasiezeichen und bei der Doppelzuordnung von CIN 2 zu Pap IIID und Pap IV.
Interne Qualitätssicherung im Rahmen der Befundausgabe: Die Laborleitung ist für eine interne Qualitätssicherung im zytologischen Befundungsprozess verantwortlich. Dem Re-Screening unterliegen jene Abstriche, die bei der Erstbefundung als unauffällig eingestuft wurden (Pap I und Pap II). Diese Maßnahme trägt zur generellen Qualitätskontrolle bei, Ziel ist die Erhöhung der Sensitivität.
Eine der folgenden Kontrollmethoden sollte angewandt werden:
100 % „Rapid Re-Screening“
randomisiertes Re-Screening/mindestens 10 % der vorgemusterten und als unauffällig eingestuften Fälle werden nachkontrolliert
„Targeted Reviewing“
Interne Qualitätssicherung unabhängig von der Befundausgabe:
„Targeted Reviewing“ von ausgewählten Patientengruppen: Die retrospektive Reevaluation von ursprünglich negativ interpretierten Zervixabstrichen von Patientinnen, bei welchen nachfolgend ein positiver Befund erhoben wurde
Zyto-Histo-Korrelation wird empfohlen
dokumentierte Kommunikation mit dem Einsender/jährlicher Bericht über die Gesamtergebnisse der Einsendungen inklusive Angaben zur Abstrichqualität
Externe Qualitätssicherung: Teilnahme am Selbstkontroll- Programm der ÖGZ (derzeit freiwillig). Dieses basiert auf einer jährlich zu meldenden Statistik, wobei jeder der am QS-Programm teilnehmenden Laborleiter eine Auswertung der eigenen Ergebnisse und einen Vergleich mit dem generellen österreichischen Durchschnitt sowie mit dem internationalen Standard und Benchmarks erhält.
Die Erhebungsbögen umfassen im Einzelnen:
Auswertung der Ergebnisse nach der Pap-Klassifikation gemäß ÖGZ
Screening-Kontrolle
Beurteilung der Abstrichqualität, Evaluierung der Abstrichqualität der einzelnen Einsender
Korrelation Zytologie/Histologie
Daten zur Struktur
Archivierung: Aufbewahrung von Anforderungsformularen mindestens 3 Monate, Aufbewahrung von Präparaten für mindestens 10 Jahre.
Befundkopien bzw. Aufzeichnungen sind entsprechend den gesetzlichen Vorgaben auf entsprechend lesbaren Datenträgern aufzubewahren.
* „Leitlinie zur Qualität in der gynäkologischen Zytologie“ – ein Projekt der ARGE QS der Österreichischen Gesellschaft für Zytologie und der Österreichischen Gesellschaft für Pathologie, Dezember 2010:
ao. Univ.-Prof. Dr. Peter Regitnig1, 2, Prof. Dr. Gerhard Breitenecker1, Prof. Dr. Hans Peter Dinges1, 2, Prim. Dr. Christa Freibauer1, 2, Prim. Dr. Walter Höbling1, 2, Prim. Prof. Dr. Sigurd Lax1, 2, Dr. Alexander Nader1, 2, OA Dr. Okcu Murat2, OA Dr. Mario Ordonez2, OA Dr. Wolfgang Pokieser1, 2, OA Dr. Johann Schalleschak1, Maria Stacher-Ehrgott1, Josefine Stani1, OA Dr. Herwig Tuppy1, 2, Dr. Walter Widder1, ao. Univ.-Prof. DDr. Helene Wiener1, 2
1 Österreichische Gesellschaft für Zytologie; 2 Österreichische Gesellschaft für Pathologie
Link: http://www.cytology.at/pdf/20110105_OEGZ_OEGP_Leitlinei_zur_Qualitaet_in_der_gynaekologischen_ Zytologie_2010.pdf