Thrombophilie bei Kinderwunsch
Das Blutgerinnungssystem
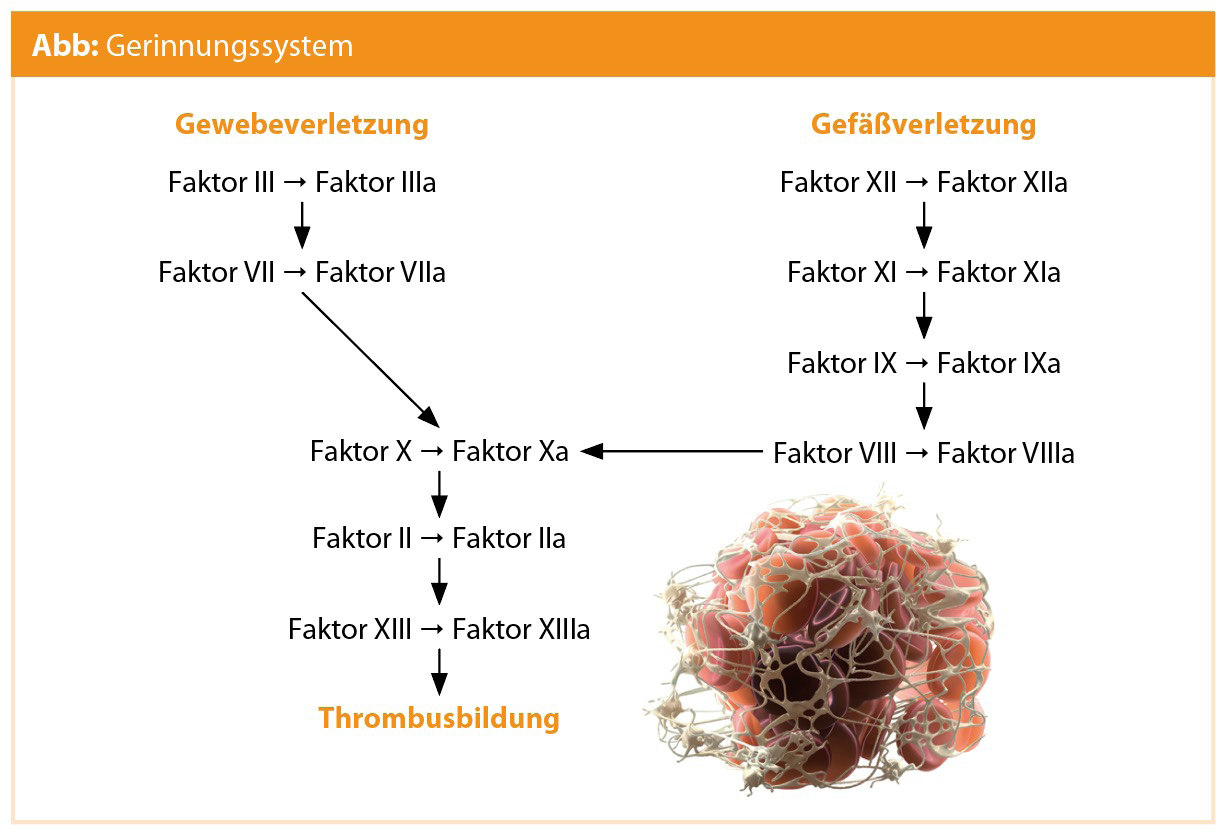
An der physiologischen Blutgerinnung sind drei Komponenten beteiligt: Thrombozyten, Gerinnungsfaktoren und das Gefäßendothel. Kommt es zu einer Verletzung des Gefäßendothels, werden in der Gefäßwand vorkommende Gerinnungsaktivatoren freigesetzt, die die Blutgerinnungskaskade aktivieren.
Die Blutstillung kann in zwei Phasen unterteilt werden:
- Primäre Blutstillung: Durch die Verletzung der Gefäßwand werden Kollagenfasern, Fibronektin und Laminin freigesetzt, was zu einem Andocken der Thrombozyten an die Gefäßwand führt. Die Thrombozyten vernetzen sich mit Hilfe des im Plasma vorkommenden Fibrinogens und bilden einen Thrombus.
- Sekundäre Blutstillung: Aktivierung der plasmatischen Blutgerinnung. Die Gerinnungsfaktoren werden in der Leber gebildet und zirkulieren im Blutplasma. Die Blutgerinnungskaskade kann über 2 Wege aktiviert werden:
- extrinsisches System: Durch eine Gewebeverletzung wird Faktor III freigesetzt, der Faktor VII aktiviert, der wiederum Faktor X aktiviert.
- intrinsisches System: Durch eine Verletzung des Gefäßendothels wird Faktor XII aktiviert, der dann Faktor XI, IX und VIII aktiviert. Faktor VIII aktiviert Faktor X, sodass beide Wege in einem gemeinsamen Endpunkt enden.
- gemeinsamer Endweg: Faktor X bewirkt die Umwandlung von Prothrombin in Thrombin (Faktor II), welches wiederum Fibrinogen mit Hilfe von Faktor XIII in Fibrin umwandelt. Das Fibrin vernetzt den Thrombus, sodass dieser endgültig stabil wird.
Es gibt physiologische Inhibitoren, um eine Überreaktion des Gerinnungssystems zu vermeiden:
- Antithrombin: Inaktivierung von Faktor II, Faktor X, Faktor XII, XI und IX
- Protein C: Inaktivierung von F VIII und Faktor V sowie von PAI 1 (Plasminogen Activator Inhibitor). Durch die Inaktivierung von PAI 1 fördert Protein C die Fibrinolyse
- Protein S: Kofaktor von Protein C
Ein Ungleichgewicht im Gerinnungssystem kann zu Blutungen oder zu einer Thromboseneigung führen. Im Rahmen der Kinderwunschtherapie ist vor allem bei der Abklärung habitueller Aborte die Thromboseneigung von Bedeutung.
Labordiagnostik bei Kinderwunsch-Patientinnen
Bereits eine ovarielle Stimulation mit Gonadotropinen im Rahmen einer IVF/ICSI-Therapie geht mit einer Aktivierung des Gerinnungssystems her. Dies ist vergleichbar mit einer Schwangerschaft und kann wie diese ein erhöhtes Thromboserisiko darstellen. Ein basaler Gerinnungsstatus sollte aus diesem Grund bei jeder Kinderwunschpatientin vor Start einer IVF/ICSI-Behandlung erstellt werden, um eine Thrombose- oder Blutungsneigung auszuschließen. Dieser beinhaltet:
- Thrombozytenzahl
- Thromboplastin-Zeit (Quick): Globaltest des extrinsischen Systems
- partielle Thromboplastinzeit (PTT): Globaltest des intrinsischen Systems
- APC-Resistenz: durch eine Punktmutation (Faktor-V-Leiden-Mutation) wird die Inaktivierung von Faktor V durch APC verhindert, was zu einer Thromboseneigung führt. Ca. 5–10 % der europäischen Bevölkerung sind von dieser Mutation betroffen. Heterozygote Personen haben ein 5–10-faches Risiko einer Thrombose, homozygote Personen ein 50–100-faches.
Bei Auffälligkeiten im basalen Gerinnungsstatus, vor allem bei Verlängerung von Quick oder PTT, ist immer eine Vorstellung bei einem Hämatologen sinnvoll, um eine genaue Abklärung zu ermöglichen.
Das Risiko für die Entwicklung einer Thrombose während eines IVF/ICSI-Zyklus ist mit 0,1–0,3 % relativ selten. Interessant sind dabei der hohe Anteil von Thrombosen im Bereich der oberen Extremität und die Tatsache, dass in über 98 % der Fälle die Thrombosen nach der Ovulationsinduktion auftreten. Besonders gefährdet sind Patientinnen, die im Rahmen der IVF/ICSI-Therapie ein OHSS entwickelt haben. Das Risiko für das Auftreten einer Thrombose steigt bei diesen Patientinnen auf 4 % an.
Thrombophilie-Screening bei Frauen vor einer ART: Generell besteht keine Indikation für ein allgemeines Thrombophilie-Screening bei Frauen vor einer ART. Thrombophilie kann jedoch manchmal im Falle von erfolgslosen IVF/ICSI-Versuchen bedingt durch ein Implantationsversagen (definiert als drei Transfers von qualitativ guten Embryonen ohne eine Schwangerschaft) oder habituellen Aborten eine Rolle spielen. Vor allem bei Frauen mit einer positiven Anamnese bei der Patientin selbst oder in ihrer Familie soll eine ausführlichere Gerinnungsdiagnostik erfolgen. Hierzu gehört:
- Hereditäre Thrombophilie: Diese Parameter sollten nur bei Frauen bestimmt werden, die eine positive Eigen- oder Familienanamnese haben. Die Leitlinie der DGGG und OEGGG sowie die Leitlinie der ESHRE zu habituellen Aborten raten von einer Bestimmung bei Frauen ohne auffällige Anamnese explizit ab, da dies zu einer Übertherapie und damit zu Komplikationen wie Blutungen und Heparin-induzierter Thrombopenie führen kann.
- Prothrombin-Mutation 20210G>A: 2–3 % der Bevölkerung sind betroffen. Die Mutation führt zu einer 2–3-fach erhöhten Thromboseneigung bei heterozygoten Trägern und zu einer mehr als 6-fach erhöhten Thromboseneigung bei homozygoten Trägern.
- Antithrombin (ATIII): Ein Mangel an Antithrombin führt zu einer erhöhten Thromboseneigung. Die Erkrankung ist selten mit nur 0,05–0,3 % Betroffenen und führt zu einem 8-fach erhöhten Thromboserisiko.
- Protein C: Ein Mangel führt auf Grund der fehlenden Inaktivierung von Gerinnungsfaktoren zu einer Thromboseneigung. 0,2–05 % der Bevölkerung sind betroffen, das Thromboserisiko ist 7–8-fach erhöht.
- Protein S: Ein Mangel führt auf Grund der fehlenden Inaktivierung von Gerinnungsfaktoren zu einer Thromboseneigung, da Protein S ein Kofaktor von Protein C ist. 0,03–0,1 % der Bevölkerung sind betroffen, das Thromboserisiko ist 7–8-fach erhöht.
- MTHFR-Mutation: Durch die Mutation C677T kommt es in Kombination mit einem erhöhten Homozysteinspiegel zu einer erhöhten Thromboseneigung. Die Hyperhomozysteinämie wird durch eine beeinträchtigte Verstoffwechselung von Folsäure bewirkt. Die Mutation liegt heterozygot bei bis zu 30 % der europäischen Bevölkerung vor, homozygot bei bis zu 10%. Die Mutation scheint nur bei homozygoter Trägerschaft gemeinsam mit einer Homozysteinämie zu einer Thromboseneigung zu führen. Relevant ist im Rahmen der Kinderwunschtherapie aber auch die erhöhte Rate an Neuralrohrdefekten und Präeklampsien, verursacht durch die beeinträchtigte Verstoffwechselung von Folsäure.
- Plasmin Activator Inhibitor 1 (PAI 1): Durch eine Punktmutation kommt es zu einer Verhinderung des Abbaus von Fibrin und damit zu einer erhöhten Thromboseneigung. Nur homozygote Träger der 4G/4G-Mutation zeigen ein erhöhtes Thromboserisiko, wahrscheinlich aber nur in Kombination mit anderen Mutationen, z. B. Faktor-V-Leiden-Mutation. Eine Bestimmung von PAI-1 ist wenig zielführend, da der Faktor zirkadianen Schwankungen unterliegt. Sollte der Verdacht bestehen, ist ein direkter Mutationsnachweis sinnvoll. Die Prävalenz der 4G-Mutation ist mit 25 % hoch.
- Erworbene Thrombophilie: Anti-Phospholipid-Antikörper: Hier sollten drei Typen von Antikörpern bestimmt werden:
- Anti-β2-Glykoprotein 1
- Anti-Cardiolipin
- Lupus-Antikoagulans
Diese Autoantikörper sind gegen Phospholipide gerichtet und aktivieren die Thrombozytenadhäsion am Endothel. Die Prävalenz des Anti-Phospholipid-Syndroms (APLS) beträgt 2–5 % der Bevölkerung, bei Thrombophilie-Patienten jedoch in etwa 30 %. 2–15 % aller Patientinnen mit habituellen Aborten sind betroffen. Es wird zwischen einem primären APLS und einem sekundären APLS unterschieden, beim sekundären APLS liegen noch weitere Autoimmunerkrankungen vor. Am häufigsten werden Anti-Cardiolipin-Antikörper gefunden. Von einem „triplepositiven“ APLS spricht man, wenn alle 3 Antikörper positiv sind. Dieses ist mit einem besonders hohen Risiko für Schwangerschaftskomplikationen assoziiert. Anti-Phospholipid-Antikörper können auch nach einer bereits erfolgreichen Schwangerschaft auftreten.
In der Leitlinie der DGGG und OEGG sind Kriterien festgelegt, wann eine Bestimmung von Lupus-Antikörpern erfolgen sollte (Tab.).
Therapie
Mehrere Studien konnten ein erhöhtes Risiko für ein Implantationsversagen und habituelle Aborte bei Faktor-V-Leiden-Mutation, Prothrombin-Mutation, Anti-Phospholipid-Antikörpern und Protein-C-Mangel zeigen. In Metaanalysen blieb nur ein signifikantes Risiko für Anti-Phospholipid-Antikörper bestehen. Daher empfehlen die ESHRE und die AWMF-Leitlinie der DGGG und der OEGGG, sich im Screening auf diese Antikörper zu beschränken, wenn die Anamnese der Patientin keinen Hinweis auf eine erhöhte Thromboseneigung zeigt.
Differenziertes Vorgehen: Die Therapie der Faktor-V-Leiden-Mutation, der Prothrombin-Mutation, des ATIII-, Protein-C- und Protein-S-Mangels besteht in einer Heparingabe in prophylaktischer Dosierung (z. B. 40 mg/d) ab Beginn der Kinderwunschtherapie bis 6 Wochen postpartal. Bei der MTHFR-Mutation ist die hochdosierte Gabe von Folsäure (5 mg/Tag) wesentlich, eine Heparinisierung sollte nur bei einer homozygoten Mutation und erhöhtem Homozysteinspiegel erfolgen. Die PAI-1-Mutation sollte ebenfalls nur in ihrer homozygoten Form behandelt werden. Liegen Anti-Phospholipid-Antikörper vor, ist zusätzlich zur Heparinisierung eine prophylaktische Gabe von ASS 100 mg notwendig, um die verstärkte Thrombozytenaggregation zu hemmen.
Ohne Einfluss auf die Schwangerschaftsrate: Nun stellt sich die Frage, ob man statt einer Abklärung nicht direkt bei Patientinnen mit Implantationsversagen oder habituellen Aborten mit einer Heparin- oder ASS-Therapie beginnen könnte, ohne vorher eine Abklärung zu machen. In den vergangenen Jahren gab es immer wieder Studien, die eine Gabe von Heparin und/oder ASS bei Patientinnen mit Implantationsversagen oder habituellen Aborten ohne Thrombophilie untersucht haben. In Metaanalysen konnte keine Verbesserung der Schwangerschaftsrate gezeigt werden, dafür aber Nebenwirkungen wie Blutungen. Dies zeigt, dass eine Thrombophilie-Diagnostik vor Einleiten einer Heparin- oder ASS-Therapie immer sinnvoll ist, um eine unnötige Therapie und damit Nebenwirkungen bei nicht betroffenen Patientinnen zu vermeiden. Eine antithrombotische Therapie zum alleinigen Zweck der Verbesserung der Schwangerschafts- und Lebendgeburtenrate ist nicht indiziert.