Kardiovaskuläres Risiko und Mortalität bei Synukleinopathien
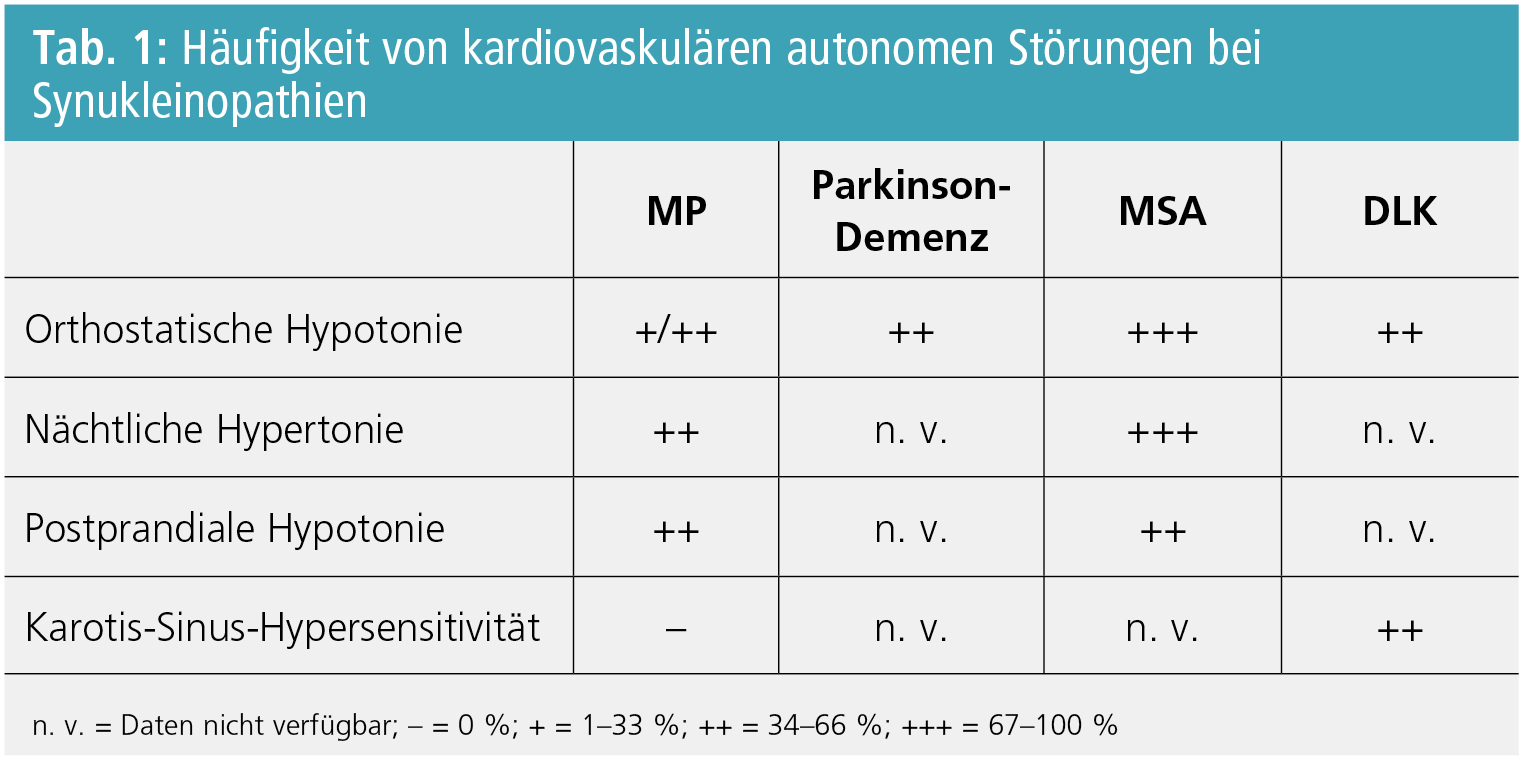
Im Vordergrund des kardiovaskulären autonomen Versagens bei Synukleinopathien stehen die neurogene orthostatische Hypotonie (OH), die häufig von postprandialer Hypotonie (PPH), Karotis-Sinus-Hypersensitivität (KSH) sowie von Hypertonie in Rückenlage (supine hypertension = SH) und nächtlicher Hypertonie (NH) begleitet wird (Tab. 1).
Im Gegensatz zur früheren Lehrmeinung einer protektiven Auswirkung von OH gegenüber kardio- und zerebrovaskulären Erkrankungen, haben verschiedene Studien kürzlich gezeigt, dass OH ein negativer prognostischer Faktor für die Lebenserwartung, das Gedächtnis und den zerebrovaskulären Outcome für die allgemeine Bevölkerung ist1–3. Im Laufe des letzten Jahrzehntes konnte eine ähnliche negative prognostische Auswirkung von kardiovaskulärem autonomem Versagen auch bei Synukleinopathien in mehreren Studien bewiesen werden.
Kardio- und zerebrovaskuläre Auswirkungen kardialen autonomen Versagens
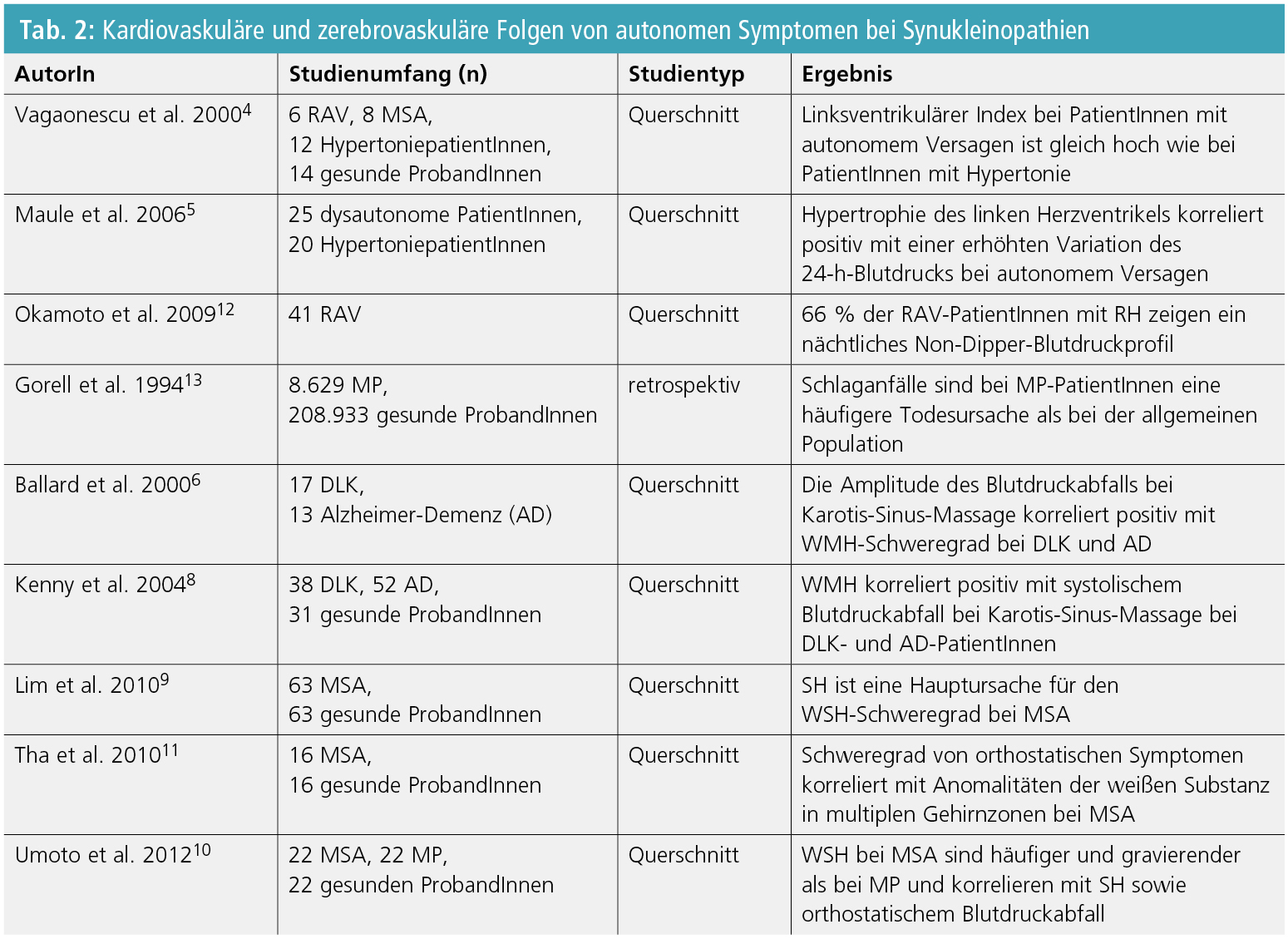
Echokardiographische Studien von Vagaonescu et al. sowie Maule et al. berichteten, dass eine linksventrikuläre Hypertrophie bei PatientInnen mit autonomem Versagen so häufig auftritt wie bei PatientInnen mit essenzieller Hypertonie und mit NH statistisch korreliert ist4, 5. Beide AutorInnen zogen die Schlussfolgerung, dass OH kein protektiver Faktor gegen Endorganschaden ist, sondern wahrscheinlich durch Koronarhypoperfusion zu kardialer Dysfunktion beitragen kann.
Erste Resultate unterstreichen ebenso eine ätiologische Beziehung zwischen OH, hypertensiven Krisen in Rückenlage und Hyperintensitäten im Bereich der weißen Substanz (WMH) bei Synukleinopathien (Tab. 2). Ballard et al.6, 7 und Kenny et al.8 zeigten eine erhebliche Korrelation zwischen Blutdruckabfall während Karotis-Sinus-Massage und dem Schweregrad von WMH bei DLK. Auch bei MSA zeigen sich OH- und SH-korrelierte zerebrale Kleingefäßschäden9, 10, obwohl diese mittels einer einmaligen Blutdruckmessung und nicht durch ein 24-h-Blutdruckmonitoring dokumentiert wurden. Schlussendlich wurde von Tha et al. kürzlich demonstriert11, dass Anomalitäten der weißen Substanz bei Diffusion-MRT-Sequenzen positiv mit Alter, OH und Ataxie-Schweregrad bei 16 MSA-PatientInnen korrelierten.
Gedächtnis
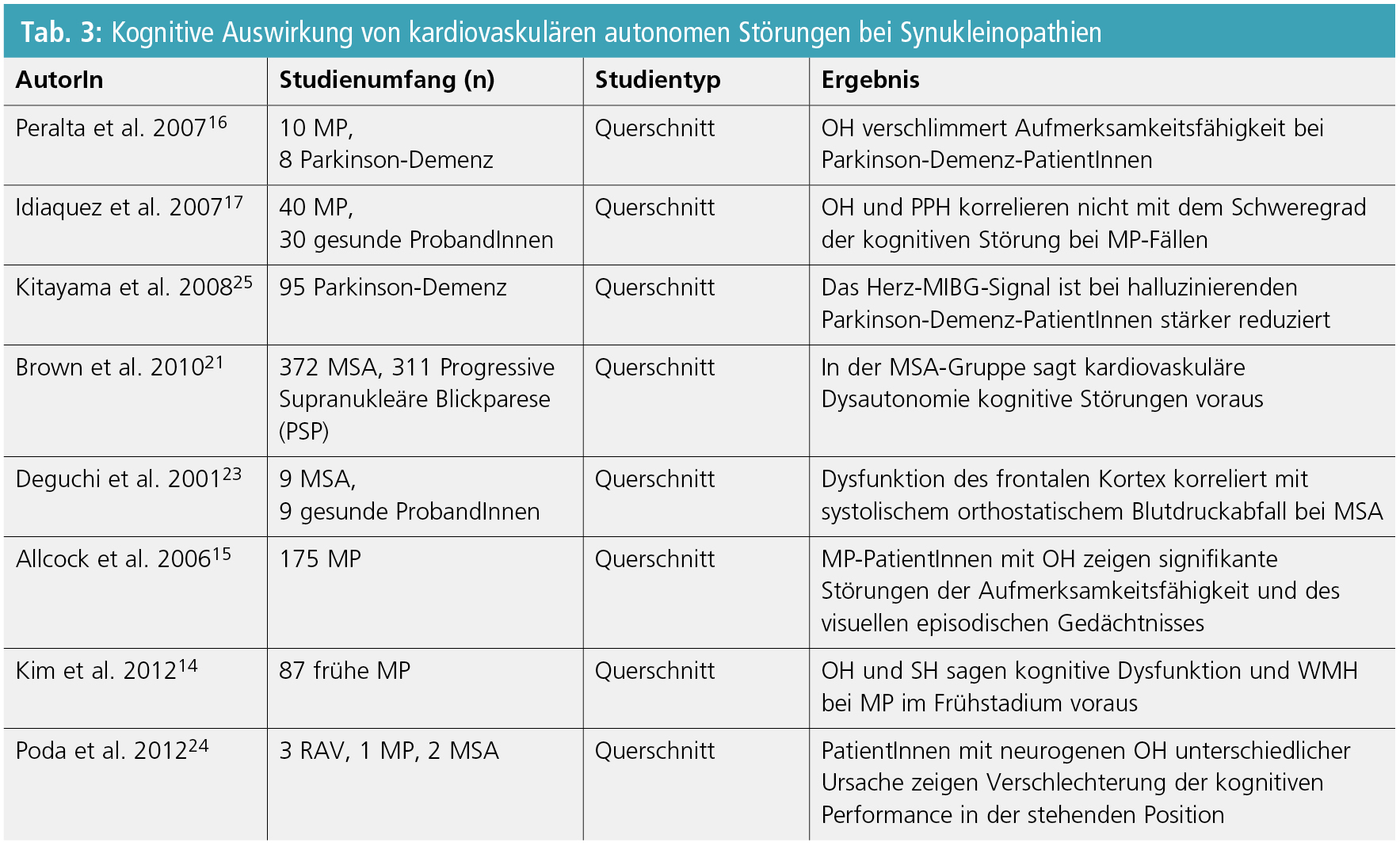
OH und SH wurden mit Gedächtnisstörungen in den frühen Krankheitsphasen bei MP korreliert. Im Besonderen wurde gezeigt, dass OH anhaltende Aufmerksamkeits- und visuelle episodische Gedächtnisdefizite bei MP auslösen kann14, 15. In einer kleinen klinischen Studie berichteten Peralta et al.16 von einem Aufmerksamkeitsdefizit, das mit dem orthostatischen Blutdruckabfall bei MP-PatientInnen mit Demenz, im Gegensatz zu nichtdementen ProbandInnen, korrelierte. Idiaquez et al.17 konnten dennoch keine erhebliche Korrelation zwischen OH und Gedächtnisstörungen bei 40 MP-PatientInnen nachweisen, obwohl sich die dementen MP-PatientInnen häufiger über orthostatische Symptome beklagt hatten.
Obgleich ausgeprägte Demenz ein Ausschlusskriterium für die MSA-Diagnose ist18, wurde häufig bei MSA-PatientInnen von einer selektiven Frontalkortex-Dysfunktion mit einem Schweregrad zwischen jenem von MP und DLK berichtet19–22. Eine rezente Studie von Brown et al.21 demonstrierte, dass kardiovaskuläres autonomes Versagen ein eigenständiger Risikofaktor für die Entwicklung von Gedächtnisstörungen bei MSA ist. Außerdem berichteten Deguchi et al.23, dass der Blutdruckabfall 5 Minuten nach dem orthostatischen Belastungsanfang mit einer erhöhten Potenziallatenz im Bereich des Frontalkortex während des Wisconsin-Card-Sorting-Tests bei MSA korreliert ist. Die Ursache dafür kann möglicherweise eine transiente Durchblutungsverminderung dieser metabolisch anspruchsvollen Rindenregion sein. Letztgenannte Hypothese wurde von aktuellen Resultaten weiter unterstützt, welche eine Abnahme der Gedächtnisleistung beim Aufstehen im Vergleich mit der Gedächtnisleistung in der Rückenlage bei PatientInnen mit neurogener OH herausgestellt haben24.
Trotz der großen Häufigkeit von kognitiven Defiziten und neurokardiovaskulärer Instabilität bei DLK ist nur von wenigen Studien die direkte ätiologische Verbindung zwischen den beiden Phänomenen untersucht worden.
Verschiedene AutorInnen berichteten, dass neurokardiovaskuläre Instabilität ein Risikofaktor für subkortikale ischämische Läsionen bei DLK-PatientInnen ist7, 8, 22. Gleichzeitige zerebrovaskuläre ischämische Schäden könnten deshalb ein negativer prognostischer Faktor für den kognitiven Outcome bei DLK-PatientInnen sein (Tab. 3). Es werden jedoch weitere Studien, die den wirklichen Einfluss von ischämischer Belastung auf kognitive Funktion bei DLK-PatientInnen untersuchen, benötigt, um diesen Zusammenhang genauer abzuklären.
Mortalität
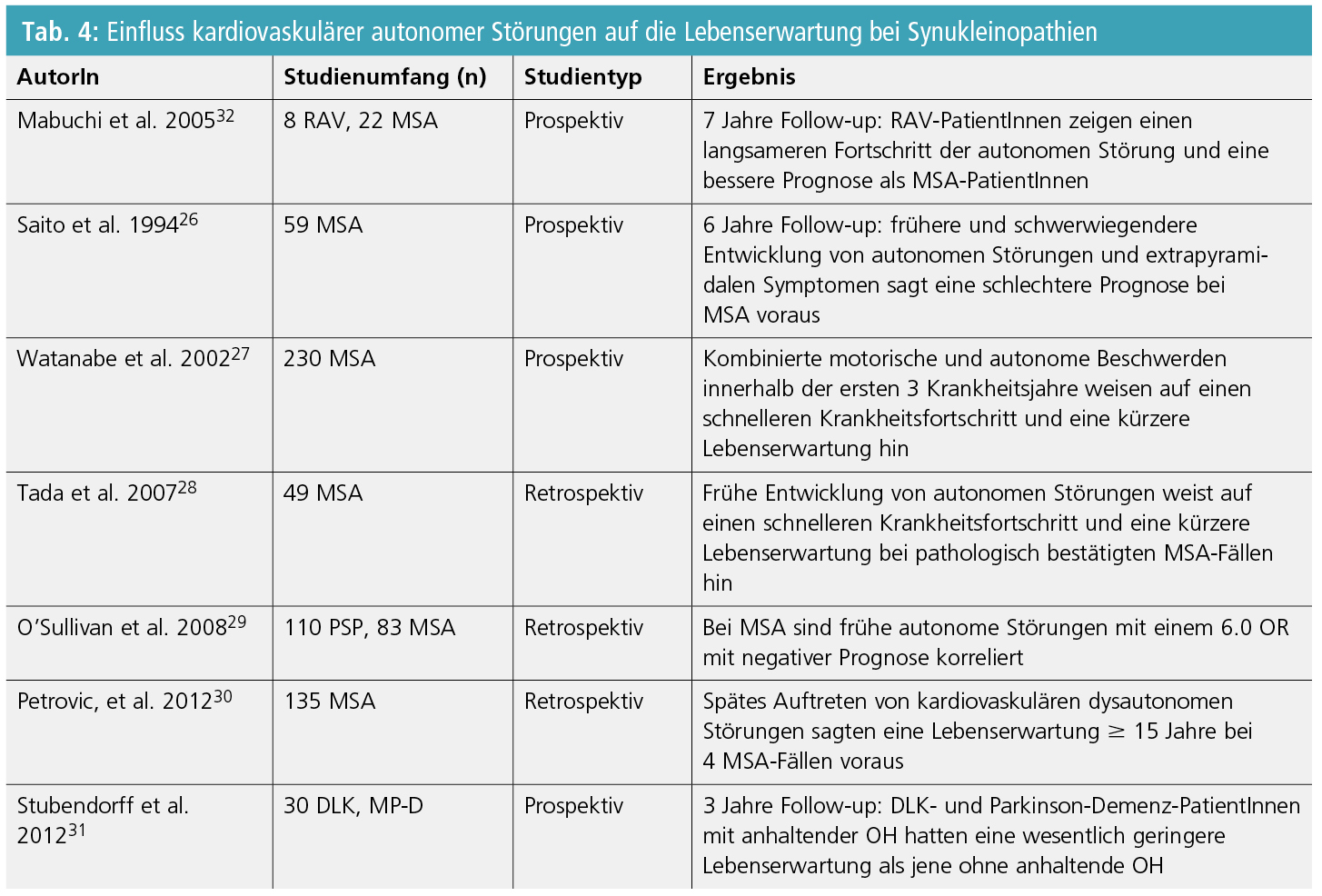
Epidemiologische Daten von verschiedenen Forschungsgruppen lieferten Hinweise für den negativen Einfluss kardiovaskulären autonomen Versagens auf körperliche Behinderung, Krankheitsfortschritt und die generelle Prognose bei Synukleinopathien (Tab. 4). Eine frühe Entwicklung von schwerwiegendem autonomem Versagen, im Besonderen des kardiovaskulären Typs, sagt einen schnelleren Krankheitsfortschritt und eine schlechtere Prognose bei MSA voraus26–29.
In einer aktuellen retrospektiven Analyse von 135 MSA-Fällen von Petrovic et al. stellte sich heraus, dass 4 dieser MSA-Fälle, bei welchen OH zu einem späteren Zeitpunkt auftrat, eine verlängerte Lebenserwartung von ≥ 15 Jahren ab Krankheitsbeginn aufwiesen30. Die nachteilige Wirkung von kardiovaskulärem autonomem Versagen auf die MSA-Prognose wird dadurch weiter untermauert. In einer 3-jährigen prospektiven Studie wurde außerdem berichtet, dass persistierende OH mit einer kürzeren Lebenserwartung auch bei DLK und Parkinson-Demenz-PatientInnen assoziiert ist31.
Schlussfolgerung
Kardiovaskuläres autonomes Versagen beeinflusst die zerebrovaskuläre Prognose sowie die kognitive Performance ebenso wie die Lebenserwartung bei Synukleinopathien (Tab. 2–4). OH beeinträchtigt die alltäglichen Aktivitäten sowie die Lebensqualität19, 33, 34 und induziert bei Parkinson-PatientInnen durch Verstärkung des Sturz- und Frakturrisikos potenzielle lebensbedrohliche Konditionen.
Derzeit wird der prognostische Einfluss der kardiovaskulären autonomen Störung in verschiedenen Krankheitsstadien von Synukleinopathien diskutiert. Tatsächlich könnten ältere und/oder fortgeschrittene Fälle eine anfälligere Untergruppe von PatientInnen sein. Alternativ könnte allerdings auch frühes und schwerwiegendes Eintreten von kardiovaskulärem autonomem Versagen ein Hauptfaktor für eine negative Prognose des natürlichen Verlaufs von Synukleinopathien sein.
Hypothetisch könnte kardiovaskuläres autonomes Versagen vaskuläre Veränderungen in einem degenerierenden Gehirn wie bei Synukleinopathien fördern, dadurch kompensierende Mechanismen behindern, den Krankheitsfortschritt beschleunigen und Symptome verschlechtern. Sollte das der Fall sein, müsste eine frühe Abklärung und Behandlung kardiovaskulären autonomen Versagens bei jenen PatientInnen durchgeführt werden, bei welchen vermutet wird, dass sie unter einer der genannten Bewegungsstörungen leiden, um durch gezielte Therapie der OH und begleitender Symptome den Outcome zu verbessern.