DPD-Testung vor dem Einsatz 5-FU-hältiger Chemotherapie
Fluorouracil(FU)-hältige Arzneimittel zählen zu den am häufigsten eingesetzten Zytostatika in der systemischen Tumortherapie. Anfang Juli dieses Jahres hat die EMA eine Empfehlung ausgesprochen, Patienten vor Beginn der Behandlung mit 5-FU (als Injektion oder Infusion) und den oralen Prodrugs Capecitabin und Tegafur auf einen DPD-Mangel zu testen.1 Ein bekannter vollständiger DPD-Mangel ist wie bislang eine Kontraindikation für die genannten Substanzen.
Bei Patienten mit partiellem DPD-Mangel soll eine reduzierte Anfangsdosis in Betracht gezogen werden. Bei guter Verträglichkeit können/sollen die Folgedosen erhöht werden. Die Gesellschaften für Hämatologie und Medizinische Onkologie der DACH-Region (Deutschland, Österreich, Schweiz) haben daraufhin ein Positionspapier zur DPD-Testung erarbeitet, das online abrufbar ist.2 Mitwirkende aus österreichischer Sicht waren Professor Wolfgang Eisterer (Klagenfurt), Professor Wolfgang Hilbe (Wien) und Professor Ewald Wöll (Zams).
Implikationen für die onkologische Praxis, die sich aus der Empfehlung zur DPD-Testung ergeben, waren auch Thema eines OeGHO-Webinars, das von Primarius Ewald Wöll im Juli dieses Jahres moderiert wurde. Impulsreferat: Primarius Wolfgang Eisterer; Diskussion: Primaria Birgit Grünberger, Professor Wilfried Renner
Hintergrund
Angestoßen wurde die EMA-Stellungnahme v. a. durch eine französische „Real life“-Studie, die hochrechnet, dass jährlich 76.200 Patienten in Frankreich mit einer Fluoropyrimidin-hältigen Chemotherapie behandelt werden. Davon würden 1.200 Patienten eine lebensbedrohliche Toxizität erleiden bzw. 150 Patienten pro Jahr versterben.3
Zentraler Wirkmechanismus von 5-FU ist die Inhibition der Thymidylat-Synthase (TS). Entscheidend ist die intrazelluläre Metabolisierung. Dabei werden nur 10–20 % des Zytostatikums intrazellulär zu den aktiven Metaboliten umgewandelt. 80–90 % werden durch Dihydropyrimidin-Dehydrogenase (DPD) zu inaktiven Metaboliten abgebaut. DPD ist das geschwindigkeitsbestimmende Enzym beim Abbau des Chemotherapeutikums und dessen Prodrugs. Eine bekannte, vollständig fehlende DPD-Aktivität gilt bereits als Kontraindikation für die Therapie mit FU-hältigen Arzneimitteln. Eine pharmakologische DPD-Blockade erhöht die intrazelluläre Konzentration von 5-FU und führt zu einer höheren Rate aktiver Metaboliten und wird im DGHO-OeGHO-SGMO-Positionspapier als Grundlage der Kombinationstherapie mit Folinsäure angeführt.
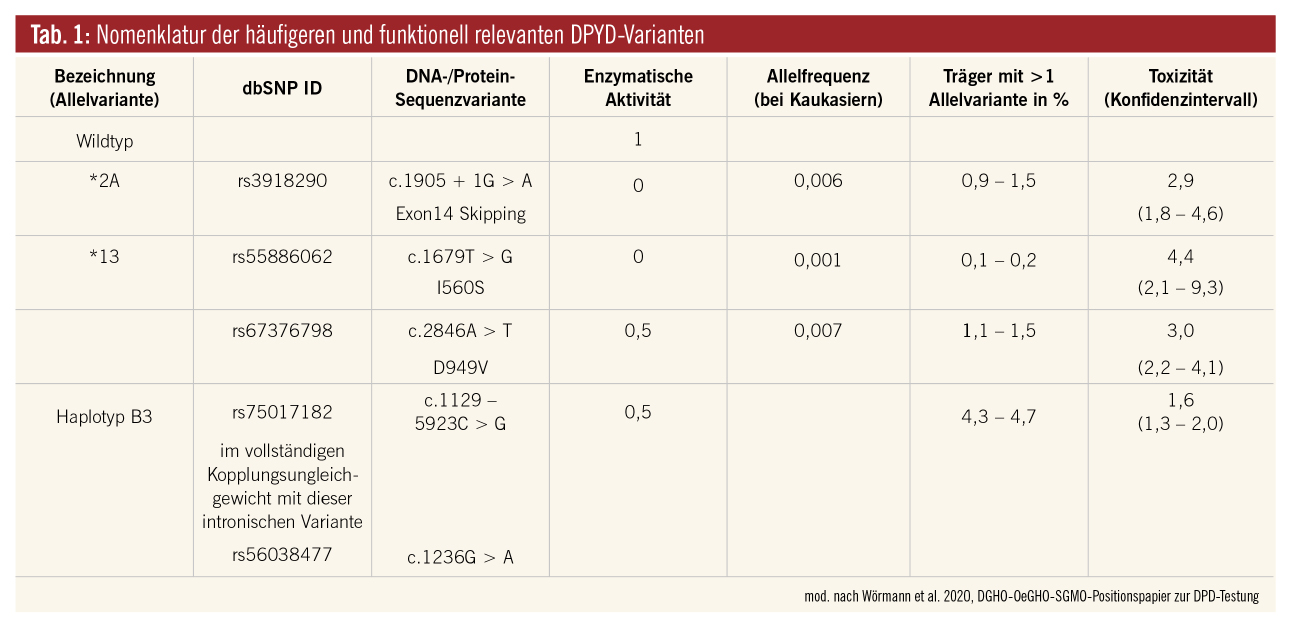
DPD wird vom DPYD-Gen kodiert. Verschiedene Polymorphismen im DPYD-Gen führen zu einer Enzym-Defizienz. Empfohlen wird die Testung auf vier Varianten des DPYD-Genotyps (DPYD*2A, DPYD*13, Polymorphismus c.2846A>T und HaplotypB3), die mit keiner/reduzierter Enzymaktivität einhergehen und zu erhöhter/schwerwiegender Toxizität führen können (Tab. 1).
Empfohlen wird eine Genotyp-gesteuerte Reduktion der Initialdosis um 25–50 % (Tab. 2).
Diskussion
Im OeGHO-Webinar wurde festgehalten, dass 5-FU bzw. dessen orale Prodrugs einen breiten Einsatz bei gastrointestinalen Tumoren, dem Mammakarzinom oder bei Kopf-Hals-Tumoren finden und dass der Großteil der Patienten die Substanzen gut tolerieren würde. Die Empfehlung der EMA kam dann plötzlich inmitten von Corona im März dieses Jahres. Professor Wolfgang Eisterer: „Im Prinzip weiß man um die Möglichkeit der DPD-Testung schon lange Bescheid, stand dieser aber bisher eher skeptisch gegenüber.“ Die zentrale Frage war daher, wie die aktuellen Empfehlungen in der klinischen Praxis einzuschätzen und umzusetzen sind. Im Impulsreferat von Professor Eisterer und der anschließenden Diskussion wurden folgende Punkte erörtert.
Wolfgang Eisterer: „Hat der Patient früher bereits eine 5-FU-Therapie erhalten und diese gut vertragen, dann ist eine DPYD-Genotypisierung nicht erforderlich und die Therapie kann wie geplant durchgeführt werden. Wenn es sich allerdings um eine Ersttherapie handelt oder der Patient unter vorangegangener 5-FU-Therapie stärkere Nebenwirkungen entwickelt hat, dann ist die Genotypisierung empfohlen, und zwar mit einem hohen Empfehlungsgrad. Die Empfehlung berücksichtigt allerdings auch die Erkrankungssituation. Wenn eine besonders rasche Therapieeinleitung erforderlich ist, muss ein Testergebnis nicht zwingend abgewartet werden.“
Eine Umfrage unter den zugeschalteten Teilnehmern des Webinars, ob bereits eine routinemäßige DPD-Testung vor dem Einsatz von 5-FU-hältigen Arzneimitteln erfolgt, hat ergeben, dass 1/3 der Teilnehmer dies bejahen und 2/3 verneinen. Von einigen Kollegen werden die Tests schon länger routinemäßig durchgeführt. Gründe für das Nichttesten basieren laut Primaria Birgit Grünberger auf Erfahrungswerten im Umgang mit der Therapie und der Beobachtung, dass gravierende Nebenwirkungen selten sind. Allerdings ändert sich die Praxis unter den gegebenen Vorzeichen. Ein wichtiger Punkt ist die zeitnahe Verfügbarkeit der Testergebnisse.
Birgit Grünberger: „Patienten, die bereits unter Therapie stehen, testen wir nicht. Auch solche Patienten nicht, die die Therapie schon einmal hatten und bei denen keine schweren Nebenwirkungen aufgetreten sind. Wir testen aber bereits alle Patienten, die neu auf die Therapie eingestellt werden. Man muss sich überlegen, wo man die Proben hinschickt. Wir schicken Proben aktuell nach Graz, und es funktioniert ausgezeichnet. Weiters versuchen wir, die Testung bereits im Tumorboard vorauszuplanen, wenn feststeht, dass der Patienten eine 5-FU-hältige Therapie bekommt. Eine entsprechende Aufklärung des Patienten erfolgt ebenfalls. Was die Testung für die klinische Praxis bringt, wird sich erst zeigen müssen. Wenn das Ergebnis aber innerhalb einer Woche verfügbar ist, spricht nichts dagegen. Eine solche Zeitspanne kennen wir auch von der RAS-Testung.“ Die Frage von Primarius Wöll, in welcher Situation auf keinen Fall getestet würde, weil die Klinik so stark im Vordergrund steht, dass man nicht abwarten kann, lässt sich eigentlich nur mit Ausnahmesituationen beschreiben – unter Umständen bei hochsymptomatischen Patienten mit großem Tumordruck.
Ein Grund für die bisherige Skepsis vor einer breiteren routinemäßigen Testung besteht laut Professor Eisterer allerdings auch in der Erfahrung, dass Patienten mit höhergradigen Nebenwirkungen, wenn diese dann getestet wurden, keine Allelträger waren, d. h., es waren Patienten mit normaler Enzymfunktion. Wolfgang Eisterer: „DPD-Mangel erklärt nur einen Teil allfälliger schwerer Toxizitäten, und es sind seit der Lancet-Publikation 2018 auch keine neuen Daten hinzugekommen, sodass die aktuelle, doch deutliche Empfehlung der EMA auch eine gewisse Überraschung ist.“
Wolfgang Eisterer: „Die Evidenz zur Dosisreduktion stammt insbesondere aus einer niederländischen Studie, die 2018 in Lancet Oncology publiziert wurde. In dieser wurden Patienten mit verschiedenen DPYD-Polymorphismen dosisabgestuft behandelt. Wildtyppatienten erhielten die volle Dosis. Mit den Dosisreduktionen wurden keine toxizitätsbedingten Todesfälle und kein höheres Hospitalisierungsrisiko verzeichnet, mit dem zusätzlichen pharmakokinetischen Hinweis, dass die DPYD-gesteuerte Medikamentenexposition bei Allel-Trägern vergleichbar gleich hoch war wie jene bei Wildtyppatienten.“4
Für Primarius Ewald Wöll war der Hinweis wichtig, dass sich die empfohlenen Dosisreduktionen ausschließlich auf die Toxizität beziehen und eine mögliche Beeinträchtigung des Outcomes nicht ausreichend untersucht ist. So steht bei einer Dosisreduktion von 50 % v. a. im adjuvanten Setting auch die Möglichkeit eines Wirkverlusts im Raum, den man derzeit nicht restlos ausräumen kann. Sollte die Dosisreduktion mit einer guten Verträglichkeit einhergehen, wären stufenweise Dosisanpassungen jedenfalls überlegenswert.
Es handelt sich um eine genetische Untersuchung im Sinne des Gendiagnostik-/Gentechnikgesetzes, d. h., es sind bestimmte Vorgaben einzuhalten (Aufklärung, Einwilligung, Durchführung durch einen Arzt und Mitteilung der Ergebnisse). Wolfgang Eisterer: „Die Untersuchung dient der Optimierung der Arzneimitteltherapie, d. h., die Aufklärung darüber ist nicht an eine dezidierte genetische Beratungskompetenz gebunden. Wird allerdings eine klinisch relevante DYPD-Variante gefunden, ist dem Patienten eine genetische Beratung anzubieten. Will der Patient darauf verzichten, muss dies schriftlich dokumentiert werden.“ Wichtig ist laut Primarius Ewald Wöll zudem, dass es sich nicht um eine Erbkrankheit mit ihren Konsequenzen handelt, sondern um einen prädiktiven Test zur Toxizität, sodass die Empfehlung aus einer genetischen Beratung mehrheitlich wohl jene sein dürfte, die Empfehlung des behandelnden Onkologen zu beachten.
Professor Wilfried Renner, Klinisches Institut für Medizinische und Chemische Labordiagnostik, Meduni Graz, führt DPD-Testungen bereits seit über 20 Jahren durch. Seiner Erfahrung nach kommen die geforderten Mutationen nur selten vor, aber doch immerhin bei etwa 10 % der untersuchten Proben. Auch Kliniker in Graz wollen das Ergebnis innerhalb von 7 Tagen verfügbar haben. Wilfried Rennner: „Die Testung selbst ist einfach durchführbar. Die Proben müssen nicht gekühlt sein oder zentrifugiert werden, sind hitzeunempfindlich und können einfach am Postweg oder per Botendienst verschickt werden. EDTA-Blut kann genauso verwendet werden wie Zitratblut. Wichtig ist: Es handelt sich um Keimbahnmutationen, d. h., Tumormaterial ist für die Untersuchung nicht geeignet. Am Befund wird angegeben, ob eine oder mehrere Mutationen gefunden wurden, ob es sich um einen intermediate oder poor metabolizer handelt bzw. welchem DPD-Aktivitätsscore das Ergebnis entspricht. Die Dosierung obliegt dann dem behandelnden Arzt.“ Prinzipiell werden auch alternative Testverfahren wie die Messung von Uracil-Spiegeln genannt, diese wären aber laut Professor Renner schwieriger zu standardisieren, sodass man in den nächsten Jahren nicht damit wird rechnen können.
Wichtig scheint abschließend noch einmal der Hinweis, dass DPD-Enzymaktivitätsmangel nur einen Teil allfälliger Toxizitäten erklären kann. D. h., eine Testung ist kein Garant für das Ausbleiben jeglicher Nebenwirkung. „Man wird Toxizitäten vermindern, aber sicher nicht alle.“ (Wilfried Renner) Es handelt sich um eine Empfehlung, keine gesetzliche Vorgabe, was letztlich aber kein Grund sein sollte, den Test nicht anzubieten. Die Kosten wären jedenfalls überschaubar und sollten übernommen werden.