Immuntherapie beim Kolorektalkarzinom: Wo stehen wir 2019?
Die rezent Nobelpreis-gekürte Entdeckung der Immun-Checkpoint-Inhibitoren hat die Therapie zahlreicher Tumorentitäten revolutioniert. Auch beim Kolorektalkarzinom, der landesweit dritthäufigsten Tumorerkrankung, konnten durch die Implementierung der Immuntherapie Erfolge erzielt werden. Erste Studien haben jedoch gezeigt, dass nur eine Subgruppe von PatientInnen mit Kolorektalkarzinom von dieser Therapie zu profitieren scheint. Daher ist eine akkurate Patientenselektion essentiell.
Immunogenität des Kolorektalkarzinoms
Die Immunogenität eines Tumors spielt eine entscheidende Rolle für das Ansprechen von Immune Checkpoint-Inhibitoren. So scheinen besonders Tumoren mit einer hohen Dichte an Tumor-infiltrierenden Lymphozyten empfänglich für Immuntherapie zu sein. Das Kolorektalkarzinom (KRK) wird im Allgemeinen nicht zu den immunologisch „heißen“ Tumoren gezählt. Rund 15 % aller KRK sind jedoch durch Defekte in DNA-Mismatch-Reparatur(MMR)-Genen charakterisiert und werden als mikrosatelliteninstabil (MSI) bezeichnet. Diese Subgruppe von Tumoren weist eine hohe Mutationslast und eine Präsenz tumorspezifischer Antigene auf, zwei Faktoren, die mit einem guten Ansprechen auf Immuntherapie assoziiert sind.
MSI/MMR-defiziente Kolorektalkarzinome
Keynote-Studien mit Pembrolizumab
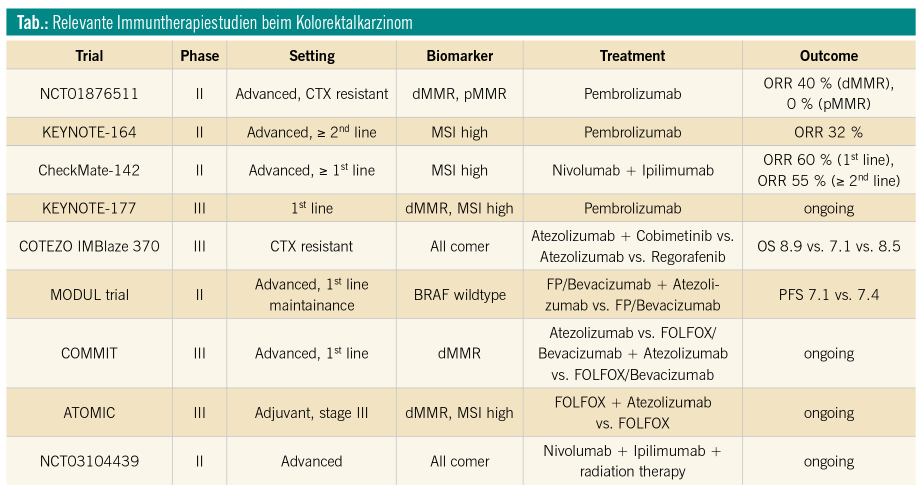
Basierend auf der Annahme großer Mutationslast und damit einhergehender Immunität von Tumoren mit MMR Defekt/Mikrosatelliteninstabilität wurde die KEYNOTE-016 Studie initiiert. Diese Phase-II-Studie untersuchte das Therapieansprechen des PD-1-Inhibitors Pembrolizumab bei behandlungsrefraktären metastasierten Kolorektalkarzinom (mKRK)-PatientInnen mit und ohne MMR-Defizit (dMMR)/Mikorsatelliteninstabilität (MSI). Die objektive Ansprechrate bei dMMR-Tumoren lag bei 40 %, und rund 80 % der eingeschlossenen PatientInnen mit dMMR waren 20 Wochen nach Studienbeginn progressionsfrei. Im Gegensatz dazu lag die Ansprechrate bei Tumoren ohne MMR-Defizit bei 0 %. Basierend auf den vielversprechenden Ergebnissen der KEYNOTE-016-Studie wurden zahlreiche weitere Phase-II/III-Studien mit Immun-Checkpoint-Inhibitoren bei diesem Patientengut initiiert. Eine gepoolte Analyse der KEYNOTE-016- und der KEYNOTE-164-Studie mit Pembrolizumab zeigte Ansprechraten von 36 % und progressionsfreies Überleben über zwölf Monate von ca. 60 %.1, 2 Unter Berücksichtigung dieser beeindruckenden Ergebnisse erteilte die FDA im Frühjahr 2017 die Zulassung für Pembrolizumab bei PatientInnen mit therapierefraktärem metastasiertem KRK mit dMMR/MSI. Eine EMA-Zulassung liegt in dieser Indikation noch nicht vor. Allerdings untersucht die laufende randomisierte Phase-III-Studie KEYNOTE-177 die Effektivität und das Sicherheitsprofil von Pembrolizumab als Erstlinientherapie in dieser Indikation.3 Erste Ergebnisse werden für 2019 erwartet.
CheckMate-Studie mit Nivolumab
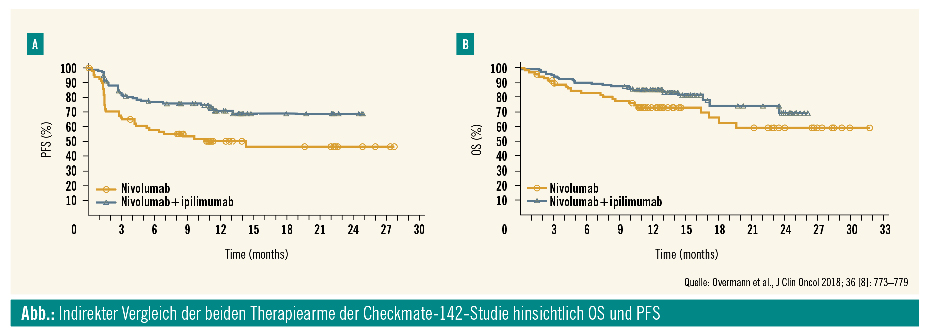
Neben Pembrolizumab wurde auch der PD-1-Inhibitor Nivolumab als Monotherapie oder in Kombination mit dem CTLA-4-Inhibitor Ipilimumab von der FDA für therapierefraktäre PatientInnen mit dMMR/MSI-Kolorektalkarzinomen zugelassen. Die Zulassung beruht auf den Ergebnissen der nicht randomisierten Checkmate-142-Studie. Als Zweitlinientherapie oder als Therapie in späteren Linien konnten mit Nivolumab als Monotherapie Ansprechraten von 31 % und ein 12-Monate-Gesamtüberleben von 73 % erreicht werden. In der Kombination mit niedrig dosiertem Ipilimumab lag die Ansprechrate bei 55 % und das 9-Monate-Gesamtüberleben bei 85 % (Abb.). Die Rate an Grad-3/4-therapieassoziierten Nebenwirkungen lag bei 20 % im Monotherapiearm und bei 32 % im Kombinationsarm.4
Obwohl es sich nicht um einen randomisierten Vergleich handelt, zeigt die Kombinationstherapie aus Nivolumab und Ipilimumab gegenüber Nivolumab-Monotherapie einen numerischen Benefit hinsichtlich des Therapieansprechens. Auf der ESMO-Jahrestagung 2018 wurden erste Ergebnisse aus dem Erstlinienarm der Checkmate-142-Studie mit Nivolumab und Ipilimumab präsentiert. Eingeschlossen wurden PatientInnen mit mKRK und dMMR/MSI, welche vorher noch keine palliative Therapie erhalten hatten. Nach einem medianen Follow-up von 13,4 Monaten lag die Ansprechrate bei 60 % und das 12-Monate-Gesamtüberleben bei 83 %.5 Diese Daten zeigen auf, dass die Kombination aus Nivolumab und Ipilimumab eine weitere wertvolle Therapieoption in der Erstlinie bei PatientInnen mit mKRK und dMMR/MSI darstellen könnte. Eine Testung des DNA-MMR-Status wird daher bei allen mKRK-PatientInnen empfohlen.
COMMIT-Studie mit Atezolizumab
Mit Spannung zu erwarten sind zudem Ergebnisse der COMMIT-Studie, welche FOLFOX/Bevacizumab in Kombination mit dem PD-1-Inhibitor Atezolizumab vs. FOLFOX/Bevacizumab oder Atezolizumab alleine als Erstlinientherapie bei mKRK-PatientInnen mit dMMR/MSI vergleicht.6 Im kurativen Setting läuft zudem eine vielversprechende Phase-III-Studie, welche FOLFOX plus Atezolizumab vs. FOLFOX alleine bei Stadium-III-Patienten mit dMMR/MSI untersucht.7
pMMR/MSS-Kolorektalkarzinome
Rund 95 % aller Kolorektalkarzinome im metastasierten Stadium sind mikrosatellitenstabil (MSS). Bei diesen Tumoren, also der Mehrzahl der Kolorektalkarzinome, blieben größere Erfolge durch Immuntherapie bis dato aus. Demzufolge ist es von größtem klinischem und wissenschaftlichem Interesse, Wege zu finden, immunologisch „heiße“ Tumoren aus den MSS-Tumoren zu selektieren und immunologisch „kalte“ empfänglich für Immuntherapie zu machen. Unabhängig vom DNA- Mismatch-Reparatur-Status scheinen die Anzahl tumorspezifischer Antigene sowie die Dichte an tumorinfiltrierenden Lymphozyten entscheidend für das Ansprechen auf Immuntherapie beim KRK zu sein.8 Rezente präklinische Arbeiten haben gezeigt, dass durch die Verabreichung zytotoxischer Chemotherapie und Radiotherapie eine antineoplastische Immunreaktion ausgelöst werden kann. Es wird angenommen, dass der gesteigerte Tumorzelltod in einer vermehrten Präsentation tumorspezifischer Antigene resultiert und somit eine tumorspezifische Immunabwehr ausgelöst wird. Basierend auf diesen Erkenntnissen wurden zahlreiche Studien mit dem Ziel initiiert, den synergistischen Effekt von Immuntherapeutika in Kombination mit zytotoxischen Therapiemodalitäten bei MSS-KRK zu untersuchen. Bis dato konnte jedoch auch mit dieser Strategie kein Durchbruch in der immuntherapeutischen Behandlung erreicht werden. In der COTEZO-IMBlaze-370-Studie konnte in der Drittlinientherapie beim fortgeschrittenen MSS-KRK kein signifikanter Überlebensvorteil mit der Kombinationstherapie aus Atezolizumab und dem MEK-Inhibitor Cobimetinib gegenüber Regorafenib alleine erreicht werden.9 Auch erste Ergebnisse der am ESMO 2018 präsentierten MODUL-Studie, welche die Kombination aus Fluoropyrimidin plus Bevacizumab plus Atezolizumab vs. Fluoropyrimidin plus Bevacizumab als Erstlinienerhaltungstherapie bei BRAF-Wildtyp-mKRK untersucht, zeigten keinen Überlebensvorteil für den Immuntherapiearm.10 Es bleibt abzuwarten, ob mittels Radiotherapie die Effektivität von Immun-Checkpoint-Inhibitoren gesteigert werden kann.
Conclusio
Die Immuntherapie mit Immun-Checkpoint-Inhibitoren stellt eine neue wertvolle Therapieoption in der Behandlung des mKRK dar. Bis dato beschränken sich Erfolge jedoch auf die kleine Subgruppe der PatientInnen mit dMMR/MSI-Tumoren. Diese scheinen sowohl in der Erst- als auch in weiteren Therapielinien von einer Immuntherapie zu profitieren. Eine Zulassung der EMA ist beim mKRK noch nicht erfolgt. Der „off label use“ der Immun-Checkpoint-Inhibitoren Pembrolizumab und Nivolumab ± Ipilimumab sollte bei histologisch verifiziertem dMMR/MSI-Status jedoch in Erwägung gezogen werden. Bei PatientInnnen mit MSS-Tumoren ist zum jetzigen Zeitpunkt eine Behandlung mit Immuntherapeutika außerhalb klinischer Studien nicht indiziert.