Orale Therapie der akuten myeloischen Leukämie 2019
Hintergrund
Bei der Therapie von chronischen Leukämien, chronisch myeloischer Leukämie (CML) oder chronisch lymphatischer Leukämie (CLL), sind rein orale und damit ambulant durchführbare Therapien bereits Realität. Die initiale Therapie der akuten myeloischen Leukämie (AML) ist aufgrund der Schwere der Erkrankung meist nur stationär durchführbar. In den letzten Jahren kam es aber zu einer Reihe von Neuzulassungen oraler Medikamente durch die Arzneimittelbehörden FDA und EMA für die Therapie der AML. Im Folgenden sollen der aktuelle Stand der oralen Therapie der AML sowie deren Nutzen und Nebenwirkungsprofil beleuchtet werden.
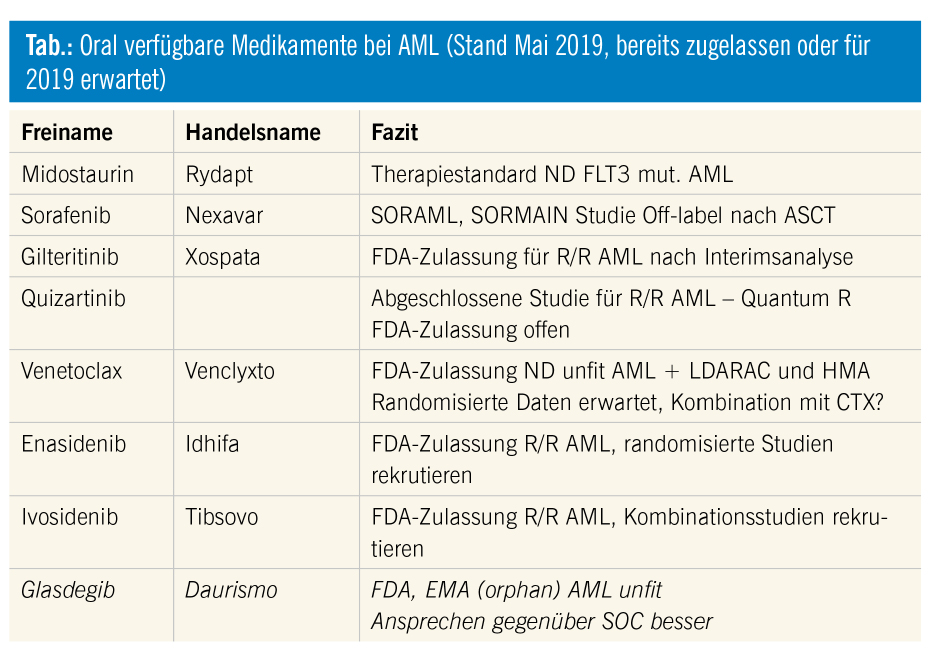
Die AML ist keine uniforme Erkrankung, viele krankheitsrelevante Gene und „drugable targets“ sind bereits bekannt. Chemotherapie und allogene Stammzelltransplantation sind nicht mehr für alle Patienten die einzigen Therapiemöglichkeiten und es sind mit Stand 2019 eine Reihe von oralen Medikamenten für die Therapie der AML verfügbar (Tab.).
Tyrosinkinaseinhibition
Wie viele andere zielgerichtete Therapien in der Onkologie kommt Midostaurin aus der Gruppe der Rezeptortyrosinkinasen. Midostaurin stellt nach signifikanter Verbesserung der Ergebnisse in der Ersttherapie der FLT3-ITD-positiven AML in Kombination mit Chemotherapie die einzige von der FDA und der EMA zugelassene Therapie in dieser Krankheitsentität dar. Allerdings hat der Multikinaseinhibitor Midostaurin als Monotherapie nur eine begrenzte Wirkung. Weitere Studien untersuchen derzeit die orale Substanz in der Erhaltungstherapie nach allogener Stammzelltransplantation. Für die Rezidivbehandlung stehen uns wahrscheinlich auch in Europa mit Gilteritinib, Quizartinib und Crenolanib bald weitere TKIs der zweiten Generation zur Verfügung. Für Quizartinib und Gilteritinib wurden bereits Studien in der Monotherapie bei rezidivierter und refraktärer AML präsentiert, die eine Verbesserung gegenüber Standardtherapie mit einer höheren Remissions- und Transplantationsrate sowie einem verbesserten Gesamtüberleben zeigten.
Rezidive nach allogener Transplantation FLT3-mutierter AML stellen ein großes therapeutisches Problem dar. Die deutsch-österreichische SORMAIN-Studie randomisierte den Multikinaseinhibitor Sorafenib gegen Placebo für ein Jahr nach allogener Transplantation gegen Standard-of-care (SOC). Dabei zeigte die experimentelle Gruppe eine signifikante Verbesserung des rezidivfreien Überlebens und des Gesamtüberlebens. Somit stellt Sorafenib einen neuen Therapiestandard nach allogener Transplantation bei FLT3-ITD-positiver AML dar.
Zielgerichtete Therapie der IDH-Mutationen
IDH-Enzyme sind wichtige Gene im Krebszyklus, Mutationen von IDH1 und IDH2 treten zusammen in etwa 25 % der AML auf und führen zu einem Maturationsarrest durch epigenetische Veränderungen. Mit Enasidenib und Ivosidenib sind aufgrund von Phase-I-Daten bereits zwei verfügbare Substanzen für die rein orale Therapie von rezidivierter/refraktärer (r/r) AML mit IDH2- bzw. IDH1-Mutation von der FDA zugelassen. Die Therapie war in den ersten Studien prinzipiell sehr gut verträglich, in etwa 10–20 % tritt ein Differenzierungssyndrom auf, welches generell gut mit Kortikosteroiden behandelt werden kann. Dieses Syndrom kann auch oft erst im Verlauf, manchmal auch nach 4–6 Monaten zum Problem werden. In der Monosubstanz können etwa 40 % komplette Remissionen erreicht werden, nun werden die beiden Substanzen in der Kombination mit HMA und einer Standardinduktionschemotherapie untersucht. Die Remissionsraten und auch die Zahl an MRD-negativen CRs konnten deutlich gesteigert werden. Die kumulative Toxizität war akzeptabel, lediglich die Verlängerung der hämatologischen Rekonstitution in der Kombination ist zu beachten.
BCL2-Inhibitor Venetoclax und AML
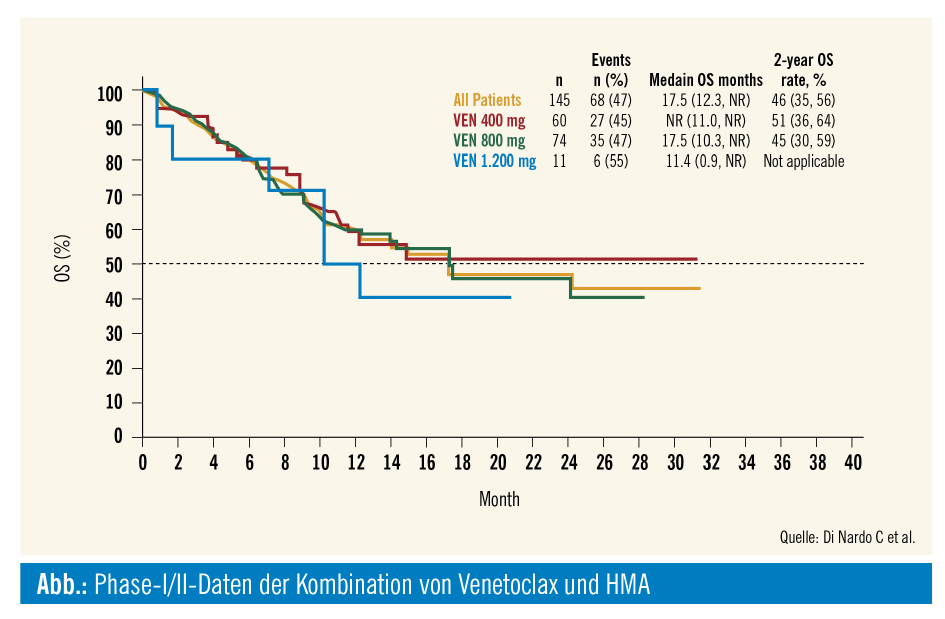
BCL2 ist ein anti-apoptotisches Protein, p53 ein wichtiger Regulator der Apoptose. Mit Venetoclax (VEN) ist ein BCL2-Inhibitor in den USA in der Kombination mit hypomethylierenden Substanzen (HMA) sowie niedrig dosiertem ARAC (LDARAC) bereits zugelassen. Neue Updates der Phase-I/II-Kombinationsstudien mit LDARAC bei neu diagnostizierten, unfitten Patienten mit AML zeigten ein rasches Ansprechen auf die Therapie (median 1,4 Monate) sowie eine Verbesserung der CR/CRi-Rate auf 54 % vs. 11 % gegenüber einer historischen Kontrollgruppe. Das mediane Gesamtüberleben (OS) lag bei 10,1 Monaten. Noch eindrucksvollere Resultate konnten in der Kombination mit HMAs erreicht werden, die CR-Raten mit AZA lagen bei 71 %, mit Decitabin bei 74 %, mit einem OS von etwa 16 Monaten für beide HMA-Kombinationen (Abb.).
Ebenfalls interessante erste Ergebnisse zeigt die CAVEAT-Phase-1b-Studie, wobei bei älteren AML-Patienten VEN mit einer attenuierten Chemotherapie kombiniert wurde. Gute Remissionsraten (> 80 %) wurden bei de-novo AML-Patienten sowie NPM1-, RUNX1-, RAS- und IDH-Mutation erzielt, während vorangehende Therapien mit HMA, sekundärer AML, p53 Mutation sowie Hochrisikokaryotyp mit einem schlechteren Ergebnis vergesellschaftet waren.
Auch die Interimsanalyse der DEC10-VEN-Studie zeigte ein gutes Sicherheitsprofil und exzellentes Ansprechen – CR/CRi 96 % bei de-novo AML, 71 % bei sAML und 55 % bei r/r AML mit Erreichen einer MRD-negativen CR in 52 %, 40 % bzw. 50 %.
Nebenwirkungen der Therapie mit Venetoclax sind oft anhaltende Zytopenien, das von der Therapie der CLL bekannte Tumorlysesyndrom tritt bei der AML eher selten auf.
Resümee
Insgesamt kann optimistisch in die Zukunft der AML-Behandlung geblickt werden. Viele Experten wünschen sich aber eine Bestätigung der hervorragenden ersten Ergebnisse durch größere Phase-III-Studien, um einen Selektionsbias hintanzuhalten und mehr Sicherheitsdaten für die Patienten mit AML zu gewinnen.