Nahrungsmittelallergien bei Kindern
Hautveränderungen wie Flush, Urtikaria oder Verschlechterung eines atopischen Ekzems, kolikartige Bauchschmerzen, Übelkeit, Erbrechen, Durchfall, verlegte Nase, Atemwegs- und Kreislaufbeschwerden bis hin zur Anaphylaxie können Symptome einer IgE- oder nicht- IgE-vermittelten Nahrungsmittelallergie (NMA) sein, differenzialdiagnostisch kommen auch andere Erkrankungen in Frage. Führen im Erwachsenenalter meist Unpässlichkeiten und manchmal Intoleranzen zur Annahme einer NMA – manchmal bestehen auch sekundäre pollenassoziierte NMA mit bevorzugt oraler Allergiesymptomatik –, stehen im Kindesalter primäre NMA zahlenmäßig deutlich im Vordergrund. Dabei ist die Symptomatik klarer, stärker und häufig auch bedrohlich. Die Herausforderung der Abklärung von NMA liegt gerade darin, eine differenzierte Diagnose zu erarbeiten.1–3
Als Leitfaden für die Bearbeitung von Diagnostik und Management von NMA dient in dieser Arbeit eine Hitliste „häufig gestellter Fragen“ von Betroffenen.
Auf Epidemiologie, detaillierte Definitionen und Pathophysiologie der jeweiligen IgE-und nicht-IgE-vermittelten NMA wird nicht eingegangen und auf die einschlägige Literatur verwiesen.2, 4–8
Wann soll eine Nahrungsmittelallergie vermutet werden?
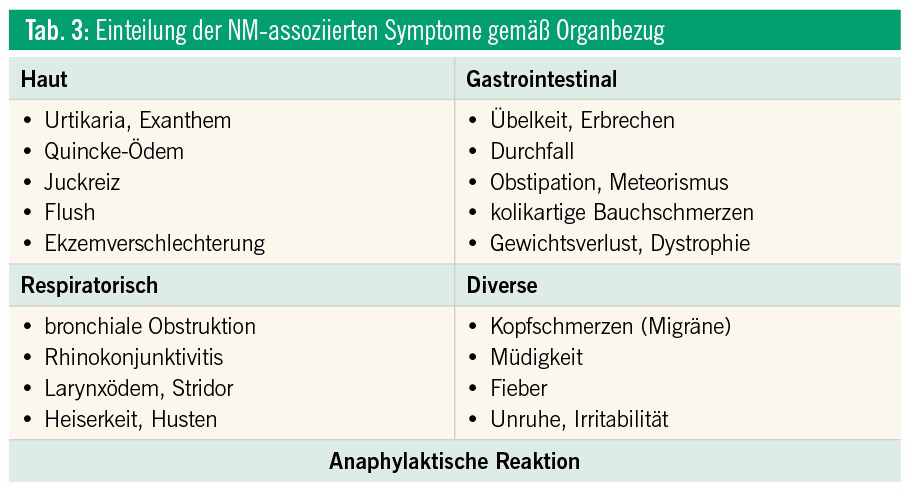
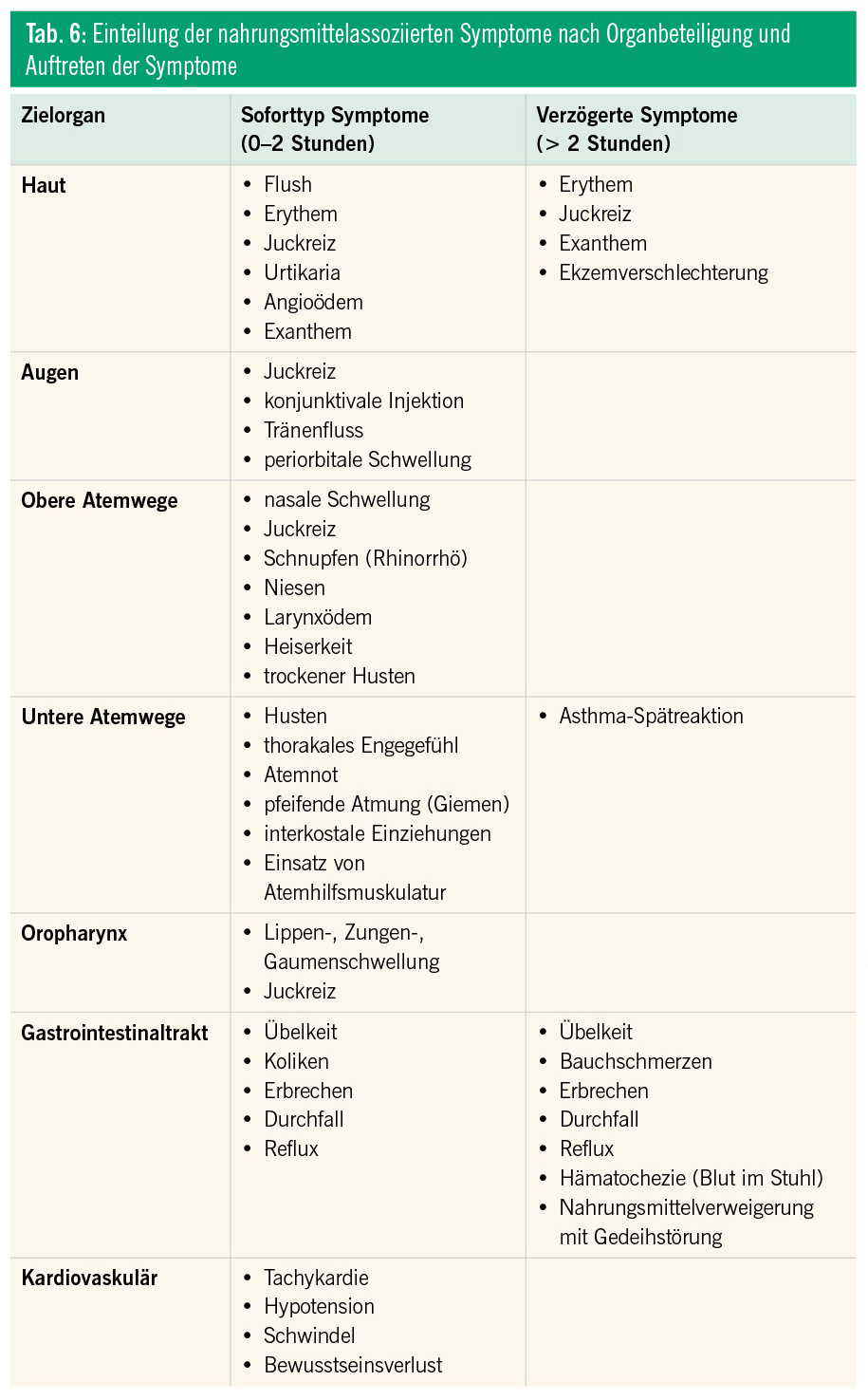
An eine IgE-vermittelte NMA ist bei raschem Auftreten der Symptomatik (innerhalb von 0–2 Stunden) nach Exposition zu denken (Tab. 1).9 Eine nicht-IgE-vermittelte NMA kann bei verzögertem Auftreten der Beschwerden (2–24/48 Stunden) nach Exposition vermutet werden (Tab. 1, 2, 3 und 6). Bei einer IgE-vermittelten Sofortreaktion können die Symptome meist sehr genau geschildert werden, bei einer Spätreaktion ist die Anamnese selten schlüssig.
Bis zu 20 % der Eltern glauben, dass ihr Kind allergisch auf ein Nahrungsmittel (NM) reagiert. Tatsächlich leiden unterschiedlich je nach Ländern (nur) 0,5–4 % an einer IgE-vermittelten NMA.4, 9 Häufig zu Unrecht vermutet wird eine NMA bei unspezifischen Symptomen sowie einer Erkrankung bei einem Geschwisterkind. Zu differenzieren ist zwischen einer IgE-vermittelten und einer nicht-IgE-vermittelten NMA, daneben sind auch noch die Intoleranzen zu berücksichtigen (Tab. 1).9
Welche Fragen sollen in der Anamnese gestellt werden?
Die Anamneseerhebung umfasst die Familienanamnese, die Eigenanamnese und die spezielle Ernährungsanamnese. Berichtete Symptome sollten mit ihrem örtlichen, zeitlichen und situativen Auftreten sowie im Zusammenhang mit der Zubereitung der Nahrungsmittel erfasst werden. Wichtig ist auch die Erhebung von konsumierten Nahrungsmitteln in Zeiten völliger Beschwerdefreiheit. Stabile Phasen sind sehr wichtig, um eine Reaktion auf ein Nahrungsmittel ausschließen zu können. Bei gestillten Säuglingen ist die Ernährung der Mutter zu erfragen, da Proteine eines jeden von der Mutter gegessenen Nahrungsmittels in individuell unterschiedlicher Konzentration in der Muttermilch enthalten sind. Ein prospektiv geführtes Symptomtagebuch hilft oft, Zusammenhänge zu klären (Tab. 4 und 7).
Worauf ist bei der körperlichen Untersuchung zu achten?
Die körperliche Untersuchung folgt einer strukturierten physikalischen Untersuchung. Neben den Symptomen, die mit einer NMA assoziiert sein können, sind alle weiteren Auffälligkeiten zu erfassen. In Zusammenschau der spezifischen Anamnese und der physikalischen Untersuchung (aktuelle Symptome) ist eine Verdachtsdiagnose zu formulieren. Die klinische Untersuchung ist selten ergiebig, da zum Zeitpunkt der Untersuchung meist keine Symptome vorliegen. Eine Fotodokumentation der Eltern kann sehr hilfreich sein und soll auch prospektiv unterstützt werden. Zur Erhärtung dieser Verdachtsdiagnose sind dann weiterführende diagnostische Maßnahmen einzusetzen (Tab. 3 und 6).
Wie ist bei Verdacht auf eine IgE-vermittelte NMA diagnostisch vorzugehen?
Die Anamnese gibt die weiteren Abklärungsschritte vor (Tab. 4). Umfang und Reihenfolge der Sensibilisierungstestungen orientieren sich an der Krankengeschichte, am Alter des Patienten und an der Verfügbarkeit von Testextrakten. Ein einzelner Test (spezifisches IgE oder Haut-Prick-Test) reicht zumeist aus, um eine Sensibilisierung auf ein Nahrungsmittel festzustellen. Ist bei hinweisender Anamnese auf eine Kuhmilch- oder Hühnereiallergie der erste dieser beiden Tests negativ, sollte immer der jeweils andere auch durchgeführt werden, da spezifisches IgE und Haut- Prick-Test bei diesen Nahrungsmitteln im Kindesalter bei einem Viertel der Patienten nicht übereinstimmen.10 Werden beide Tests durchgeführt, und stimmen diese nicht überein, ist das positive Ergebnis eher richtig als das (falsch) negative. Ergibt sich aus der Anamnese ein klarer Verdacht einer Reaktion auf ein Nahrungsmittel, und erbringt der Sensibilisierungstest ein passendes Ergebnis, kann die Diagnose zumeist gestellt werden. Der Atopy-Patch- Test mit zumeist nutritiven Allergenquellen hat sowohl für die IgE- wie auch die nicht- IgE-vermittelte NMA eine sehr eingeschränkte Bedeutung und wird daher generell nicht empfohlen.3 Bleibt die Problematik unklar, kann als weiterer Schritt eine diagnostische Eliminationsdiät hilfreich sein. Wenn unter dieser eine Symptomverbesserung erzielt worden ist, sollte als letzter, aber wichtiger Schritt im Anschluss eine Nahrungsmittelprovokation unter ärztlicher Aufsicht, vorzugsweise unter stationären Bedingungen erfolgen. Bei positivem Sensibilisierungstest auf bisher oder über eine längere Zeit eliminierte Nahrungsmittel kann der Test in seiner Wertigkeit nur mit einer Provokation überprüft werden.
Aber auch der Nachweis von spezifischen IgE besagt lediglich eine Sensibilisierung und ist keinesfalls mit dem Beweis einer klinischen Aktualität gleichzusetzen. Auch nach Entwicklung einer Toleranz (d. h. der Körper verträgt ein bisher nicht vertragenes Nahrungsmittel wieder) können die IgE-Werte (zumindest) über Jahre positiv bleiben. Die Vorteile der Bestimmung der spezifischen IgE-Antikörper gegenüber Hauttests liegen in der Gefahrlosigkeit der Untersuchung, in der Unbeeinflussbarkeit durch momentane allergische Symptome und Unabhängigkeit von einer antiallergischen Therapie sowie einer allgemein besseren Akzeptanz durch Kind und Eltern.
Die Auswahl der untersuchten spezifischen IgE-Antikörper orientiert sich in der Regel an der Anamnese und kann bei (noch) eingeschränkter Ernährung primär meist auf einige wichtige Nahrungsmittel beschränkt werden (z. B. Kuhmilch, Hühnerei, Erdnuss, Fisch, Soja, Weizen). Falls kein spezieller Verdacht vorliegt, wird eine Abklärung mit den eben genannten Nahrungsmitteln durchgeführt. Viele relevante Nahrungsmittel sind molekular charakterisiert, und es lassen sich zahlreiche Allergenmoleküle auf deren IgE-Reaktivität bestimmen. Mithilfe des IgE-Erkennungsprofils soll die individuelle klinische Relevanz einer Sensibilisierung und eine Risikoabschätzung ermöglicht werden. Es wurden für einige Nahrungsmittelallergene Markermoleküle identifiziert, deren klinische Treffsicherheit noch zu prüfen ist.11–16 Hauttests mit verschiedenen Nahrungsmitteln werden meist als Prick- Test durchgeführt. Diese sollten – soweit möglich – mit dem nativen Nahrungsmittel und nicht mit kommerziellen Allergenextrakten durchgeführt werden, da die Qualität der Extrakte durch die unterschiedliche Stabilität der Nahrungsmittelallergene eingeschränkt ist. Dieses Verfahren lässt sich nicht nur mit flüssigen Nahrungsmitteln (wie Kuhmilch, Ei, Sojadrink) verwirklichen, sondern als sog. Prick-Prick-Test auch mit festen Nahrungsmitteln (z. B. Nüssen) durchführen. Dabei wird die Prick-Lanzette zuerst in das entsprechende Nahrungsmittel gestochen („geprickt“) und dann in die Haut des Patienten gestochen. Es wird genügend Allergen übertragen, um bei sensibilisierten Kindern eine Hautreaktion zu provozieren. Hauttests mit Nahrungsmitteln können prinzipiell in jedem Alter durchgeführt werden.
Welche Testverfahren sollen nicht verwendet werden?
Nachweislich untauglich zur Diagnostik von Nahrungsmittelallergien sind Bioresonanz, Kinesiologie, Elektroakupunktur, zytotoxischer Lebensmitteltest (Methoden ohne Aussagekraft und/oder Überprüfung), Lymphozytentransformationstest, nahrungsmittelspezifisches IgG und IgG4 (Methoden mit unzulässiger Interpretation).17
Wann ist die Nahrungsmittelprovokation einzusetzen?
Eine Nahrungsmittelprovokation ist der letzte und beweisende Schritt in der Abklärung einer NMA (Tab. 4). Sie ist Grundlage für eine gesicherte Erweiterung des Nahrungsspektrums, ermöglicht die Instruktion hinsichtlich einer Allergen-Elimination und eine Einschätzung des Risikos für schwere Reaktionen.
Sie ist u. a. indiziert bei (a) unklarer diagnostischer Gesamteinschätzung trotz detaillierter Anamnese und Testresultate, (b) vermuteter allergischer Reaktion, bei welcher der Auslöser trotz Allergiediagnostik unklar bleibt, (c) Nachweis einer Sensibilisierung, wenn das entsprechende Nahrungsmittel bisher nicht oder nur in kleinen Mengen gegessen wurde, (d) Bestätigung der klinischen Verträglichkeit nach Besserung der klinischen Symptome unter einer diagnostischen Eliminationsdiät, z. B. atopisches Ekzem, und (e) zur Überprüfung einer natürlichen Toleranzentwicklung.18
Der „Goldstandard“ der NM-Allergiediagnostik ist die doppelblind placebo-kontrollierte orale Nahrungsmittelprovokation (DBPCFC).15, 18–20 Patienten mit klar zuzuordnenden (anaphylaktischen) Reaktionen auf ein Nahrungsmittel und entsprechend positivem Sensibilisierungstest werden keiner Provokationstestung unterzogen. DBPCFC können in jedem Alter durchgeführt werden, also auch bereits im Säuglingsalter. Generell verfolgen Nahrungsmittelprovokationen zwei Ziele:
- einerseits verursachende Allergene zu entdecken, um sie in der Folgezeit (bis zu einer eventuellen Toleranzentwicklung) zu eliminieren, und
- andererseits zu beweisen, dass Nahrungsmittel für das Beschwerdebild keine Rolle spielen und somit unnötige Diäteinschränkungen verhindert werden können.
In der täglichen Praxis ist Letzteres zahlenmäßig ebenso häufig und als Indikation zur DBPCFC genauso wichtig wie Ersteres. Ein negatives Ergebnis einer Provokationstestung kann für die zukünftige Ernährungssituation ebenso wichtig sein wie ein positives, da unnötige Diäten dem Kind wertvolle Bausteine der Ernährung vorenthalten.
Wie ist bei Verdacht auf nicht-IgE-vermittelte NMA vorzugehen?
Das Vorgehen bei IgE- und nicht-IgE-vermittelten NMA unterscheidet sich prinzipiell nicht voneinander. Ein negativer Sensibilisierungstest schließt eine klinisch relevante NMA nicht sicher aus. Da „Hilfsuntersuchungen“ fehlen, ist für die Diagnose ein klarer und reproduzierbarer Zusammenhang zwischen Auftreten der Beschwerden und Aufnahme bestimmter Nahrungsmittel sowie eine Besserung der Symptome unter Karenz noch wichtiger. Dabei helfen eine diagnostische Eliminations- und Provokationstestung.
Da bei nicht-IgE-vermittelten NMA (z. B. eosinophile Gastroenteropathie, nahrungsmittelinduzierte Enterocolitis) eine Toleranzentwicklung rascher eintreten kann, ist es sinnvoll, eine solche in kürzeren Abständen zu überprüfen.3
Wie sind IgE-vermittelte und nicht-IgE-vermittelte NMA zu behandeln?
Für die Ernährungstherapie, d. h. für die Elimination des symptomauslösenden Nahrungsmittels, spielt es keine Rolle, ob eine IgE- oder eine nicht-IgE-vermittelte Ursache zu Grunde liegt. Das zu mei dende Nahrungsmittel muss bis zur Toleranzentwicklung strikt gemieden werden. Davon abzugrenzen sind die Nahrungsmittelunverträglichkeiten (nicht immunologisch) (Tab. 1). Bei IgE-vermittelter NMA ist gemäß Schweregrad die Versorgung mit einem Adrenalin-Autoinjektor und weiteren Akutmedikamenten zu bedenken. Bei akuter nicht-IgE-vermittelter NMA ist für eine rasche Hydrierung (oral, i. v.) im Akutfall zu sorgen.
Ist die Diät das einzige zielführende Verfahren?
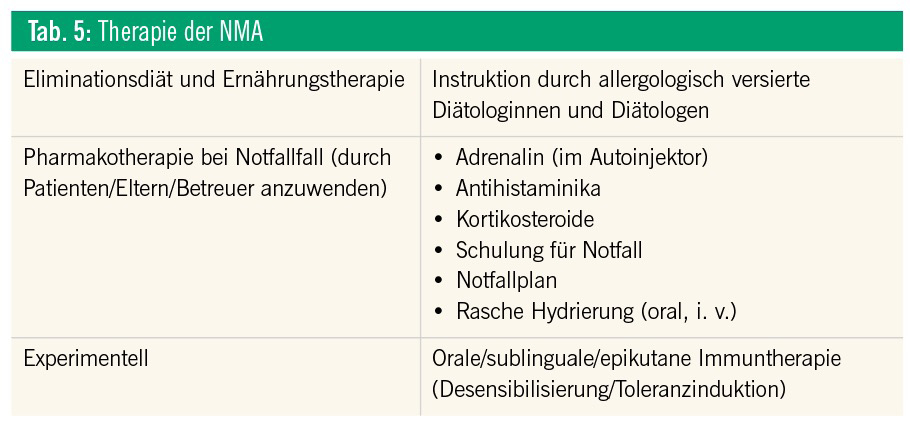
Therapiemöglichkeiten bei NMA umfassen Eliminationsdiäten und Pharmakotherapien (Tab. 5).15 Eine Beeinflussung des natürlichen Verlaufs von NMA ist nach heutigem Verständnis nur sehr eingeschränkt zu erzielen. Diätempfehlungen für therapeutische Eliminationsdiäten müssen auf einer präzisen Diagnostik durch Spezialisten beruhen und sind im Kindesalter aufgrund der Möglichkeit einer Toleranzentwicklung für einige NM nur für 12–24 Monate gültig. Nach dieser Zeit muss die klinische Aktualität neu evaluiert werden. Ärztlich verordnete Diätempfehlungen können nur in Form einer ausführlichen Instruktion durch geschulte Diätologinnen und Diätologen umgesetzt werden. Dabei wird auch auf die Vermeidung einer Mangelernährung geachtet. Insbesondere bei der Kuhmilchallergie stehen uns heute gute, stark hydrolysierte Formulanahrungen oder Aminosäurenahrungen zur Verfügung. Die Schulung der Patienten und ihrer Familien umfasst neben der diätetischen Schulung auch das Erkennen von allergischen Frühsymptomen und die Behandlung allergischer Reaktionen nach dem versehentlichen Genuss zu eliminierender NM.2, 9
Eine Pharmakotherapie (z. B. Verabreichung von Antihistaminika oder Steroiden bei leichteren Symptomen) ist nur als kurzfristige, symptomatische Therapie beim Auftreten allergischer Symptome zu betrachten. Eine prophylaktische Dauertherapie mit Antihistaminika oder Steroiden ist nicht zielführend und nicht indiziert. Antihistaminika mögen zwar einige IgE-vermittelte Reaktionen an der Haut oder Schleimhaut abschwächen, haben aber wenige Effekte auf systemische Reaktionen, die über die Haut hinausgehen.21 Die Behandlung nahrungsmittelinduzierter anaphylaktischer Reaktionen ist immer ein Notfall. Patienten, die früher anaphylaktische Reaktionen hatten, unter Asthma bronchiale leiden oder allergisch auf Erdnüsse, Nüsse, Fisch oder Schalentiere sind, haben ein erhöhtes Risiko, eine anaphylaktische Reaktion zu erleiden. Diese Patienten sollen immer Epinephrin (Adrenalin) als Autoinjektor dabei haben. Bei den ersten Anzeichen einer anaphylaktischen Reaktion muss Epinephrin frühzeitig eingesetzt werden. Es wurde gezeigt, dass bei verzögertem Behandlungsbeginn die Komplikations- und Sterblichkeitsrate deutlich zunimmt. Wichtig ist es, die Kinder und deren Eltern ausreichend zu schulen (AGATE/Arbeitsgemeinschaft Anaphylaxie- Training und -Edukation e. V.).
Anders als bei Inhalationsallergien scheint eine Immuntherapie mit subkutanen Injektionen des Allergens bei der NMA aufgrund eines erhöhten Nebenwirkungsprofils (noch) nicht umsetzbar. Neue Immuntherapieformen (z. B. OIT – spezifische orale Immuntherapie, sublinguale [SLIT] oder epikutane [EPIT] Applikation) sind zurzeit in Testung, aber sie stehen derzeit für den Routineeinsatz nicht zur Verfügung. Rezente Studien zeigen zum Teil Erfolge, jedoch ist der Anteil an schweren Nebenwirkungen zu hoch (bis zu 50 %), um einen breiten Einsatz dieser Methode derzeit vertreten zu können.22, 23
Als neueste Therapiestrategie wurde kürzlich die frühzeitige Einführung von Erdnüssen ab dem ersten Lebensjahr zur Verhinderung der Entwicklung von Erdnussallergien diskutiert. Die Zielgruppe waren Kinder mit mittelschwerer bis schwerer Neurodermitis und/oder Eiallergie in Ländern mit einer sehr hohen Inzidenz. Die Ergebnisse dieser Studie sind überzeugend und weitere Studien sollen zeigen, für welche erweiterte Zielgruppe diese Maßnahmen zu empfehlen sein werden.24
1 Szepfalusi Z, Wien Med Wochenschr 2012; 162:525–32
2 Boyce JA et al., J Allergy Clin Immunol 2010; 126:S1–58
3 Nowak-Wegrzyn A et a., J Allergy Clin Immunol 2015; 135:1114–24
4 Rona RJ et al., J Allergy Clin Immunol 2007; 120:638–46
5 Burks AW et al., J Allergy Clin Immunol 2012; 129:906–20
6 Sackeyfio A et al., BMJ 2011; 342:d747
7 Urisu A et al., Allergol Int 2011; 60:221–36
8 Fiocchi A et al., J Allergy Clin Immunol 2010; 126:1119-28 e12.
9 Muraro A et al., Allergy 2014; 69:1026-45
10 Mehl A et al., Clin Exp Allergy 2012; 42:1266–72
11 Fiocchi A et al., Curr Opin Allergy Clin Immunol 2011; 11:200–3
12 Sanz ML et al., Curr Opin Allergy Clin Immunol 2011; 11:204–9
13 Nicolaou N et al., Curr Opin Allergy Clin Immunol 2011; 11:222–8
14 Ballmer-Weber BK et al., Curr Opin Allergy Clin Immunol 2011; 11:229–35
15 Worm M et al., Allergo J Int 2015; 24:256–93
16 Lange L, Lasota L, Finger A, et al., Allergy 2017; 72:598–603.
17 Kleine-Tebbe J et al., Allergo J 2009; 18:132–46
18 Niggemann B et al., Allergo J 2011; 20:149–60
19 Niggemann B., Allergy 2010; 65:2–6
20 Niggemann B et al., Allergy 2007; 62:729–32
21 Finkelman FD., Curr Opin Immunol 2010; 22:783–8
22 Beyer K, J Allergy Clin Immunol 2012; 129:1179–84
23 Groetch M et al., Pediatr Allergy Immunol 2013; 24:212–21
24 Du Toit G et al., N Engl J Med 2015; 372:803–13