20 Jahre photodynamische Therapie
Historische Entwicklungen
Die ersten Ansätze zur photodynamischen Therapie datieren bereits mehr als 100 Jahre zurück. Prof. Dr. Hermann von Tappeiner hat den Begriff photodynamische Reaktion in die Dermatologie eingeführt. Gemeinsam mit dem Dermatologen Albert Jesionek behandelte er Patienten mit Lupus vulgaris, Syphilis im Stadium II und oberflächlichen Hauttumoren mit topischen Farbstoffen als Photosensibilisator (z. B. Eosin-Lösung) in Kombination mit Licht. 1908 führte Walter Hausmann Experimente durch, in denen er die Effekte von Chlorophyllextrakten auf rote Blutzellen untersuchte und Mäuse mit systemisch verabreichtem Hämatoporphyrin-Derivat und Licht behandelte, was zur Entwicklung von Erythem und Ödem der Haut führte. Weitere Untersuchungen brachten Informationen zur erhöhten Aufnahme von Hämatoporphyrin-Derivaten in Tumoren, in denen nach der Bestrahlung mit Quarzlampenlicht die Nekrosen histologisch aufgearbeitet wurden.
Mehr als 60 Jahre später war es Thomas Dougherty, der 1978 die photodynamische Therapie mit systemisch verabreichtem Dihämatoporphyrin in Kombination mit einem Rotlichtlaser bei Patienten mit kutanen und subkutanen Tumoren anwandte. Systemische Photosensibilisatoren hatten allerdings den Nachteil, eine massive, über Wochen anhaltende Lichtempfindlichkeit hervorzurufen.
Ein Meilenstein für die dermatologische Anwendung war die Entwicklung der topischen PDT durch die Kanadier Kennedy und Pottier im Jahr 1990. Bei dieser Form der PDT wird Aminolävulinsäure (ALA), eine Vorläufersubstanz im Häm-Zyklus, äußerlich auf die erkrankten Hautareale aufgetragen. In der Regel erfolgt die Applikation okklusiv über einen Zeitraum von einigen Stunden. Während dieser Zeit wird ALA in der Haut zum eigentlichen Photosensibilisator, dem Protoporphyrin IX (PP IX), umgewandelt. Der genaue Mechanismus der selektiven Synthese und Akkumulation von PP IX in der tumorösen bzw. entzündlichen Haut ist immer noch ungeklärt. Studien an Tumorzelllinien haben gezeigt, dass die erhöhte Porphyrinsynthese von der Aktivität der Enzyme des Häm-Zyklus abhängt. Besonders zwei Enzyme, Ferrochelatase und Porphobilinogendeaminase, spielen dabei eine wichtige Rolle. Die PDT basiert auf der Interaktion zwischen einem Photosensibilisator – meistens handelt es sich um Porphyrine oder Porphyrinderivate – und Licht. Die bei der PDT verwendeten Photosensibilisatoren sind lichtaktivierbare Farbstoffe, die präferenziell im Tumor bzw. entzündlichen Gewebe akkumulieren und dort aufgrund ihrer spezifischen Absorptionseigenschaften durch bestimmte Wellenlängen des sichtbaren Lichts angeregt werden können. Bestrahlung von Tumorgewebe mit Licht adäquater Wellenlänge induziert eine photochemische Reaktion, die zur weitgehend selektiven Tumordestruktion führt. Bei der PDT von entzündlichen Hauterkrankungen, bei der wesentlich geringere Lichtdosen zur Anwendung kommen, steht nicht die Gewebedestruktion, sondern die immunmodulierende Wirkung der PDT im Vordergrund.
Indikationen der PDT
Die PDT hat sich in den letzten 20 Jahren in der Behandlung von nicht-melanozytären Tumoren der Haut etabliert. Der Einsatz der PDT bei entzündlichen Hauterkrankungen ist eine neuere Entwicklung, die allerdings noch durch randomisierte, placebokontrollierte Studien belegt werden muss.
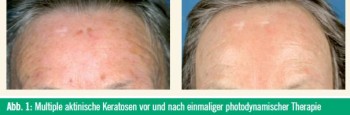
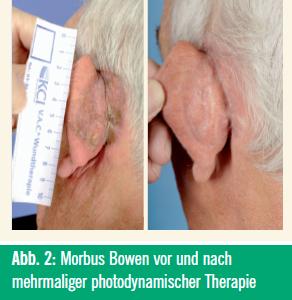
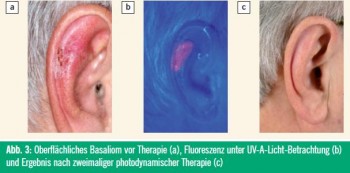
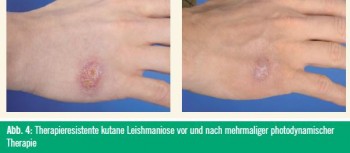
Über die dermatologischen Indikationen für die topische PDT wurde bereits ausführlich in einer früheren Ausgabe von „Spectrum Dermatologie“ (01/2010) berichtet. Die Abbildungen 1–4 zeigen Beispiele von erfolgreichen PDT-Behandlungen.
Zur erwähnen ist, dass die PDT auch zunehmend als eine Therapie der ersten Wahl bei immunsupprimierten Patienten anzusehen ist. Bei organtransplantierten Patienten ist das Risiko der Entwicklung eines Plattenepithelkarzinoms 65–250 Mal und eines Basalioms 10–16 Mal höher als bei nicht-transplantierten Patienten. In mehreren klinischen Studien wurde gezeigt, dass in dieser Patientengruppe PDT eine erfolgreiche Therapie bei multiplen, oberflächlichen Hauttumoren darstellt. Der Vorteil der PDT liegt darin, dass man durch die flächenhafte Behandlung auch einen präventiven Effekt erzielen und die Anzahl von neu entstehenden Läsionen reduzieren kann.
Neue Entwicklungen
Neue galenische ALA-Zubereitungen
Neue Entwicklungen haben sich auf dem Gebiet der galenischen Zubereitung der ALA-Formulierung sowie der Bestrahlungsquellen ergeben. Neben Levulan Kerastick® (20 % Aminolävulinsäure-Hydrochlorid, in Kombination mit Blaulicht für die Behandlung von aktinischen Keratosen (AK) am Capillitium und Gesicht in Amerika registriert), und Metvix® (16 % Methyl-Aminolävulinat für die Behandlung von AK, Morbus Bowen und Basaliomen in Europa zugelassen) wurde in der Zwischenzeit ein ALA-haltiges Pflas ter (Alacare®) für die Behandlung von aktinischen Keratosen im Gesicht und auf der Kopfhaut in Österreich und Deutschland zugelassen.
Bei Alacare® handelt es sich um ein 4 cm2 großes Pflaster, das 8 mg 5-ALA enthält. Man kann bei Patienten bis zu maximal 6 Alacare®-Pflaster für 4 Stunden in einer PDT-Sitzung applizieren. Die Abheilungsrate liegt bei 79 % und die Rezidivrate nach 12 Monaten Beobachtungszeit bei 11 %. Der Vorteil gegenüber anderen 5-ALA-Formulierungen liegt in der einfachen Handhabung und dem integrierten Lichtschutz. Es ist auch keine Vorbehandlung der Läsion vor der Pflasterapplikation erforderlich.
Ein weiteres Präparat, das kurz vor der Zulassung steht, ist BF-200 ALA von der Firma Biofrontera. Hierbei handelt es sich um eine Nanoemulsion von 10 % ALA in einer Gelmatrix, welche für die Behandlung von aktinischen Keratosen entwickelt wurde. Durch die Nanoemulsion wird ALA in Lösung gehalten und kann besser in die Haut penetrieren, weshalb trotz geringerer Konzentration des Wirkstoffes eine hohe therapeutische Wirksamkeit gegeben ist. Eine vor Kurzem publizierte Studie, in der BF-200 ALA mit Placebo und Metvix® verglichen wurde, zeigte 3 Monate nach Therapie signifikant höhere Abheilungsraten bei den mit BF-200 ALA behandelten AK. BF-200 ALA wurde auch bei Basaliomen, Condylomata acuminata und vulvären intraepithelialen Neoplasien angewandt und hat in den bisherigen Studien eine hohe Wirksamkeit und Sicherheit gezeigt, sodass man auf eine baldige Markteinführung hoffen kann.
Gerät zur PDT-Heimbehandlung
Kürzlich wurde ein neues Gerät (Ambulight PDT von der Firma Ambicare Health) auf den Markt gebracht, das eine PDT-Heimbehandlung ermöglicht. In Kombination mit einem Photosensibilisator kann man damit sehr bequem und schmerzarm (aufgrund der geringen Lichtintensität) oberflächliche Hauttumoren behandeln. Ambulight PDT erzeugt ein Licht mit der maximalen Wellenlänge von 640 nm und einer Strahlungsintensität von lediglich 7 mW/cm2. Die reine Bestrahlungsdauer beträgt 3 Stunden (entspricht einer Dosis von 75 J/cm2). Die (derzeitigen) Nachteile sind, dass man nur kleine Läsionen (bis 2 cm im Durchmesser) behandeln kann und das Gerät teuer und nur für eine Therapie verwendbar ist. An der Weiterentwicklung dieses Therapieprinzips (größere Behandlungsfelder, Möglichkeit multipler Behandlungen, geringere Kosten) wird gearbeitet.
Sonnenlicht als Lichtquelle
Einen originellen Ansatz wählte eine dänische Arbeitsgruppe, die Sonnenlicht als Lichtquelle benutzte. In einer randomisierten, intraindividuellen Vergleichsstudie wurde die PDT von AK am Capillitium oder im Gesicht entweder mit einer Leuchtdiode oder natürlichem Sonnenlicht durchgeführt. Die Auswertung ergab, dass beide Lichtquellen gleich wirksam, jedoch die Schmerzen bei Sonnenlichtbestrahlung signifikant geringer waren.
Offenes Problem: Schmerz
Das größte Problem bei der Durchführung der PDT sind nach wie vor die bisweilen extrem starken Schmerzen, die sich in Form von Brennen und Stechen während und oft auch einige Zeit nach der Bestrahlung manifestieren. Man unterscheidet dabei 2 Typen von Schmerzen: den neurogenen Schmerz am Anfang der Bestrahlung und den inflammatorischen Schmerz nach der PDT. Die genauen Mechanismen der Schmerzentstehung sind nicht geklärt.
Die gängigste Maßnahme zur Unterdrückung des PDT-induzierten Schmerzes ist die Kühlung des bestrahlten Hautareals durch Besprühen mit kaltem Wasser, durch einen Ventilator oder einen kalten Luftstrahl (CRIOjet™). Bei stärkeren Schmerzen können nicht-steroidale Antirheumatika systemisch verabreicht werden. Die präventive Anwendung von topischen Anästhetika, wie z. B. EMLA®, oder von Capsaicin zur Desensibilisierung von Nozizeptoren hat keinen Erfolg gezeigt. Es ist zu hoffen, dass sich durch die Weiterentwicklung von Photosensibilisatoren, Bestrahlungsprotokollen und/oder Bestrahlungsquellen die topische PDT in absehbarer Zukunft wesentlich schmerzarmer durchführen lässt.