Allergieprävention über eine Beeinflussung der Mikrobiota
Klinische Studien zur Allergieprävention mit Probiotika: Während der letzten Dekaden wurde ein sehr starker Anstieg der Prävalenz von Allergien festgestellt.1 Daher ist eine finnische Studie zur Allergieprävention mit einem Monospezies-Probiotikum (LGG), welche 2001 in „Lancet“ publiziert wurde2, mit großem Interesse diskutiert worden. Einschlusskriterium für diese Untersuchung (n = 159) war eine atopische Erkrankung in der unmittelbaren Familienanamnese, so genannte „high-risk babies“, der primäre Endpunkt war die Reduktion der Häufigkeit von atopischen Ekzemen bei Kindern im Alter von 2 Jahren unter Probiotikagabe. Durch die Gabe von 1 x 109 CFU/d (pränatal 2–4 Wochen und postnatal für 6 Monate) konnte nach 2 Jahren die Inzidenz der atopischen Dermatitis gegenüber der Placebogruppe um 50 % reduziert werden. Dieser große signifikante Unterschied war auch noch 4 Jahre später3 und in einer weiteren Auswertung nach 7 Jahren4 ohne weitere Probiotika-Gabe nachweisbar.
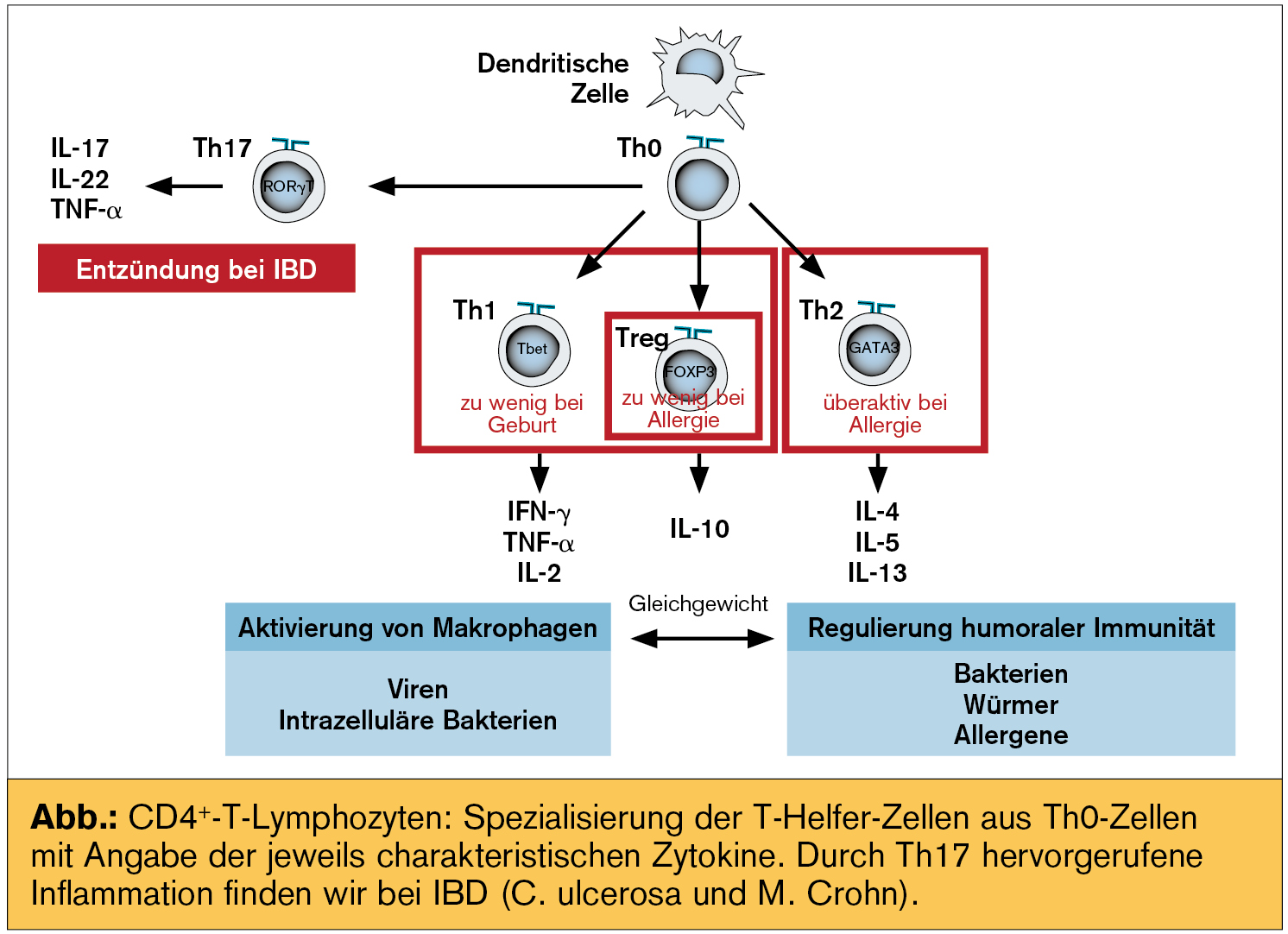
Auch Studien5 mit Probiotika zur Therapie allergischer Erkrankungen (wie atopischer Dermatitis) zeigten positive Ergebnisse (eingesetzt wurden B. lactis oder LGG). Andere randomisierte, kontrollierte Studien mit einzelnen Stämmen, die außerdem teilweise nur postnatal eingesetzt wurden, zeigten keine Effekte auf atopische Ekzeme (Taylor6: L. acidophilus; Kopp7: LGG; Wickens8: B. animalis subsp. lactis; Son9: B. longum und L. rhamnosus). Multispezies-Probiotika, die prä- und postnatal angewendet wurden, senkten die Inzidenz hingegen signifikant (Kukkonen10 mit n = 1.223; Niers11 mit n = 156; Kim12 mit n = 112). In die PandA-Studie (Probiotics and Allergy; randomisiert, doppelblind und placebokontrolliert) wurden knapp 160 „high-risk babies“ aufgenommen.11 Den Müttern wurde während der letzten 6 Schwangerschaftswochen und den Babys sofort nach der Geburt bis zur Vollendung des ersten Lebensjahres täglich 3 x 109 CFU eines Multispezies-Probiotikums aus B. bifidum W23, B. lactis W52 und Lc. lactis W58, eingebettet in eine hypoallergene Matrix, verabreicht (Omni-Biotic® Panda). Die Auswahl dieser Stämme13, 14 erfolgte am Department für Pädiatrie des Universitätsklinikums Utrecht (Niederlande) aufgrund ihrer spezifischen Eigenschaften zur Stimulation der Produktion des immunmodulierenden Zytokins IL-10 sowie ihrer Fähigkeit zur Unterdrückung der Bildung von Th2-Zytokinen (Abb.). Dies erfüllt alle Qualitätskriterien der WHO und WGO, es berücksichtigt das Multispezies-Konzept verstärkter bakterieller Synergien.15, 16 Da in dieser Studie nach der Vollendung des 1. Lebensjahres keine weitere probiotische Versorgung erfolgte, waren die Ergebnisse des 2-Jahres-Follow-up von großem Interesse: der Abstand zwischen der Placebogruppe und der Panda-Gruppe konnte weiterhin konstant gehalten werden.11, 17 Wesentlich für die positiven Ergebnisse war unter anderem, dass das Panda-Probiotikum den Schwangeren und den Neugeborenen bereits ab dem 1. Tag nach der Geburt verabreicht wurde.
Das „schwangere“ Immunsystem: Zellen des Immunsystems besitzen Rezeptoren für die Geschlechtshormone, daher wird dieses bei Frauen besonders im Menstruationszyklus durch den ständig wechselnden Hormonspiegel beeinflusst. Während der Menstruation ist die Th1-Antwort zur Infektabwehr günstiger für den Organismus, wobei der Abfall des Progesteronspiegels in der Lutealphase immunologisch mit einer Entzündungsreaktion vergleichbar ist.18 In der folgenden follikulären Phase wird die Immunantwort durch die steigenden Östrogenspiegel in eine Th2-Antwort moduliert, um nach dem Eisprung durch den Progesteronüberschuss wieder in eine Th1-Antwort umgekehrt zu werden. Während einer Schwangerschaft unterbleibt diese Umkehr. Die Implantation in der lutealen Phase wird durch die steigende Bildung von T-reg-Zellen (früher T-Suppressor-Zellen) begünstigt, da sie durch Östrogen gefördert wird. Der Einfluss der Sexualhormone bewirkt eine etwas höhere Immunkapazität bei Frauen. Mit der Pubertät wird die Thymusdegeneration induziert, da Leukozyten Rezeptoren für die Geschlechtshormone besitzen. Ab der Menopause nimmt die Immunkapazität stetig ab. Das Immunsystem wechselt ab dem 60. Lebensjahr wieder von einer Th1- zu einer Th2-dominierten Immunantwort – eine höhere Infektanfälligkeit im Alter ist die Folge.
Uterus, Plazenta und Fetus sind so genannte „immunprivilegierte“ Regionen des Körpers, wo keine Immunreaktionen im klassischen Sinn (Entzündung und Gewebsverletzungen) ablaufen dürfen, weil in diesen empfindlichen Geweben Zellverluste nicht kompensierbar sind. Da Immunreaktionen in diesen Organen das Gewebe nicht schädigen dürfen, sind sie von Barrieren (Blut-Gewebe-Schranken) umgeben. Der Fetus selbst (als „allogenes Transplantat“) wird durch die Plazentaschranke vor den mütterlichen Immunzellen abgeschirmt. Invasive Trophoblastzellen müssen aber ein Versorgungssystem aufbauen und dürfen nicht abgestoßen werden.19 Es bedarf also noch weiterer Mechanismen, damit das fremde Gewebe während der Schwangerschaft toleriert werden kann, wie z. B. Induktion von Toleranz durch dendritische Zellen und Immunsuppression durch T-reg-Zellen sowie Kontrolle durch die uterinen natürlichen Killerzellen (uNK), welche durch die Produktion von angiogenetischen Faktoren entscheidend zum Umbau uteriner Gefäße beitragen.20
Allergische Sensibilisierung und die „Allergiekarriere“: Um den Fetus vor einer Abstoßung zu schützen, ist während einer erfolgreichen Schwangerschaft die intrauterine Umgebung Th2-dominiert. Die Entwicklung einer allergischen Sensibilisierung ist daher nicht auf eine Th2-Verschiebung zurückzuführen, sondern auf die Unfähigkeit, auf Umweltreize richtig anzusprechen und den nötigen Wechsel zu einem Th1/Th2-Gleichgewicht zu vollziehen.21
Eine ungenügende Bildung von T-reg-Zellen führt zu allergischer Sensibilisierung. Bei hoch gefährdeten Neugeborenen kann die Entstehung allergischer Krankheiten durch Zunahme von T-reg-Zellen und IL-10 verhindert werden. T-reg-Zellen tragen zur Immunhomöostase bei, weil Th1- und Th2-Zellen über endokrine Stimulation nur ihre eigene Vermehrung fördern und über reziproke Blockade die Vermehrung und Differenzierung zu den jeweils anderen Th-Zellen verhindern. Beide Zellarten steuern über Zytokine das Immunsystem. Th1-Zellen induzieren hauptsächlich die Bildung von IL-2 und IFN-gamma – sie sind bei der Abwehr intrazellulärer Infektionen beteiligt. Hingegen induzieren Th2-Zellen vor allem IL-4, IL-5 und IL-13. Sie sind bei der Abwehr extrazellulärer Infektionen und atopischer Erkrankungen beteiligt. Asthma ist immunologisch durch ein Überwiegen der Th2-Zytokin-Antwort charakterisiert. Eine Allergie (dieser Begriff wurde durch den Wiener Clemens von Pirquet – einen Schüler von Theodor Escherich – eingeführt22) zeigt bei betroffenen Kindern in den klinischen Erscheinungsbildern oft einen chronologischen Verlauf, der auch als „Allergiekarriere“ bezeichnet wird: Nahrungsmittelallergien (Altersgipfel mit ca. 1,5 Jahren), gefolgt von atopischen Ekzemen (Verlagerung auf die Haut mit 1,5 Jahren) und in der Pubertät Manifestation von Asthma und allergischer Rhinitis (Verlagerung auf pulmonales Gewebe). Die Inzidenz atopischer Erkrankungen bei Schulkindern wird mit 20 bis 30 % angegeben.
Hygiene-Hypothese: Eine Erklärung für den starken Anstieg in den letzten Jahrzehnten versucht die Hygiene-Hypothese23, 24, 25: danach führen verbesserte Hygienebedingungen zu weniger Infektionen in der frühen Kindheit, was in einer verringerten Toleranz des Immunsystems gegenüber Allergenen und einer höheren Neigung zu Th2-vermittelten allergischen Erkrankungen resultiert. Basierend auf einer Unterforderung des Immunsystems wird die Reizschwelle für die Auslösung einer Immunantwort so weit abgesenkt, dass das Immunsystem auch gegen harmlose Antigene aktiviert wird. Eine Verminderung atopischer Erkrankungen wurde bei Kindern beobachtet, die ihr erstes Lebensjahr auf einem Bauernhof verbracht haben, wo ihr Immunsystem mit verschiedensten Krankheitserregern Kontakt hatte.
FACT-BOX
Bei der Frau wechselt die Immunitätslage im Laufe des Monatszyklus hormonabhängig von einer Th1- zu einer Th2-Dominanz, welche nach einer eingetretenen Schwangerschaft bis zur Geburt bestehen bleibt, damit es zu keiner Abstoßung des Fetus kommt. Im Darmlumen (= „Außenwelt“) des Neugeborenen wird über regulatorische T-Zellen (über IL-10) ein Wechsel zu einem Th1-/Th2-Gleichgewicht angestrebt. Bleiben diese Stimuli aus, können atopische Allergien die Folge sein. Dieser Shift des Immunsystems kann von einer anfänglichen Th2-Dominanz zu einer nötigen Th1-/Th2-Homöostase durch Zufuhr speziell ausgewählter Bakterien (prenatal an die Mutter und postnatal im ersten Lebensjahr an das Baby) induziert werden. Dies geschieht über eine vermehrte IL-10-Produktion und Hemmung von IL-4, IL-5 und IL-13. Durch placebokontrollierte Studien (z. B. die PandA-Studie) konnte gezeigt werden, dass diese Art einer Allergieprävention eine signifikante Risikoreduktion bewirken kann, deren Ausmaß auch nach Ende der Zufuhr probiotischer Keime persistiert.