Blutspenden verursacht Eisenmangel

Ein substanzieller Anteil der Bevölkerung in entwickelten Ländern spendet Blut (etwa 2–3 %), einerseits als Vollblut, das nach der Spende weiter prozessiert und in seine Einzelbestandteile zerlegt wird, andererseits mittels Apheresespenden, bei denen durch die bereits während der Spende erfolgende Auftrennung selektiv die gewünschte(n) Komponente(n), wie z. B. Plasma oder Thrombozyten gesammelt werden können, um den Erythrozytenverlust gering zu halten. In den letzten Jahrzehnten hat sich die Sicherheit von Blutprodukten für die Empfänger durch verpflichtend durchzuführende Qualitätsmaßnahmen, wie beispielsweise ausführliche Spenderfragebögen, serologische und DNA-Testung auf die wichtigsten relevanten Erreger, wesentlich verbessert. Umgekehrt wird bisher der Sicherheit für Spender nur wenig Beachtung geschenkt1, 2.
Eisenmangel: Eine der häufigsten Nebenwirkungen wiederholter Blutspenden ist der Eisenmangel, der v. a. Frauen und Mehrfachspender betrifft3, 4. Dies ist seit mindestens 1956 bekannt, und bereits damals wurde eine perorale Eisentherapie zwischen den Blutspenden gefordert5. Dennoch sind bisher – zumindest in Österreich – Diagnostik, Therapie und Aufklärung der Spender bezüglich eines allfälligen Eisenmangels meist nur rudimentär, da gesetzlich lediglich eine Hämoglobinkontrolle vorgesehen ist. Wie bei anderen pathologischen Laborwerten wird der Spender auch bei vorliegender Anämie angeschrieben und eine weitere Abklärung im hausärztlichen Bereich empfohlen. Erst in den letzten Jahren wurde der Eisenmangel als relevantes Problem wahrgenommen, das weiterer Forschung und v. a. Implementierung geeigneter Maßnahmen für Prävention und Therapie bedarf. Eisenmangel ist weltweit eine der häufigsten nutritiven Mangelerscheinungen. Bisher wurde regelmäßiges Blutspenden kaum als mögliche Ursache wahrgenommen oder erfragt.
Allgemeines: Bei einer Vollblutspende werden 450 ml Blut (±10 %) als Konserve plus bis zu 50 ml für die erforderlichen Tests entnommen. Dies entspricht einem Netto-Eisenverlust von 200–250 mg. Ältere Schätzungen gehen davon aus, dass durch den Verlust im Sammelsystem und durch die Abnahme von Proberöhrchen 10 Apheresespenden in etwa 1 Vollblutspende entsprechen6. Heutzutage kann diese Menge vermutlich je nach Entnahmetechnik (Maschine, Nachspülung, Probengewinnung aus Vollblut vs. Plasma) deutlich reduziert werden.
Spendenintervalle und Aufwandsentschädigung: In Österreich sind Plasmaspenden 50 mal/Jahr, Thrombozytenspenden 26 mal/Jahr und Vollblutspenden 4- (Frauen) bis 6-mal (Männer) pro Jahr zulässig. Eine gewisse Überlappung zwischen den verschiedenen Spenden (z. B. ein Plasmaspender, der zusätzlich gelegentlich Vollblut oder Thrombozyten spendet) ist zwar nicht unbedingt erwünscht, aber grundsätzlich möglich. Apheresespender erhalten in Österreich im Gegensatz zu Vollblutspendern aufgrund der höheren zeitlichen Belastung häufig eine Aufwandsentschädigung von etwa 20–25 Euro pro Spende.
Eisen – physiologische Funktionen und Speicher: Bei guten Eisenspeichern hat der Körper einen Gesamteisengehalt von 3.000–4.000 mg, wovon etwa 1.000 mg an Reserven in Leber, Milz und Knochenmark verfügbar sind. Prämenopausale Frauen haben durch Verluste während Menstruationsblutungen und Schwangerschaften bzw. Geburten neben häufig eisenarmer Ernährung oft nur einen Eisenspeicher vonweniger als 400 mg. Eisen hat nicht nur in der Hämoglobinbildung eine entscheidende Funktion, sondern ist u. a. Bestandteil vieler Schlüsselenzyme (inkl. DNA-Synthese). Ein Eisenmangel ist auch mit Fatigue, dem Restless-Legs-Syndrom, eingeschränkter kognitiver und physischer Leistungsfähigkeit sowie vermehrtem Haarausfall assoziiert. 2003 wurde in einer doppelblinden, placebokontrollierten Studie gezeigt, dass unerklärte Müdigkeit durch eine perorale Eisentherapie bei Frauen ohne Anämie mit einem Ferritinwert < 50 µg/l signifikant positiv beeinflusst werden konnte7. In der Schwangerschaft ist Eisen für die gesunde Entwicklung des Fötus essenziell. Die iatrogene Verursachung eines Eisenmangels ist daher bei prämenopausalen Frauen als besonders kritisch zu bewerten4.
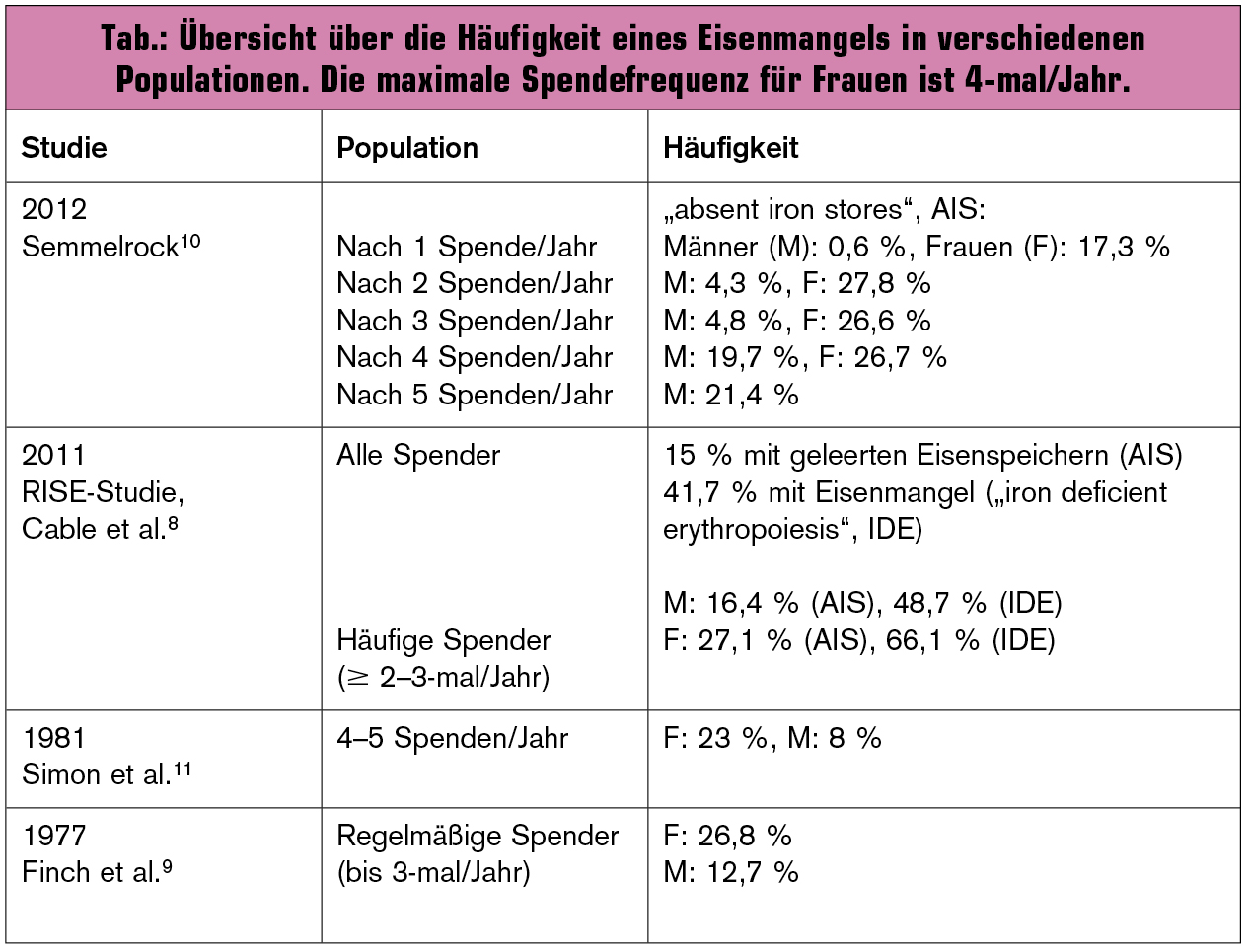
Prävalenz bei Vollblut- und Apheresespenden: Untersuchungen in verschiedenen Regionen haben gezeigt, dass ein Eisenmangel bei regelmäßigem Blutspenden häufig ist8–11 (Tab.). Risikofaktoren sind u. a. Spendehäufigkeit, niedrigeres Körpergewicht und weibliches Geschlecht. Auch das Restless-Legs-Syndrom wurde bei bis zu einem Viertel aller Blutspender beschrieben12.
Interventionsstudien: Theoretisch könnte der mit einer Vollblutspende verursachte Eisenverlust von ca. 200 mg mit einer 20-tägigen oralen Eisentherapie von 100 mg täglich kompensiert werden (d. h. total 2.000 mg, Resorption meist um 10 %, entsprechend 200 mg). Orale Eisenpräparate sind jedoch insbesondere gastrointestinal häufig nicht gut verträglich, was zu einer eingeschränkten Einnahme-Compliance führen kann. Einige Eiseninterventionsstudien bei Blutspendern mit peroralem und/oder intravenösem Eisen wurden bisher publiziert, diese zeigten im Allgemeinen eine gute Einnahme-Compliance und eine hohe Effizienz bezüglich der Verbesserung des Eisenstatus13–20. Sowohl die perorale als auch die intravenöse Eisengabe ist effizient und sicher, wobei jedoch zu erwarten ist, dass die beschriebene hohe Einnahme-Compliance in diesen Studien nicht auf Routinesituationen übertragbar ist. Eine weitere große Studie (n = 400), erstmalig mit hochdosiertem intravenösem Eisen (800 mg Eisencarboxymaltose), wird derzeit in der Schweiz durchgeführt und soll 2013 abgeschlossen werden (Clinical Trials Protokoll NCT01519830).
Derzeit wird in der transfusionsmedizinischen Routine üblicherweise keine Eisensubstitution angeboten. Bedenken bestehen bezüglich der möglichen Aggravierung einer unbekannten Hämochromatose und der Verschleierung anderer, v. a. gastrointestinaler Blutverluste. Alternativ ist eine Einschränkung der Spendehäufigkeit möglich4, 19, wobei bereits 1–2 kurz aufeinander folgende Vollblutspenden einen niedrigen Eisenspeicher entleeren können. Des Weiteren ist dies aufgrund des hohen Bedarfs der modernen Medizin an Blutprodukten und der immer strengeren Kriterien für Blutspenden im Sinne der Produktsicherheit sicherlich keine ideale Lösung.
Hämochromatose: Bei der Hämochromatose handelt es sich um eine genetisch bedingte Eisenspeichererkrankung, die mit einer Genfrequenz von ca. 10 % die häufigste Erbkrankheit bei erwachsenen Kaukasiern ist. Aus medizinischer Sicht gibt es keinen Anlass, das Blut von Hämochromatosepatienten zu verwerfen21. In Österreich ist daher seit Juni 2008 die Blutspende bei bekannter Hämochromatose ohne Organschäden möglich.
Zusammenfassung: Ein Eisenmangel ist ein seit Langem bekanntes, jedoch erst kürzlich in seiner vollen Dimension erkanntes Problem bei Blutspendern. In den letzten Jahren wurden einige vielversprechende Interventionsstudien mit peroralem bzw. intravenösem Eisen publiziert. Insbesondere hochdosierte intravenöse Eisenpräparate scheinen in dieser Situation ideal zu sein. Der wesentlichste Nachteil dieser Therapie sind die derzeit noch recht hohen Kosten. Sowohl im Sinne ethischer Grundsätze als auch der Erhaltung eines gesunden Spenderpools zur Deckung des enormen Bedarfs an Blutprodukten ist die weitere Thematisierung und Optimierung der Therapie des Eisenmangels als häufigste Nebenwirkung regelmäßiger Blutspenden unbedingt nötig. Patienten mit Hämochromatose ohne Organmanifestationen dürfen und sollen regelmäßig Blut spenden.
cy in whole blood donors. Transfusion 2011 Mar; 51(3):458–61