Chronisch-myeloische Leukämie – Heilung ante portas?
Erfolgsgeschichte Tyrosinkinase-Inhibitoren
In der IRIS-Studie wurde Imatinib 400 mg/d prospektiv-randomisiert mit dem damaligen Standard Interferon alpha (5 Mio./m2/d) + Cytarabin (AraC; 20 mg/m2/d, 10 d/Monat) bei 1.106 Patienten verglichen. Das 8-Jahres-Update dieser Studie zeigt ein kumulatives komplettes zytogenetisches Ansprechen (CCyR) von 83 %, ein krankheitsfreies Überleben von 81 % und ein Gesamtüberleben von 85 %. Als relevantester Parameter bezüglich des Langzeitüberlebens stellte sich das Erreichen einer CCyR innerhalb von 12 Monaten nach Therapiebeginn heraus. Nach den Kriterien des European Leukemia Net (ELN) und des National Comprehensive Cancer Network (NCCN) werden Patienten dann als Nichtansprecher eingestuft, wenn sie nicht innerhalb von 3 Monaten eine komplette hämatologische Remission oder ein zytogenetisches Ansprechen innerhalb von 6 Monaten erreichen. Wurde nicht innerhalb von 18 Monaten eine „major molecular remission“ (MMR = 0,1 % bcr-abl) erzielt, bestand ein suboptimales Ansprechen mit höherer Imatinib-Resistenz. Bei solchen Patienten wird die Umstellung auf einen anderen TKI empfohlen. TKIs der 2. Generation (Nilotinib, Dasatinib) wurden prospektiv-randomisiert als Erstlinientherapie klinisch geprüft und zugelassen.
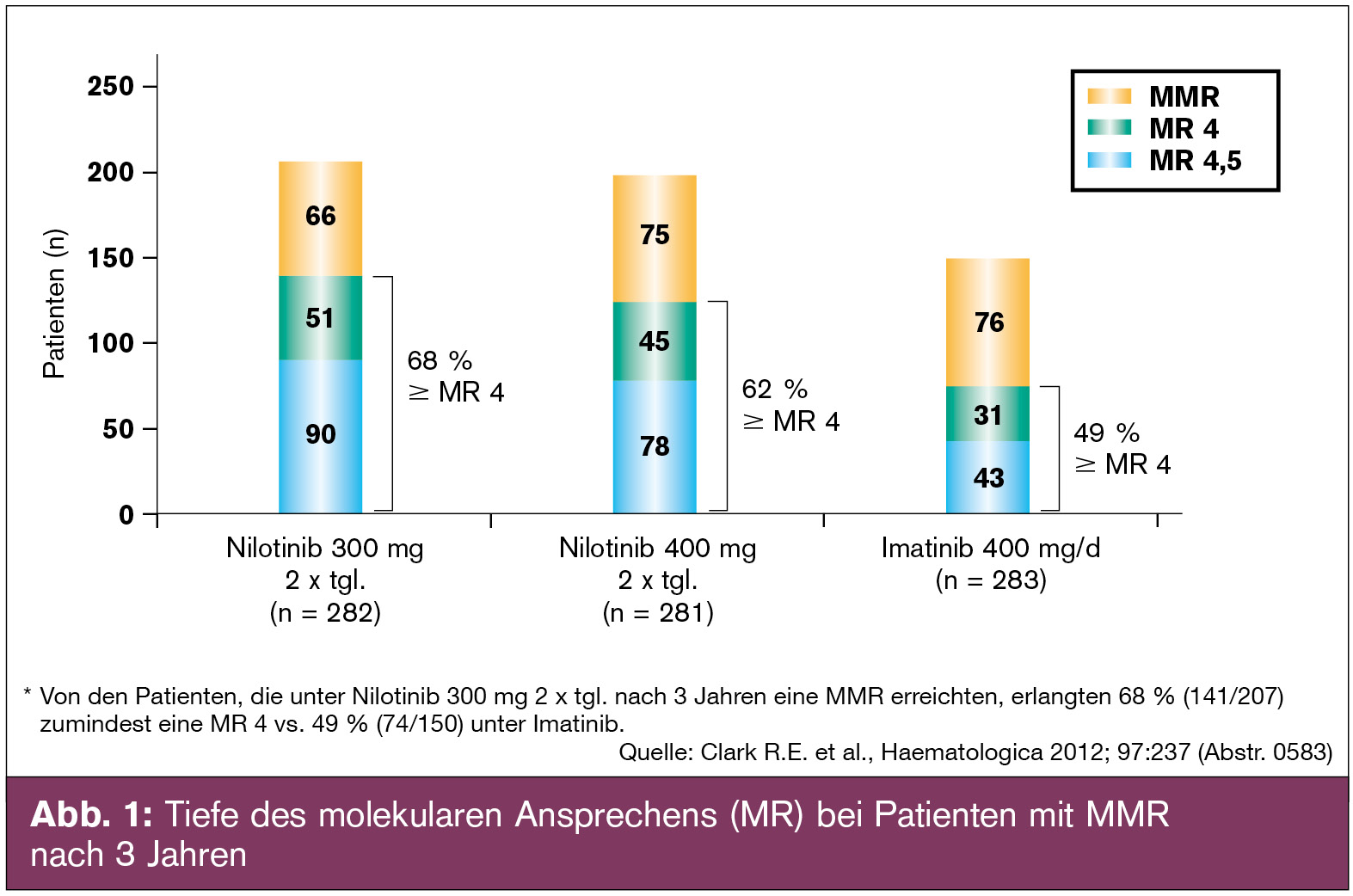
ENESTnd-Studie: 840 unbehandelte CML -CP-Patienten wurden randomisiert: Nilotinib 2 x 300 mg/d versus Nilotinib 2 x 400 mg/d versus Imatinib 400 mg/d.
Konsistent mit den Resultaten nach 1 und 2 Jahren lagen auch nach 3 Jahren die MMR-Raten unter Nilotinib (73 %, 70 %) signifikant höher als mit Imatinib (53 %, p < 0,0001).
Auch die Rate von MR 4 lag nach 3 Jahren mit Nilotinib signifikant (je nach Dosierung 40 % bzw. 44 %) höher im Vergleich mit Imatinib (26 % p < 0,001). Die tiefste molekulare Remission MR 4,5 lag nach 3 Jahren (32 %, 28 %) signifikant höher als mit Imatinib (15 %, p < 0,0003) (Abb. 1). Der Unterschied bei den tiefen molekularen Ansprecharten (MR 4, MR 4,5) stieg hier von 10 % nach einem Jahr auf 17 % nach 3 Jahren. Patienten unter Nilotinib hatten eine signifikant geringere Wahrscheinlichkeit einer Progression in eine akzelerierte Phase oder Blastenkrise im Vergleich zu Imatinib (HR = 0,16, p = 0,0059).
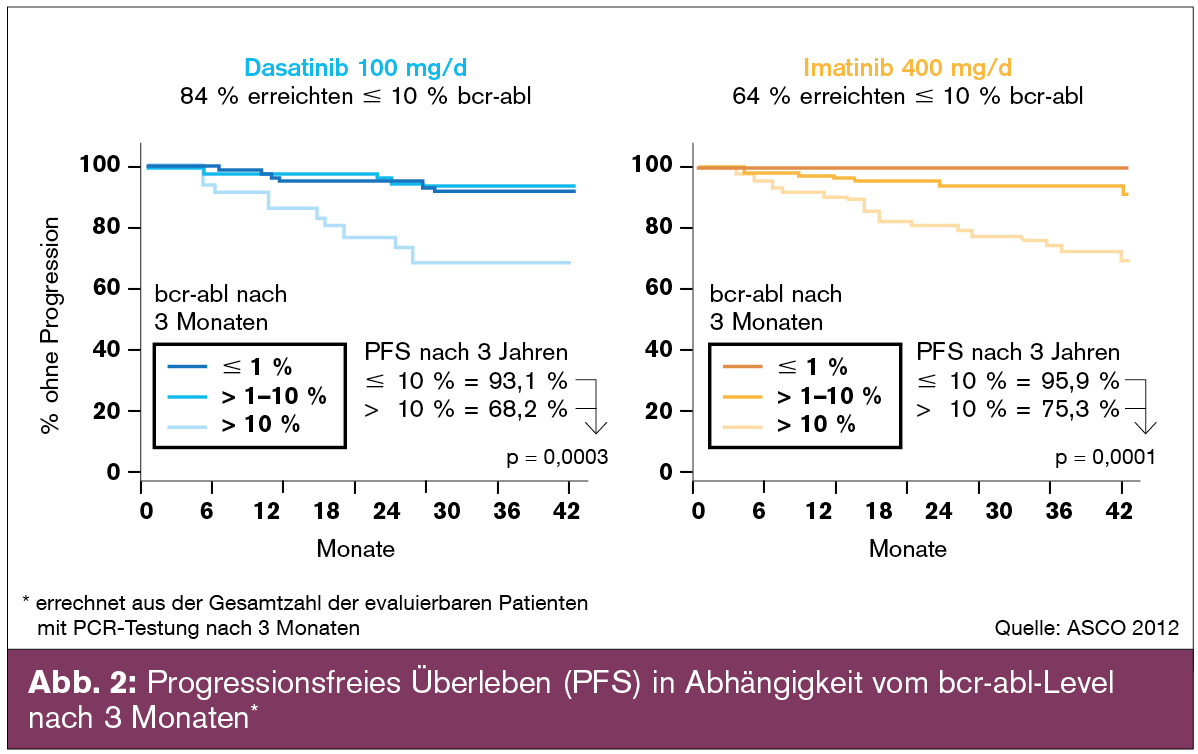
DASISION-Studie: 516 unbehandelte CML-CP Patienten wurden randomisiert: Dasatinib 100 mg/d versus Imatinib 400 mg/d.
Im 3-Jahres-Follow-up wiesen die Dasatinib-Patienten innerhalb von 3 Monaten ein tieferes molekulares Ansprechen (unter 10 % bcr-abl) auf als jene mit Imatinib (84 % versus 64 %). In beiden Armen wiesen Patienten mit einem stärkeren molekularbiologischen Ansprechen nach 3 Monaten (bcr-abl unter 10 %) eine signifikant höhere Wahrscheinlichkeit für ein krankheitsfreies und Gesamtüberleben nach 3 Jahren auf (Abb. 2).
Weiters wurde bei PatientInnen mit besserem molekularbiologischen Ansprechen eine geringere Transformationsrate in die akzelerierte Phase (AP) bzw. Blastenkrise (BC) beobachtet.
Kontrolliertes Absetzen der Therapie
Die Tatsache, dass bei Patienten jahrelang ein bcr-abl-Transkript nicht mehr nachgewiesen werden konnte (MR 4,5), führte zu Studien, bei denen kontrolliert die Therapie abgesetzt wurde. Bei 100 PatientInnen mit CML, die 3 Jahre Imatinib erhalten hatten und durch 2 Jahre MR 4,5 aufwiesen, wurde das Medikament abgesetzt. Nach 30 Monaten Follow-up zeigte sich folgendes Bild: 61 % Relaps (davon 58 innerhalb der ersten 7 Monate), 39 % MR 4,5 nach 24 bzw. 36 Monaten. PatentInnen mit niedrigem Sokal-Score (prognostischer Outcome-Score) wiesen ein signifikant besseres Andauern (70 %) der MR 4,5 auf als solche mit intermediärem oder hohem Risiko. Alle Patienten sprachen auf eine neuerliche Imatinib-Therapie wieder an. Es scheint so zu sein, dass ein Verlust einer MMR jedenfalls eine Indikation für einen Wiederbeginn einer Therapie darstellt, ein Verlust einer MR 4,5 dieses aber nicht unbedingt erfordert.
Weitere Studien für personalisiertes Procedere
In Zukunft wird in einer Reihe von Studien (CML V, ENEST op, ENEST cmr, EUROPe Stop TKI) versucht werden zu zeigen, dass nach einer erfolgreichen Dauertherapie der TKI abgesetzt werden kann, weil nach einer funktionellen Heilung eine weitere Therapie nicht mehr notwendig ist. Im Sinne einer personalisierten Medizin brauchen dann genau definierte Patienten keine weitere Therapie mehr, da sie als geheilt gelten können, was noch zu beweisen ist.