Lymphome – Neue Therapieansätze in der Hämatologie

In den letzten Jahren haben Grundlagenerkenntnisse in der molekularen Pathogenese zu der Entwicklung von so genannten zielgerichteten Therapien („targeted therapies“) geführt, die das therapeutische Repertoire in der Lymphombehandlung wesentlich bereicherten. Insbesondere der Einsatz neuer zielgerichteter Antikörper hat ohne wesentliche Toxizitätssteigerung die Prognose vieler Lymphomentitäten substanziell verbessert.
Akute lymphatische Leukämie (ALL)
Durch Intensivierung und Optimierung der Chemotherapie, den risikoadaptierten Einsatz der allogenen Stammzelltransplantation und verbesserter Supportivmaßnahmen konnte die Behandlung der akuten lymphatischen Leukämie (ALL) in den letzten Jahren deutlich verbessert werden. Individualisierte Therapiestrategien, aufbauend auf prognostischen Faktoren wie Zytogenetik oder minimale residuelle Resterkrankung (MRD), haben ebenso zur Prognoseverbesserung beigetragen.
Antikörpertherapie: Alle ALL-Blasten exprimieren linienspezifische Antigene auf ihrer Zelloberfläche, wie z. B. CD19, CD20, CD22 oder CD33, die als potenzielles Ziel für eine Antikörpertherapie definiert werden können. Die größte Erfahrung liegt sicherlich für den Anti-CD20-Antikörper (Ak) Rituximab (Mabthera®) vor, der bereits routinemäßig mit Chemotherapie kombiniert bei B-zelliger ALL zum Einsatz gelangt. Ein weiteres attraktives Epitop ist CD 19, da es bei allen B-Vorläufer-ALL-Patienten exprimiert wird.
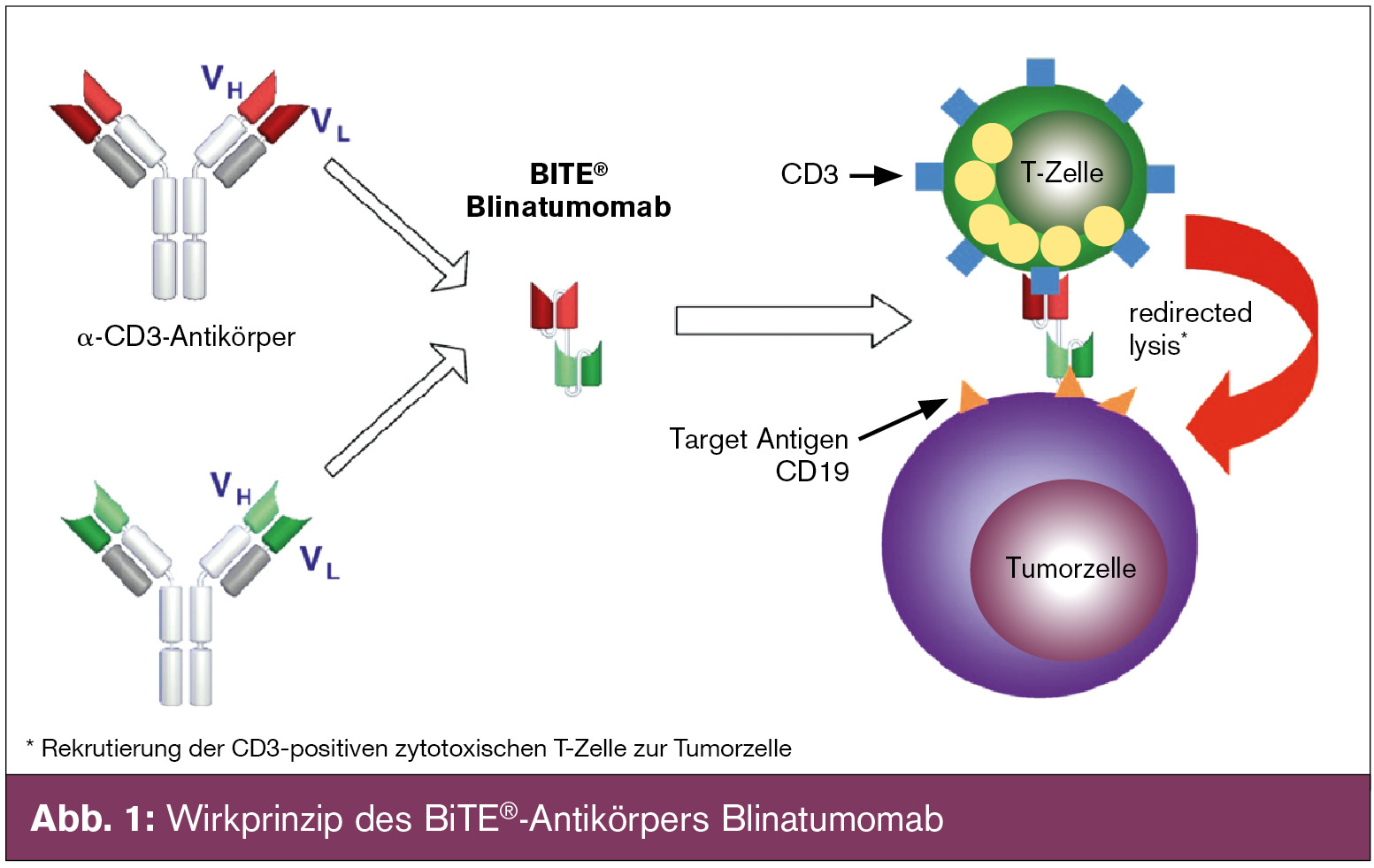
Neu: BiTE®-Antikörper: Blinatumumab ist ein neuartiger bi-spezifischer Antikörper, der 2 Bindungsarme besitzt, die durch eine kurze Peptidbrücke verbunden sind. Dieser bindet einerseits das CD19-(Tumor-)Antigen, andererseits das CD3-Antigen, rekrutiert somit CD3-positive zytotoxische T-Zellen zur Tumorzelle und induziert eine Ak-mediierte Tumorzelllyse (Abb. 1). Solche Antiköper werden BiTE®-Antikörper („bi-specific T-cell engaging antibodies“) genannt. Die ersten Ergebnisse mit diesen BiTE®-Antikörpern wurden bei Patienten mit fortgeschrittenen, relapsierten B-zelligen Non-Hodgkin-Lymphomen gesammelt, bei denen im Rahmen einer Phase-I-Dosisfindungsstudie 62 Patienten mit unterschiedlichen Lymphomentitäten behandelt wurden und eine Gesamtansprechrate von 82 % mit akzeptablem Nebenwirkungsprofil erreicht werden konnte. Im Anschluss wurden 20 MRD-positive ALL-Patienten (nach Chemotherapie bzw. Rezidiv) behandelt, von denen 16 Patienten anhaltend MRD-negativ wurden, darunter auch Patienten mit zytogenetischem Hochrisikoprofil (wie z. B. bcr-abl- oder t(4;11)-positive ALL-Patienten). Im nächsten Schritt wurde die Wirksamkeit von Blinatumomab bei rezidivierenden bzw. refraktären Patienten mit ALL untersucht. Von 25 auswertbaren Patienten erreichten 17 (= 68 %) eine komplette Remission mit einem MRD-negativen Status innerhalb der ersten 2 Zyklen. Nach einer medianen Nachbeobachtungszeit von 10 Monaten relapsierten bislang 6 Patienten. Das Nebenwirkungsprofil war mild und in den meisten Fällen voll reversibel. Insgesamt handelt es sich bei Blinatumomab um einen hochpotenten Antikörper mit neuem Wirkmodus, dessen hohe Effektivität auf einen engen Kontakt zwischen Effektor- und Targetzelle beruht. Eine globale Zulassungsstudie ist im Gange.
Follikuläres Lymphom
Das follikuläre Lymphom (FL) ist mit einer Inzidenz von 22 % die zweithäufigste Lymphomentität und ist der klassische Repräsentant der indolenten Lymphome. In den letzten Jahren konnten beträchtliche Fortschritte in der Therapie des FL erreicht werden.
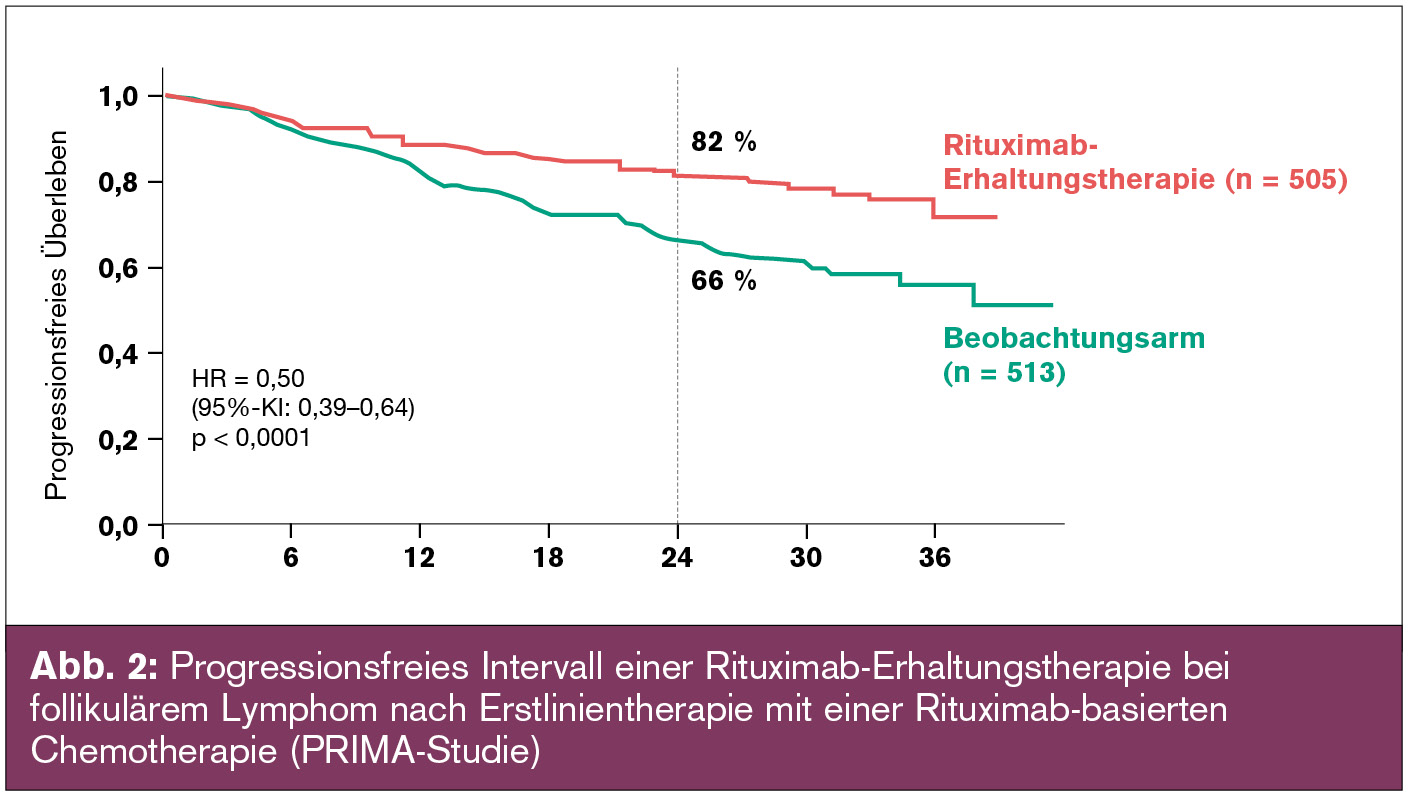
Rituximab bereits etabliert: Dieser Fortschritt beruht zum großen Teil auf der Einführung des Anti-CD20-Antikörpers Rituximab, von dem in mehreren randomisierten Studien gezeigt werden konnte, dass er in Kombination mit Chemotherapie das Gesamtüberleben signifikant verlängert. Daher ist die Rituximab-basierte Chemoimmunotherapie derzeit die etablierte First-Line-Therapie des FL. 3 bis 5 Jahre nach der Erstlinientherapie kommt es gewöhnlich zur Erkrankungsprogression des FL. Der Stellenwert einer Erhaltungstherapie mit Rituximab bei FL nach Erstlinientherapie wurde in der so genannten PRIMA-Studie evaluiert. In dieser Studie wurden 1.019 Patienten, die ein Ansprechen auf unterschiedliche Chemoimmunotherapien zeigten, in eine Gruppe mit Rituximab-Erhaltungstherapie oder in einen Beobachtungsarm randomisiert. Die Erhaltungstherapie bestand aus Rituximab 375 mg/m2 in 2-monatigen Abständen über 2 Jahre. Die Erhaltungstherapie wurde sehr gut toleriert, infektiöse Komplikationen waren häufiger im Erhaltungsarm, waren jedoch insgesamt milde und transient. Die Rituximab-Erhaltungstherapie verbesserte die Qualität des Ansprechens und verlängerte das progressionsfreie und ereignisfreie Überleben (Abb. 2). Das Gesamtüberleben war unbeeinflusst, was durch ein zu kurzes Follow-up bzw. effektive „Salvage“-Therapien erklärt werden kann. Nichtsdestotrotz kann die Rituximab-Erhaltungstherapie als „standard of care“ definiert werden da die Qualität des Ansprechens auf eine Erstlinientherapie prognostischen Wert besitzt und mit einem längeren Gesamtüberleben korreliert.
Bendamustin: Eine weitere neue Wirksubstanz ist Bendamustin, ein Hybridderivat mit Alkylans- und Purinanalogon-ähnlichen Eigenschaften, das sich durch seine hohe Effektivität gepaart mit guter Verträglichkeit auszeichnet und in Österreich bereits zur Erstlinienbehandlung der chronisch-lymphatischen Leukämie zugelassen ist. Die Kombination aus Bendamustin und Rituximab (B-R) wurde in einer multizentrischen randomisierten Phase-III-Studie der deutschen Studiengruppe für indolente Lymphome mit der Standardtherapie R-CHOP verglichen und die ersten Langzeitergebnisse von 514 Patienten mit unbehandelten indolenten oder Mantelzell-Lymphomen ausgewertet. Die größte Gruppe waren die follikulären Lymphome mit 54 %, aber auch Marginalzonen- bzw. Mantelzelllymphome oder Patienten mit Morbus Waldenström wurden in diese Studie inkludiert. Im Langzeit-Follow-up von mittlerweile 45 Monaten betrug das mediane progressionsfreie Überleben (PFS) im B-R-Arm 69,5 Monate versus nur 31,2 Monate im CHOP-R-Arm. Während das Gesamtansprechen unter beiden Schemata vergleichbar war (B-R: 92,7 %, R-CHOP: 91,3 %), war die Rate an kompletten Remissionen unter B-R signifikant höher (39,8 % vs. 30,0 %). Der signifikante Effektivitätsvorteil zeigte sich auch in allen histologischen Subgruppen außer beim Marginalzonenlymphom und war unabhängig vom Alter der Patienten oder vom Risikoprofil (i. e. Follikular Lymphoma International Prognostic Index FLIPI: 0–2, entsprechend einer günstigen Risikokonstellation, oder FLIPI 3-5, entspricht einer ungünstigen Risikokonstellation). Die Kombination aus Bendamustin und Rituximab ist zusätzlich wesentlich besser verträglich ohne signifikante Alopezie und mit geringerer Hämatotoxizität, weniger Infektionen und einer geringeren Neuropathierate assoziiert. Diese vielversprechenden Ergebnisse führten dazu, dass viele Hämato-Onkologen Bendamustin plus Rituximab als den neuen Standard zur First-Line-Therapie für Patienten mit indolenten Lymphomen und Mantelzell-Lymphomen ansehen.
Diffus-großzelliges B-Zell-Lymphom
Das diffus-großzellige B-Zell-Lymphom (DLBCL) ist mit etwa 35 % der häufigste Lymphomsubtyp und der wichtigste Vertreter der aggressiven Lymphome. Das verbesserte Verständnis der molekularen Grundlagen mittels Genexpressionsanalysen führte zur Charakterisierung verschiedener Subtypen, die auch trotz Chemoimmunotherapie (i. e. R-CHOP) unterschiedliche Prognosen aufweisen: der mit einer günstigen Prognose behaftete Keimzentrumssubtyp (GCB-Typ, von „germinal center b-cell-like“) sowie der eher refraktäre Non-GCB-Subtyp. Der letztere ist durch eine konstitutive Aktivierung des NF-B-Signaltransduktionswegs gekennzeichnet, der die Lymphomzelle immortalisiert und der somit für den refraktären Verlauf verantwortlich ist.
Bortezomib ist ein Proteasominhibitor, der NF-κB inhibiert und damit diesen Kreislauf durchbricht. Die Zugabe von Bortezomib zur Standardtherapie R-CHOP bei Patienten mit unbehandelten DLBCL führte zu einer Gesamtansprechrate von 100 % mir einer Rate kompletter Remissionen von 86 %. Bemerkenswert ist, dass die Zugabe von Bortezomib zu R-CHOP zu einer Effizienzsteigerung führte, die die Prognose der Patienten mit dem Non-GCB-Subtyp an die der guten Prognosegruppe des GCB-Subtyps annäherte, sodass beide Gruppen ein identes progressionsfreies Überleben aufwiesen. Diese Studie zeigt, dass die Aufklärung der molekularen Pathogenese zur Identifizierung neuer therapeutischer Targets führt und eine rational designte Antilymphomtherapie ermöglicht, die auf molekular definierten Patientensubgruppen aufbaut. In Zukunft wird es somit in zunehmendem Maße möglich, eine individualisierte, „maßgeschneiderte“ Therapie mit hoher Effizienz und geringem Nebenwirkungsprofil anzubieten.