Das geht auf Herz und Nieren – eine gefährliche Achse
Bei Hypertonus*
Die arterielle Hypertonie ist eine der häufigsten Erkrankungen weltweit, dennoch wird ihr sowie dem Erreichen der Zielwerte nach wie vor zu wenig Aufmerksamkeit geschenkt. So erreichten in einem 2015 durchgeführten Apothekenmessprojekt Patienten mit einer antihypertensiven Verordnung nur zu 41 % den Zielbereich.1 In einer weiteren Untersuchung wiesen 29,5 % der Personen ohne bekannten Bluthochdruck und 57,3 % der Patienten mit bekanntem Hypertonus erhöhte Blutdruckwerte auf.2 Im Rahmen des weltweiten Projektes „Messmonat Mai 2017“ wurde Menschen an öffentlichen Plätzen und in Apotheken der Blutdruck gemessen.3 Hierbei stellte Österreich mit unzureichenden Zielwerten (140/90 mmHg) bei 43,2 % der unbehandelten und 63,5 % der behandelten Messprobanden einen traurigen Rekord im Ländervergleich auf. In diesem Zusammenhang soll zum Nachdenken anregen, dass die arterielle Hypertonie weiterhin die Hauptursache für kardiovaskuläre Erkrankungen, Behinderung und frühzeitige Sterblichkeit bleibt; und 14 % der Todesfälle weltweit können auf Bluthochdruck zurückgeführt werden.4
Österreichischer Blutdruckkonsensus
Um erneut auf die Wichtigkeit der frühzeitigen Diagnostik und adäquaten Therapie des Bluthochdrucks hinzuweisen, wurde im letzten Jahr der „Österreichische Blutdruckkonsensus“ veröffentlicht, in den die Expertise der unterschiedlichsten Fachgesellschaften miteinbezogen wurde.5 Neu darin ist die Empfehlung zur automatisierten bzw. automatisierten unbeobachteten Blutdruckmessung in einem separaten Raum, wie sie im SPRINT Trial6 verwendet wurde, um eine sichere Diagnose zu stellen. Daneben bleibt natürlich die Möglichkeit der Selbstblutdruckmessung und der Langzeitblutdruckmessung, die weiterhin den Goldstandard darstellen.
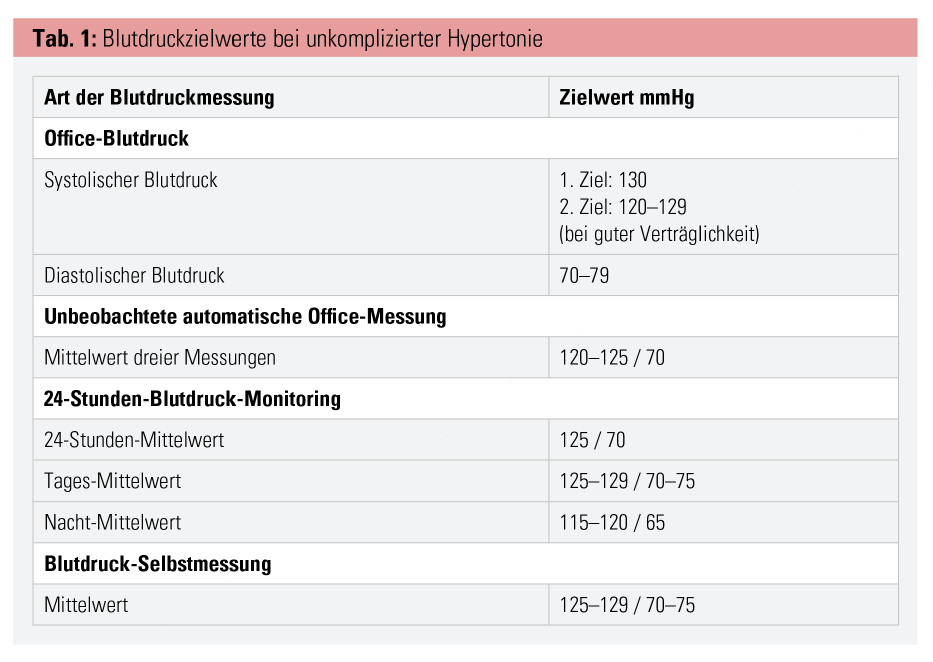
In der Entscheidung der Grenzwertfrage zur Diagnosestellung schloss man sich der European Society of Hypertension (ESH) mit 140/90 mmHg an7 (entgegen den US-amerikanischen Richtlinien, die 130/80 mmHg als Grenzwert führen8). Zu achten ist dabei sowohl auf den systolischen als auch auf den diastolischen Wert. In Bezug auf die Prädiktion einer KHK ist bis zum 50. Lebensjahr der diastolische Blutdruck der bessere Prädiktor; zwischen dem 50. und 59. Lebensjahr sind systolischer und diastolischer Blutdruck gleich aussagekräftig; ab 60 ist der diastolische Blutdruck invers mit dem KHK-Risiko assoziiert, sodass der Pulsdruck als KHK-Prädiktor herangezogen werden sollte.9
Dafür wurden die Zielwerte für unkomplizierte Hypertonie deutlich strenger definiert (Tab. 1): Als primäres Ziel gilt die Senkung des systolischen Blutdrucks unter 130 mmHg, bei guter Verträglichkeit bis 120 mmHg; der diastolische Blutdruck soll stets unter 80 mmHg liegen.
Nach Hypertonie-vermittelten Organschäden soll aktiv früh gescreent werden, um so größere Schäden zu vermeiden. Die Liste asymptomatischer Hypertonie-vermittelter Endorganschäden findet sich in Tabelle 2.
Bei chronischer Niereninsuffizienz haben ca. 80–85 % aller Betroffenen eine Hypertonie.10 Die zweithäufigste Ursache eines dialysepflichtigen Nierenversagens ist die hypertensive (vaskuläre) Nephropathie; zur Nephroprotektion und verlangsamten Progression wird eine intensivierte Blutdrucksenkung empfohlen.11
In der Blutdrucktherapie setzt man neben den klassischen Lifestyle-Empfehlungen früh auf eine Kombinationstherapie aus ACE/ARB + Diuretikum/CCB. Sollte dies nicht ausreichend wirksam sein, würde im nächsten Schritt eine 3-fach-Kombination aus den oben gewählten Substanzen zum Tragen kommen, dann die zusätzliche Verabreichung von Spironolacton. Ab diesem Stadium sollte die Zuweisung in ein Hypertoniezentrum zur möglichen weiteren Abklärung bzw. zum Ausloten möglicher invasiver Maßnahmen erfolgen. Die Monotherapie wird nur bei systolischen Blutdruckwerten unter 150 mmHg, niedrigem kardiovaskulärem Risiko bzw. Frailty empfohlen. Betablocker sollen nur bei kardialer Indikation (KHK, Angina pectoris, Vorhofflimmern, St. p. Myokardinfarkt, Herzinsuffizienz) frühzeitig als Therapiestandard etabliert werden.5
Von einer „resistenten Hypertonie“ spricht man bei Ordinationsblutdruckwerten > 140/90 mmHg unter 3-fach-antihypertensiver Therapie inklusive Diuretikum und optimierter Dosierung. In diesem Fall sollte man eine fehlende Adhärenz des Patienten ausschließen, diese besteht zu rund 50 % nach einem Jahr. Dies ist eines der Hauptargumente, warum die Single-Pill-Kombinationen in den aktuellen Guidelines forciert werden. Häufig spielt aber auch die therapeutische Inertia eine Rolle. Sind diese Ursachen ausgeschlossen, muss in Richtung einer sekundären Hypertonie mit den üblichen Abklärungsschritten gefahndet werden.
Entscheidend für die Reduktion von Endorganschäden ist neben der rechtzeitigen Diagnosestellung auch die regelmäßige Kontrolle des Therapieziels.
Resümee
Die arterielle Hypertonie ist weiterhin unzureichend diagnostiziert und therapiert. Ein regelmäßiges Screening auf Bluthochdruck und Endorganschäden kann kardiovaskuläre Ereignisse verhindern. Die medikamentöse Kombinationstherapie als „Single Pill“ wird als Firstline-Therapie empfohlen; Monotherapien sind nur noch bei Blutdruckwerten unter 150 mmHg oder Frailty anzustreben.
Bei koronarer Herzkrankheit**
Epidemiologie, Prävalenz und Pathogenese
Bei Patienten mit chronischer Niereninsuffizienz (CKD) treffen häufig klassische kardiovaskuläre Risikofaktoren wie arterieller Hypertonus, Diabetes mellitus und Hyperlipidämie mit weiteren, für eine koronare Herzerkrankung (KHK) prädisponierenden Faktoren zusammen.1 Dies sind beispielsweise die chronische Inflammation sowie Dysregulationen im Renin-Angiotensin-System (RAS) und im Calcium-Phosphat-Stoffwechsel.2 Letztlich hat diese Konstellation eine schon sehr früh im Krankheitsverlauf der CKD auftretende und – verglichen mit der gleich alten Normalbevölkerung – höhere Prävalenz koronarer Ereignisse zur Folge.3
Auch in der Pathogenese gibt es Unterschiede zur nierengesunden Bevölkerung. So ist einerseits die klassische Intimaverkalkung linear mit dem Grad der Niereninsuffizienz zunehmend, darüberhinaus kommt es andererseits schon ab einer mittelgradig eingeschränkten Nierenfunktion oft zu einer signifikanten Mediaverkalkung.4
Präsentation und Diagnostik
Einhergehend mit diesen pathogenetischen Unterschieden ist auch die Präsentation eines ersten akuten koronaren Events anders als bei Nierengesunden, was in der Klinik besondere Bedeutung erhält. Während bei knapp drei Viertel (72 %) der Patienten ohne CKD bei der Koronarischämie klassischerweise Thorax-, Arm- oder Schulterschmerzen im Vordergrund stehen, trifft dies bei nicht einmal der Hälfte (44 %) der CKD-Patienten zu.5 Häufiger kommt es hingegen zu einer oligosymptomatischen Patientenpräsentation mit Dyspnoe, was differenzialdiagnostisch beim Assessment bedacht werden muss.Bei der Diagnosestellung eines akuten koronaren Events kommt erschwerend die bekannte eingeschränkte Beurteilbarkeit der Troponin-Diagnostik hinzu, wobei die Wertigkeit insbesondere bei höhergradig eingeschränkter Nierenfunktion und besonders im Dialysestadium unklar ist. Bei negativem Troponin T kann zwar rasch eine „Rule out“-Entscheidung getroffen werden, allerdings ist bei den meisten CKD-Patienten zur akkuraten Einschätzung eine serielle Kontrolle nötig.6 Im speziellen Patientenkollektiv der chronischen Hämodialyse konnte in verschiedenen Publikationen bei (klinisch stabilen) Patienten sowohl ein Abfall als auch ein Anstieg des Troponin-T-Werts während der Dialyse gezeigt werden, sodass die Interpretation hier letztlich nur in Zusammenschau von Klinik, Vortestwahrscheinlichkeit und Surrogatparametern erfolgen kann.7
Zur Vorhersage koronarer Geschehen sollten traditionelle Risiko-Scores (u. a. Framingham Risk Score) aufgrund mangelnder Validierung und Aussagekraft nicht zur Anwendung kommen. Des Weiteren sind auch funktionelle (Belastungs-)Tests bei stabilen Patienten wie Ergometrie und Myokardszintigrafie aufgrund von niedriger Sensitivität und Spezifität bei oftmals nichterreichter Ausbelastung und vorbestehenden EKG-Veränderungen nur eingeschränkt beurteilbar, sodass oftmals eine Koronarangiografie empfohlen werden muss.8 Letztlich erfolgt aus diesen Gründen insbesondere bei der Vorbereitung zur Nierentransplantation, bei welcher eine solide Kenntnis der koronaren Situation des Patienten vorhanden sein sollte, ein „step-wise approach“ in der Diagnostik von nichtinvasiven bis hin zu invasiven Verfahren.
Folgen und Therapie
Auch die Datenlage zur Behandlung der KHK bei CKD ist von Evidenzmangel geprägt. Einzig zur Lebensstilmodifikation und plättchenaggregationshemmenden Therapie gibt es positive Präventionsdaten.9 Bezüglich einer lipidsenkenden Statintherapie zeigte die SHARP-Studie bei CKD einen präventiven Effekt bei kardiovaskulären Komplikationen,10 jedoch kann den Ergebnissen der AURORA-Studie zufolge bei hochgradig eingeschränkter Nierenfunktion bzw. im Dialysestadium keine Empfehlung mehr für einen Neubeginn mit einem Statin ausgesprochen werden.11
Bei nierengesunden Patienten, die ein koronares Ereignis überstanden haben und oftmals nachfolgend eine eingeschränkte myokardiale Pumpfunktion aufweisen, geht aufgrund einer sehr positiven Datenlage der Trend der Sekundärprophylaxe mittlerweile zu einer multimodalen Quadrupeltherapie mit Betablocker, Sartan-/Neprilysin-Inhibitor, Aldosteronantagonist und SLGT-2-Inhibitor.12
Aufgrund des Mangels an Daten und entsprechenden Zulassungen ist zumindest ein Teil dieser Therapien für CKD-Patienten derzeit nur eingeschränkt verfügbar. Es wird jedoch künftig eine liberalere Therapiegestaltung unter entsprechender Nebenwirkungskontrolle zu erwarten sein.
Bei PAVK***
Die periphere arterielle Verschlusskrankheit (PAVK) ist eine häufige Erkrankung, deren Prävalenz mit dem Alter zunimmt und die ca. 3 % der Bevölkerung über 60 Jahre betrifft. Nikotinabusus ist der wichtigste Risikofaktor, betroffen sind vor allem Männer (m : f = 4 : 1).1, 2 Dabei kommt es zu stenosierenden und okkludierenden Veränderungen der Aorta und der Extremitätenarterien. Das Ausmaß der Restdurchblutung hängt von Stenosegrad, Länge des Verschlusses, etwaigen Kollateralkreisläufen und vom Versorgungsbedarf der abhängigen Gewebsregion (zumeist der Beine) ab.
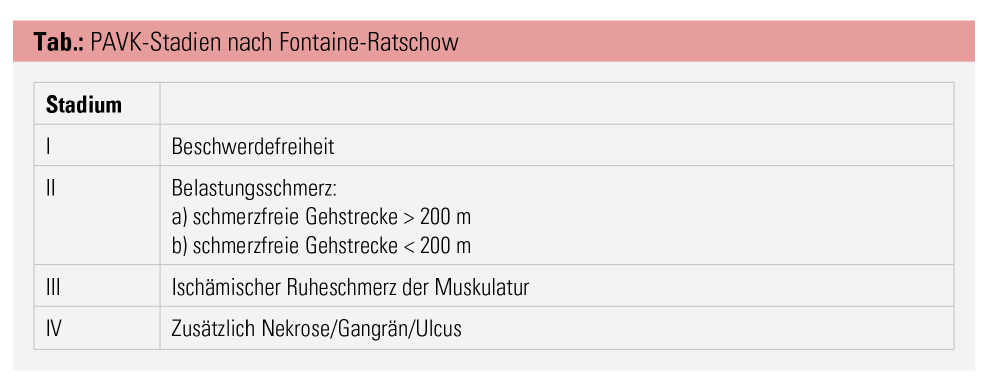
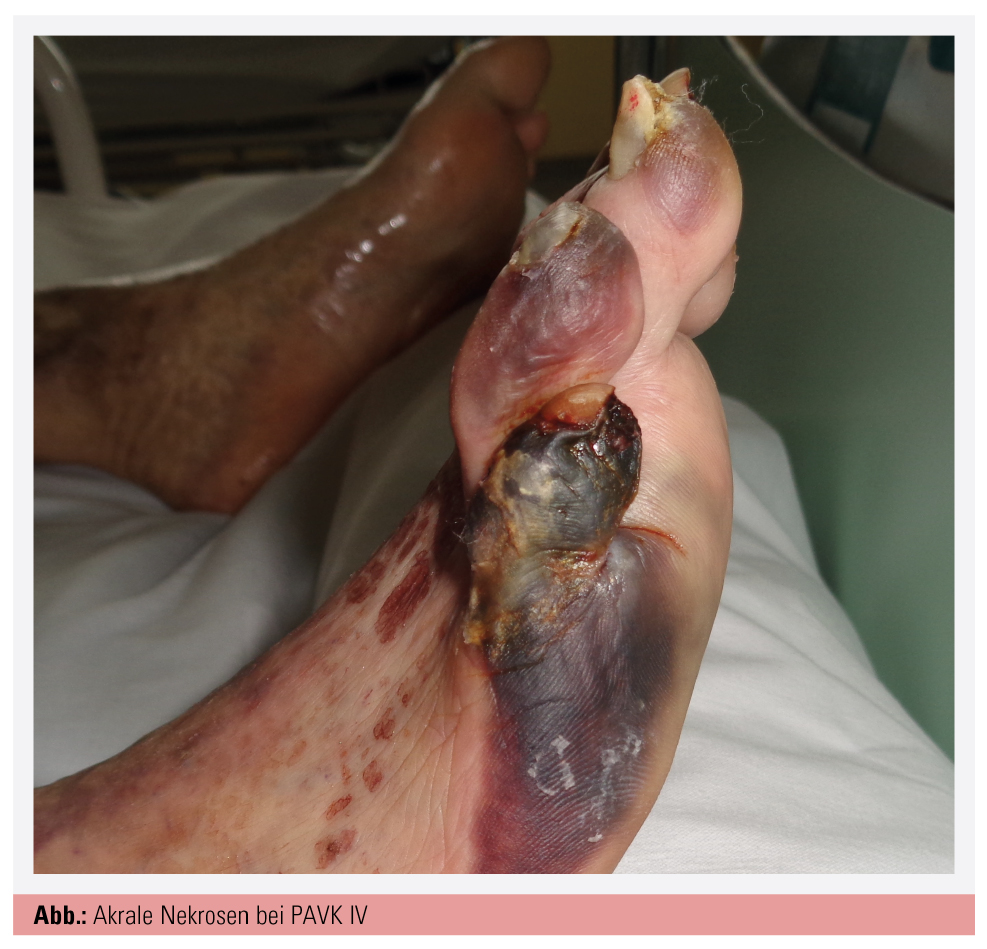
Das Leitsymptom ist der belastungsabhängige ischämische Muskelschmerz, der sich distal der Stenose projiziert und den Patienten zwingt, nach einer bestimmten Gehstrecke stehenzubleiben. An diesem Leitsymptom der Claudicatio intermittens orientiert sich auch die klinische Stadieneinteilung (Tab.). Die Füße sind dabei blass und kühl, die Pulse distal von der Stenose oft nicht mehr tastbar. Mit der systolischen Dopplerdruckmessung in Ruhe (Ankle-brachial-Index) kann als Basisuntersuchung für die PAVK dieses Pulsdefizit quantifiziert, mit der direktionalen Dopplersonografie die Stenose und die typische Strompulskurve visualisiert werden. PAVK geht mit trophischen Störungen, einer verzögerten Wundheilung und letzten Endes auch mit akralen Nekrosen einher (Abb.).
Grundlage der Therapie ist einerseits die Beseitigung/Behandlung der kardiovaskulären Risikofaktoren der Arteriosklerose. Wichtig dabei ist Nikotinkarenz, optimale Therapie des Diabetes mellitus, der arteriellen Hypertonie und der Fettstoffwechselstörung.3, 4 Andererseits erfolgt die Therapie symptomatisch und stadiengerecht und reicht von der Ergotherapie (strukturiertes Gehtraining) im Stadium II, Gabe von Thrombozytenaggregationshemmern, Revaskularisierungsmaßnahmen (perkutane transluminale Angioplastie, Stentimplantation bzw. Bypassoperation), konsequenter Wund- und Infektbehandlung bis hin zur Amputation als Ultima Ratio für die PAVK im Stadium IV.5
Die Prognose hängt vom Schweregrad/Stadium der PAVK ab, vom Ausschluss bzw. Fortbestehen der kardiovaskulären Risikofaktoren und von den weiteren Manifestationen der Arteriosklerose (KHK, ZAVK) sowie den assoziierten Erkrankungen wie Herzinsuffizienz und COPD. Wichtig dabei ist, dass Patienten mit PAVK im Stadium II in ca. 50 % der Fälle auch koronare Gefäßstenosen aufweisen, dass Patienten mit Stadium III und IV in 90 % der Fälle eine KHK und in 50 % der Fälle eine ZAVK haben.6 Die Mehrzahl der Patienten mit PAVK verstirbt an einem Herzinfarkt (ca. 60 %) und Schlaganfall (ca. 10 %). Kurzum – Patienten mit PAVK haben eine um 10 Jahre reduzierte Lebenserwartung.
Dabei kommt zum Tragen, dass Arteriosklerose eine Systemerkrankung ist, die zumeist nicht nur ein isoliertes Gefäßbett, sondern den gesamten Gefäßbaum betrifft. Die kardiovaskulären Risikofaktoren wie arterielle Hypertonie, Hyperglykämie und Dyslipidämie sind nämlich auch systemisch wirksam. Zudem reduziert die PAVK die Mobilität und Lebensqualität der Patienten und macht damit ein körperliches Training bzw. eine Reduktion des Körpergewichts, wie es beispielsweise bei der Therapie des Diabetes mellitus Typ 2 wünschenswert ist, schwierig.
Mönckebergsche Mediasklerose
Abzugrenzen von der PAVK ist die Mönckebergsche Mediaverkalkung, wie sie bei fortgeschrittener chronischer Niereninsuffizienz und bei Diabetes mellitus auftreten kann. Dabei kommt es zu einer Verkalkung der Tunica media in der Gefäßwand. Diese führt wegen der daraus resultierenden Gefäßsteifigkeit und fehlenden Elastizität zu einem höheren peripheren Widerstand und zu einer kardialen Mehrbelastung. Charakteristisch für die Mönckebergsche Mediasklerose ist zudem auch, dass der Knöchel-Arm-Index, wie er zum Screening für die PAVK eingesetzt wird, wegen der eingeschränkten Kompressibilität der Arterien oft falsch hoch ist bzw. normal erscheint. Wie bei der PAVK ist die Kontrolle der zugrundeliegenden kardiovaskulären Risikofaktoren bzw. der diesbezüglichen Grunderkrankungen (chronische Niereninsuffizienz bzw. Diabetes mellitus) Grundlage für die Therapie. Experimentelle Therapieansätze umfassen die Induktion der Autophagie und benötigen noch eine umfassende klinische Erprobung.7
Resümee
Bei PAVK-Patienten ist die klinische Untersuchung der Füße essenziell, um Frühstadien und Komplikationen rechtzeitig zu erkennen und adäquat zu therapieren.
Die Behandlung der PAVK umfasst einen kausalen Therapieansatz mit Kontrolle der kardiovaskulären Risikofaktoren, eine stadiengerechte symptomatische Behandlung vom Gehtraining bis zur Revaskularisation/Amputation und nicht zuletzt eine Diagnostik und Therapie der assoziierten KHK und ZAVK, die wesentlich zur Mortalität dieser Patienten beitragen.