Das Mikrobiom, Probiotika und rheumatoide Arthritis
Das Mikrobiom
Die intestinale mikrobielle Flora hat sich zusammen mit der menschlichen Spezies entwickelt und ist eine symbiotische Beziehung eingegangen. Die Vielfalt und die Zusammensetzung des Mikrobioms wird unter anderem durch genetische und diätetische Faktoren des Wirtes bestimmt.1 In den letzten Jahren wurde immer deutlicher, dass die habituellen Darmbakterien indirekt mit dem Wirt über ihre Stoffwechselprodukte – kurzkettige Fettsäuren („short chain fatty acids“, SCFAs) – interagieren, wobei in einem ausgeglichenen Mikrobiom intestinale Epithelzellen stimuliert werden, um die ausbalancierte angeborene und erworbene Immunantwort im Gastrointestinaltrakt aufrechtzuerhalten. Hierbei wird im Kolon der Großteil an SCFAs produziert, deren wichtigste und meistuntersuchteste Vertreter Butyrat, Propionat und Acetat sind.
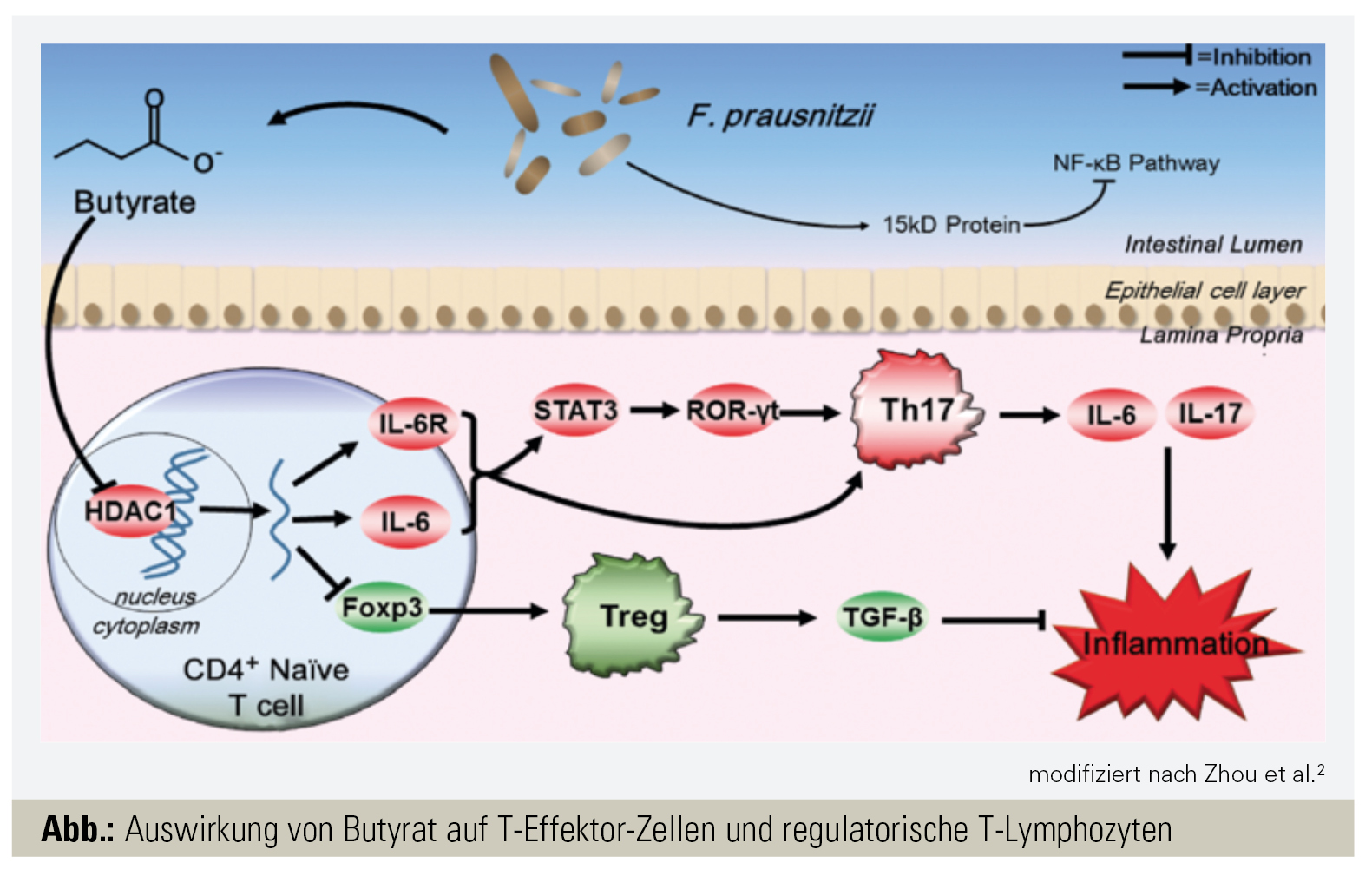
Bekannterweise hemmen Butyrate den proinflammatorischen NFκB-Signalweg, stimulieren regulatorische T-Lymphozyten sowie T-Effektorzellen (Immunhomöostase) und werden von Epithelialzellen für Proliferation und Reparaturmechanismen benötigt, um die Integrität der intestinalen Epithelschicht aufrechtzuerhalten. SCFAs können über histonverändernde Enzyme (Histon-Deacetylasen, HDACs) auch die zelluläre Transkription und Funktion von Proteinen beeinflussen (Abb.).2
Acetat weist eine ähnliche Wirkung auf wie Butyrat, mit dem Unterschied, dass in einem proinflammatorischen Entzündungsmilieu hauptsächlich T-Effektorzellen (Proinflammation) stimuliert werden, nicht jedoch regulatorische T-Zellen (Immuntoleranz). Patienten mit autoimmunen und autoinflammatorischen Erkrankungen wie rheumatoider Arthritis (RA), Spondyloarthritis (SpA) und Psoriasisarthritis (PsA) weisen eine Dysbiose und verringerte Diversität des intestinalen Mikrobioms auf.
Rheumatoide Arthritis
Bei der RA spielt die genetische Prädisposition eine Rolle, wobei sich in den letzten Jahren zeigte, dass auch Umwelteinflüsse wie Rauchen, Infektionen und das Mikrobiom entscheidend an der Pathogenese beteiligt sind.
Beim Rauchen kommt es über Peptidyl-Arginin-Deiminase (PAD) zur verstärkten Citrullinierung von Proteinen, was eine Erklärung für das Auftreten von anticitrullinierten Peptid-Antikörpern (ACPA) bis zu 10 Jahre vor Entstehung der Erkrankung sein könnte. Außerdem ist Rauchen mit Parodontitis assoziiert, die durch Porphyromonas gingivalis mitverursacht wird. RA-Patienten haben gehäufte Parodontiden sowie orale P.-gingivalis-Besiedlung.3 In epidemiologischen Studien zeigte sich ein gehäuftes Auftreten von P.-gingivalis-Antikörpern bei RA-Patienten, obwohl bislang trotz zahlreicher Hypothesen eines infektiösen Auslösers kein direkter Keimnachweis gelang. P. gingivalis ist der einzige bekannte Kommensale, der das PAD-Enzym exprimiert und so menschliche Proteine citrulliniert.
Im Gastrointestinaltrakt scheint vor allem eine Reduktion der Bacteroidetes-Population und ein gehäuftes Auftreten von Prevotella copri (75 % im Vergleich zu 25 % bei Normalbevölkerung) von Bedeutung zu sein. Weiter zeigten sich eine Reduktion von Faelibacterium, einem der häufigsten physiologischen Darmkeime und ein Butyratproduzent, sowie eine Verschiebung des Mikrobioms in Richtung Acetatproduzenten. Die verringerte Diversität des Mikrobioms scheint vor allem durch die Krankheitsdauer und das Vorkommen von Auto-Antikörpern bestimmt zu sein.4 In einer Studie von Zhang et al. mit neu diagnostizierten und bislang unbehandelten RA-Patienten bestand ein Teil der gesunden Kontrollgruppe aus nahen Angehörigen von RA-Patienten. Diese wiesen allerdings eine mikrobielle Komposition auf, die den restlichen gesunden Kontrollen deutlich näher war als den verwandten RA-Patienten, sodass hier davon ausgegangen werden muss, dass genetische, diätetische und Umwelteinflüsse auf die Veränderung des Mikrobioms eine geringere Rolle zu spielen scheinen.5 Auch zeigte sich in dieser Studie, dass bei therapienaiven Patienten die Einleitung einer Immunmodulation und somit die Reduktion der Krankheitsaktivität zu einer Rekompensation der mikrobiellen Flora führte.
Einsatz von Probiotika
Bei RA versuchten einige Studien, eine Reduktion der Arthritis-Aktivität mittels oraler Probiotikagabe nachzuweisen. Hierfür wurde Lactobacillus casei verwendet. In einer Studie zeigte sich eine signifikante Reduktion von Tumor-Nekrose-Faktor (TNF) im Serum, eine Änderung der klinischen Parameter konnte nicht nachgewiesen werden.6 In einer Studie von Zamai et al. mit Lactobacillus rhamnosus, L. reuteri und L. casei konnte eine signifikante Reduktion von IL-12 und TNF sowie C-reaktivem Protein und klinischen Parametern erreicht werden.7 Einschränkend muss jedoch erwähnt werden, dass die statistisch signifikante Reduktion der Krankheitsaktivität nach erfolgter Probiotika-Therapie dennoch eine mittlere Krankheitsaktivität bedeutete (DAS28 von 4,0 auf 3,7 gesunken).
Eines der größten Probleme beim Einsatz von Probiotika war in der Vergangenheit, dass die meist fakultativ anaeroben probiotischen Stämme nicht in der Lage waren, den unteren GI-Trakt zu besiedeln. Die erfolgversprechendsten anaeroben Bakterien, die hier zum Einsatz kommen könnten, sind: Akkermansia muciniphila, Bacteroides fragilis, Bacteroides thetaiotaomicron, Faecalibacterium prausnitzii und Prevotella histicola. A. muciniphila produziert große Mengen an SCFA und moduliert das Immunsystem; B. fragilis scheint ebenfalls im Kontext der Erkrankung das Immunsystem positiv zu beeinflussen; B. thetaiotaomicron beeinflusst die Komposition des übrigen Mikrobioms, indem es pathogene Bakterien wie Listeria monocytogenes reduziert, was wiederum zu einer Vermehrung förderlicher Darmkeime führt; F. prausnitzii gilt als einer der größten Butyratproduzenten (Effekte s. o.); P. histicola fördert die T-Zell-Differenzierung in Richtung regulatorischer T-Zellen und fördert die Vermehrung physiologischer Darmkeime wie Prevotella und Sutterella.
Inwiefern der Einsatz von Probiotika bei der Behandlung der RA in Zukunft eine Rolle spielen wird, bleibt Gegenstand laufender Forschung. Die Zukunft der Probiotikatherapie sollte auf jeden Fall in der individuellen Mikrobiomanalyse und maßgeschneiderten Zusammenstellung probiotischer Stämme liegen, um eine zielgerichtete Optimierung des Mikrobioms zu ermöglichen. Dies ist derzeit logistisch und finanziell im Routinebetrieb noch nicht möglich.






















































































_Baldur_Scholz_GmbH_opt.jpg)
