SERIE Venöse Thromboembolie: Diagnose der Pulmonalarterienembolie – Strategien im Jahr 2012
Am Beginn der Abklärung sollten eine sorgfältige Anamnese sowie eine genaue körperliche Untersuchung des Patienten stehen. Typische Symptome wie plötzlich aufgetretene Dyspnoe, Thoraxschmerzen oder Tachypnoe sind bei über 60 % der Patienten mit Pulmonalarterienembolie (PAE) vorhanden, während andere (Synkope, Hämoptysen) deutlich selte – ner (< 20 %) beschrieben werden.1, 2 Die körperliche Untersuchung, das Elektrokardiogramm sowie ein Thoraxröntgen können weitere Hinweise in Richtung der Verdachtsdiagnose Lungenembolie geben, sind aber ebenso bedeutend in der Erfassung anderer, differenzialdiagnostisch zu beachtender Krankheitsbilder.
Scores: Zwei etablierte klinische Vorhersagescores, der Wells-Score und der Revised Geneva-Score, erlauben die Einteilung von Patienten anhand von Risikofaktoren und klinischen Charakteristika in Gruppen unterschiedlicher Vortestwahrscheinlichkeit (niedrige, mittlere oder hohe klinische Wahrscheinlichkeit > Tab.).3, 4 Der Wells-Score ist umfangreicher validiert und mit ihm kann die Wahrscheinlichkeit für das Vorliegen einer PAE in zwei oder drei Stufen berechnet werden. Der Revised Geneva- Score hat den Vorteil, ohne eine subjektive Beurteilung auszukommen.
D-Dimere: In den meisten diagnostischen Algorithmen ist die Bestimmung der D-Dimere im Plasma zur PAE-Diagnostik vorgesehen. Der große Vorteil dieses Labortests ist seine hohe Sensitivität für venöse Thromboembolien (> 95 % für den ELISA, 85–90 % für den Latextest), welche bei negativem Testergebnis den weitgehenden Ausschluss einer PAE bei Patienten in den niedrigen Risikokategorien erlaubt. Der Nachteil aller D-Dimer-Testsysteme ist die niedrige Spezifität, speziell bei älteren und stationären Patienten, Malignomen sowie in der Schwangerschaft.5
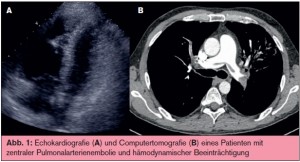
Bildgebung: Auch wenn klinische Scores und D-Dimer wertvolle Hinweise liefern können, ist zur definitiven Diagnose einer PAE eine bildgebende Untersuchung unverzichtbar. Der heutige Standard in der Diagnostik ist die Multidetektor-Computertomografie, die in praktisch allen Fällen eine PAE beweisen oder auch ausschließen kann.6 Die heutigen Multidetectorscanner bieten mit Schichtdicken um 1 mm und sehr kurzen Scanzeiten eine hervorragende Auflösung bis in den subsegmentalen Bereich. Durch breite Verfügbarkeit dieser Geräte ist eine exakte Diagnostik heute auch in Standardkrankenhäusern und ambulanten diagnostischen Einrichtungen möglich. In der Diagnostik der massiven PAE mit hämodynamischer Beeinträchtigung hat die Echokardiografie als notfallmäßig direkt am Krankenbett verfügbare Methode einen hohen Stellenwert. Das wichtigste Kriterium stellt dabei die Dilatation der Rechtsherzabschnitte dar (> Abb. 1), welche allerdings differenzialdiagnostisch gegen andere Ursachen der Rechtsherzbelastung, wie das chronische Cor pulmonale, abgegrenzt werden muss. Gemeinsam haben die Computertomografie und die Echokardiografie den Vorteil, dass alternative Diagnosen, wie zum Beispiel ein Myokardinfarkt mit regionalen Wandbewegungsstörungen oder eine Aortendissektion, mit derselben Untersuchung erkannt werden können. 7 Nicht vergessen werden sollte die Bedeutung der Duplexsonografie der Beinvenen, welche in bestimmten klinischen Situationen (zum Beispiel Schwangerschaft, Niereninsuffizienz, Kontrastmittelunverträglichkeit) als initiale Diagnostik zum Einsatz kommt und wertvolle diagnostische Hinweise geben kann.8 Dabei muss allerdings berücksichtigt werden, dass sich sonografisch nur in etwa 30–50 % der Patienten mit PAE eine Thrombose in den Beinvenen nachweisen lassen wird.9, 10 Andere Modalitäten haben heutzutage stark an Bedeutung verloren und werden nur noch in einzelnen Fällen eingesetzt. Die Perfusions-/ Ventilationsszintigrafie der Lunge liefert je nach Interpretationskriterien und Patienten – gut bis zu 75 % nicht-diagnostische Befunde, welche einer weiteren Abklärung bedürfen. 11 Sie wird deshalb, ebenso wie die konventionelle Pulmonalisangiografie, nur noch selten durchgeführt. Die MR-Angiografie hat den Vorteil der fehlenden Strahlenbelas – tung, hat sich jedoch bisher in der Routinediagnostik der PAE nicht durchsetzen können.
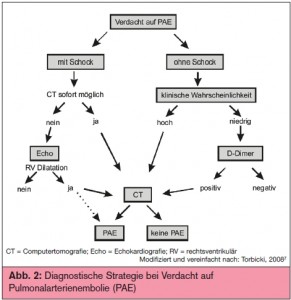
Diagnostische Strategie: Bei einem hämodynamisch instabilen, schockierten Patienten bietet sich als initiale Diagnostik die Echokardiografie an. Beim Fehlen von Rechtsherzbelastungszeichen kann in diesem Fall die Verdachtsdiagnose einer PAE verworfen und die Suche auf anderen Ursachen für das klinische Zustandsbild gerichtet werden. Umgekehrt wird bei einem Patienten mit niedriger Vortestwahrscheinlichkeit die Bestimmung der D-Dimere sinnvoll sein, um eine PAE ausschließen zu können. Dabei ist zu beachten, dass nur das negative Ergebnis eines hochsensitiven D-Dimer-Tests ausreicht, um bei Patienten mit mittlerer Vortestwahrscheinlichkeit in den 3-stufigen Scores eine PAE ohne weitere Diagnostik auszuschließen. Bei Verwendung eines weniger sensitiven D-Dimer- Assays ist das nur bei einer geringeren Anzahl von Patienten möglich (niedrige Wahrscheinlichkeit im 3-stufigen und 2-stufigen Score). In allen anderen Fällen wird dann eine computertomografische Untersuchung Klar – heit über das Vorliegen einer PAE bringen. > Abb. 2 zeigt einen Vorschlag für eine diagnostische Strategie in Anlehnung an die aktuellen Leitlinien der European Society of Cardiology (ESC)7.
FACT-BOX
• Die Multidetector-Computertomografie ist heute die Methode der Wahl zur Diagnose einer Pulmonalarterienembolie (PAE).
• Ein diagnostischer Algorithmus mit einem klinischen Wahrscheinlichkeitsscore und einer D-Dimer-Bestimmung ermöglicht den Ausschluss einer PAE bei Patienten mit niedrigem Risiko.
• In speziellen Situationen können weitere Untersuchungen, wie Echokardiografie oder Duplexsonografie der Beinvenen, wert – volle zusätzliche Informationen bringen.
1 Miniati M. et al., Am J Respir Crit Care Med1999; 159:864-71
2 Stein P.D. et al., Chest 1997; 112:974-79
3 Wells P.S. et al., Thromb Hemost 2000; 83:416-20
4 Le Gal E.A. et al., Ann Int Med 2006; 144:165-71
5 Di Nisio M. et al., J Thromb Hemostas 2007; 5:296-304
6 Schoepf U.J. et al., Circulation 2004; 109:2160-67
7 Torbicki A. et al., Eur Heart J 2008; 29:2276-315
8 Bounameaux H. et al., Vasc Med 2010; 15:399-406
9 Turkstra F. et al., Ann Intern Med 1997; 126:775-81
10 Kearon C. et al., Ann Intern Med 1998; 129:1044-49
11 Sostmann H.D. et al., Radiology 2008; 246:941-46