Gicht – Harnsäure: Wann senken und wie stark?
Die Gicht ist die bei Weitem häufigste kristallinduzierte Gelenkentzündung. Sie ist aber auch – um bei den Superlativen zu bleiben – wahrscheinlich die in ihren Implikationen für die Betroffenen am stärksten unterschätzte Erkrankung. Es handelt sich um eine durch Mononatriumurat-Kristalle induzierte Entzündung der Gelenke und/oder der Weichteile. Als Rheumatologen sollten wir uns aber immer auch der Bedeutung der Hyperurikämie für die Niere und als allgemeiner, auch kardiovaskulärere, Risikofaktor bewusst sein.
„Disease of Kings“
Die Arthritis urica ist eine bereits seit dem Altertum bekannte Erkrankung, die auch als „the king of the diseases and the disease of kings“ bezeichnet wird. Dies bezieht sich auf den früheren, fast exklusiven Befall reicher bzw. adliger Personen – aufgrund der reichhaltigeren Ernährung und des Zugangs zu Alkohol – im Gegensatz zur Normalbevölkerung. Dokumente der Erkrankung in Form von Gichttophi finden sich bereits an Mumienpräparaten aus dem vorchristlichen Ägypten. Auch Hippokrates hatte sich mit der Behandlung der Arthritis urica auseinanderzusetzen und beschrieb die klassische Podagra.
Die Prävalenz der Arthritis urica zeigt erhebliche regionale und ethnische Unterschiede mit in unserer Zeit generell steigender Tendenz und beträgt derzeit in den westlichen Ländern zwischen drei und vier Prozent, wobei Männer doppelt so häufig betroffen sind; Frauen in überwiegendem Ausmaß erst nach der Menopause. Bei prämenopausalem Auftreten sollte immer nach einer sekundären Gicht gesucht werden wie z. B. nach einer „eating disorder“ (Anorexie bzw. Bulimie), die aufgrund der permanent katabolen Situation und z. B. einem Diuretika- und Laxanzienabusus ebenso zu Hyperurikämien disponiert.
Die Prävalenz der Hyperurikämie erreicht rezenten Studien zufolge Werte von 21 % bei beiderlei Geschlecht, was zu einem Gutteil auf die Zunahme der Adipositas zurückzuführen ist.
Genetik und Ernährung
In 30 % findet sich eine positive Familienanamnese. In rund 90 % liegt eine verminderte renale Exkretion der Harnsäure (HS) vor, wohingegen die vermehrte HS-Produktion die Ausnahme darstellt. Was die renale HS-Eliminierung betrifft, hat die Forschung genetische Polymorphismen am Chromosom 11 (Anionentransporter URAT1) bzw. am Chromosom 4 (GLUT9 und ABCG2) identifizieren können. Zusätzlich spielen exogene und hier vor allem nutritive Faktoren eine Rolle.
Als Auslöser gelten – entgegen der früheren Lehrmeinung – nicht nur purinreiche Nahrungsmittel, wie z. B. Innereien oder Spargel, sondern auch Alkohol und fruktosereiche Nahrungsmittel (Äpfel und Orangen) bzw. fruktosehältige Softdrinks. Andere Nahrungsmittel, wie z. B. fettarme Milchprodukte oder die Einnahme von Vitamin C haben sich als harnsäuresenkend herausgestellt.
Das Löslichkeitsprodukt von Harnsäure beträgt 6,8 md/dl – überschreitet die Konzentration von Natriumurat diesen Grenzwert, kann es zur Mononatriumurat-Kristallformation kommen und zur entsprechenden Deposition im Gewebe. Dieser Mechanismus wird von lokalen Faktoren, wie Temperatur, pH-Wert, Hydratationszustand etc. beeinflusst, bzw. prädisponiert beispielsweise auch eine vorbestehende Osteoarthrose zu Uratablagerungen. Die Phagozytose dieser Uratkristalle führt zur intrazellulären Aktivierung des NALP3-Inflammasoms, was in weiterer Folge IL-1β, ein stark proinflammatorisches Zytokin, aktiviert.
Die Hyperurikämie ist, wenn Bestandteil des metabolischen Syndroms, ein Risikofaktor für Inzidenz und Mortalität bei koronarer Herzkrankheit und bei Frauen ausgeprägter als bei Männern. Inwieweit die isolierte Hyperurikämie einen kardiovaskulären Risikofaktor darstellt, ist in Diskussion und wird beforscht. Harnsäure per se stellt ein Antioxidans dar, und ihr Vorhandensein bedeutete in der Evolution des Menschen an sich einen Überlebensvorteil, der sich nun durch die Änderung unseres Lebensstils in das Gegenteil verkehrt.
Vier klinische Stadien
Folgende vier klinische Stadien der Gicht werden unterschieden: asymptomatische Hyper-urikämie, akuter Gichtanfall, Arthritis urica im Intervall sowie die chronisch-tophöse Gicht. Besondere Beachtung und steigendes Interesse sollte vor allem die Arthritis urica im Intervall finden, denn diese wird häufig nicht erkannt bzw. verkannt und kann dann in einer durchaus invalidisierenden Gelenkerkrankung enden.
Typisch für die akute Gicht ist die meist aus Beschwerdefreiheit auftretende, hoch schmerzhafte Monarthritis mit fulminantem Beginn, seltener treten auch eine Oligoarthritis oder Daktylitis bzw. Bursitiden auf. Im Rahmen eines derartigen Gichtschubes kann es auch zu einer deutlichen Auslenkung der Akutphaseproteine kommen. Anekdotisch werden sogar akute Gichtarthritiden in einem Gelenk nach Totalendoprothese (TEP) berichtet.
Ohne spezifische Therapie verschwindet eine Gichtattacke üblicherweise innerhalb von 7 bis 10 Tagen. Sichere Daten hinsichtlich der Wahrscheinlichkeit von Rezidiven ohne harnsäuresenkende Therapie existieren nicht. In einer retrospektiven Fallstudie vor Einführung von Allopurinol wird die Rezidivrate nach 1 Jahr mit 62 % und nach 3 Jahren mit 84 % angegeben.
Im chronischen Stadium kommt es zur Entstehung von Gichttophi in Gelenken, Sehnen, Bursen, Ohrknorpel und in der Subkutis. Ganz generell ist eine Uratdeposition in allen mesenchymalen Geweben möglich.
Diagnose
Für die akute Gichtarthritis wird das Vorliegen des typischen klinischen Bildes – wie oben beschrieben – zur Diagnosestellung als ausreichend betrachtet. Als Goldstandard gilt allerdings nach wie vor der Nachweis von phagozytierten Harnsäurekristallen im Gelenkpunktat bzw. Tophusmaterial im Polarisationsmikroskop. Für alle Kristallarthropathien hat die Arthrozentese zur Diagnosestellung eine zentrale Bedeutung.
Im Nativröntgen zeigen sich charakteristische Veränderungen wie Lochdefekte, kalkdichte Tophi in den Weichteilen, Usuren und z. B. der „Gichtstachel“, der für die Erkrankung pathognomisch ist. In zunehmendem Maße hat sich der Gelenk-Ultraschall als diagnostische Methode etabliert. Einerseits ist es das so genannte „Doppelkonturzeichen“, verursacht durch Natriumuratablagerungen auf dem hyalinen Gelenkknorpel, andererseits der Nachweis von Uratkristallen oder Pannusgewebe in der Synovia (periartikuläre Tophi imponieren „wolkig“), welche die Diagnose erhärten, dazu kann noch der Power-Doppler als Entzündungsnachweis zum Tragen kommen.
Eine elegante Methode zum Nachweis von Harnsäuredepots stellt die Dual-Energy-Computertomografie (DECT) dar. Allerdings bleibt diese aufgrund der Verfügbarkeit, der einzukalkulierenden Strahlendosis und der entstehenden Kosten speziellen, in erster Linie differenzialdiagnostischen Fragestellungen vorbehalten.
Akuttherapie
Sowohl zur Diagnose als auch zur Therapie der Gicht hat die EULAR 2006 evidenzbasierte Expertenempfehlungen im Rahmen eines ESCICIT (EULAR Standing Committee for Interna-tional Clinical Studies Including Therapeutics) herausgebracht (Zhang et al., EULAR evidence based recommendations for gout. Ann Rheum Dis 2006).
Nicht vergessen werden sollte auf Lokalmaßnahmen wie Kryotherapie oder Topfenumschläge.
Zur medikamentösen Akuttherapie stehen nichtsteroidale Antirheumatika (NSAR), zu denen auch die Coxibe zu zählen sind, und Kolchizin sowie – bei entsprechender Indikation – auch Steroide (systemisch oder intraartikulär) zur Verfügung.
In dieser speziellen Patientenpopulation ist besonders auf die kardiovaskulären Risken der NSAR-Anwendung zu achten. Bei Kolchizin ist zumeist das Nebenwirkungsprofil mit in erster Linie gastrointestinalen Beschwerden und Knochenmarkstoxizität limitierend. In einer rezenten Studie hat sich die Niedrigdosisgabe mit 1,2 mg Kolchizin zu Beginn des Anfalls, gefolgt von 0,6 mg nach einer Stunde als ebenso wirksam, wie das früher übliche Hochdosisschema erwiesen. Auch für den prophylaktischen Einsatz ist Kolchizin geeignet. Die gleichzeitige Gabe mit anderen, das Zytochrom CAP3A4 benutzenden Medikamenten (z. B. Clarithromycin oder Statine) sollte vermieden werden.
Wesentlich erscheint es, die antiphlogistische Therapie nach dem akuten Gichtanfall für längere Zeit (drei bis sechs Monate) als Anfallsprophylaxe fortzusetzen.
Die Erforschung der IL-1β-Aktivierung hat zu Pilotstudien mit IL-1-Antagonisten wie Anakinra, Rilonacept und Canakinumab geführt, die sich bisher in kleinen Patientenkollektiven sowohl in der Therapie als auch Prophylaxe einer Gichtarthritis als effizient erwiesen haben. Aufgrund der hohen Kosten werden diese Therapeutika allerdings – zumindest vorerst – nur eine geringe Rolle spielen können. Für die Behandlung der polyartikulären chronischen Gichtarthritis allerdings könnte IL-1-Hemmung eine, vor allem wegen des Nebenwirkungsprofils von NSAR, Kolchizin und Kortikosteroiden, die Alternative darstellen.
Harnsäuresenkung
Eine asymptomatische Hyperurikämie stellt keine zwingende Therapieindikation dar. Über den Grenzwert, ab dem eine symptomlose Hyperurikämie behandelt werden sollte, herrscht keine Einigkeit unter Rheumatologen und schon gar nicht unter Rheumatologen und Nephrologen, wie auch nicht darüber, ob nach dem ersten Gichtanfall bereits eine harnsäuresenkende Therapie einzuleiten wäre. Sind Nierensteine anamnestisch zu erheben, ergibt sich allerdings schon nach dem ersten Arthritis-urica-Schub eine Therapieindikation.
Die Sicht der Autoren: Ab einem Harnsäurewert von > 10 mg% bei Männern, bei Frauen höher, ist eine uratreduzierende Therapie zu überdenken, jedenfalls sollte der Wert kontrolliert und mit dem Patienten ein Gespräch über Ernährung und Lifestyle-Modifikation geführt werden.
Ein stattgehabter Gichtschub stellt die Indikation zur Einleitung einer uratsenkenden Therapie dar, begleitet von einer Anfallsprophylaxe mit NSAR oder Kolchizin.
Die Erfahrung lehrt, dass nach einem akuten Gichtanfall mit der Gabe einer harnsäuresen-kenden bzw. urikostatischen Therapie nicht sofort begonnen werden, sondern zumindest 14 Tage bis drei Wochen zugewartet werden sollte, um nicht die Anfälle zu prolongieren. Literaturevidenz für dieses Vorgehen findet sich nur ausgesprochen spärlich.
Das gebräuchlichste Urikostatikum und derzeitige Standardtherapie ist Allopurinol. Ein einschleichender Beginn mit 100 mg täglich und schrittweiser Steigerung auf 300 mg ist an-gezeigt; in hartnäckigen Fällen ist auch eine Steigerung bis 600 mg/d durchaus möglich.
Als Zielwert der Serumharnsäure unter Therapie hat sich konsensuell < 6 mg/dl heraus-kristallisiert. Regelmäßige Kontrollen der Zielwerterreichung sind notwendig. Einerseits bedeutet die Senkung der Serumharnsäure unter den Zielwert die Möglichkeit der Auflösung von Harnsäuredepots, anderseits das Nichterreichen die Gefahr weiterer Ausbreitung der Uratdepositionen und damit möglicherweise einer Chronifizierung der Erkrankung. Durch die Auflösung von Harnsäuredepots wird die Gicht zur heilbaren Erkrankung – wo keine Harnsäurekristalle, dort keine durch sie induzierte Arthritis. An häufigsten Nebenwirkungen von Allopurinol sind Urtikaria, Diarrhöen, Leukopenien, Fieber und Hypersensitivitätsreaktionen der Haut zu beobachten. Allopurinol ist in unseren Breiten – aufgrund der breiten und häufig nicht indizierten Verschreibung – die häufigste Ursache für das Stevens-Johnson-Syndrom bzw. die toxische epidermale Nekrolyse. Eine absolute Kontraindikation für Allopurinol stellt eine Azathioprintherapie dar (Knochenmarkstoxizität).
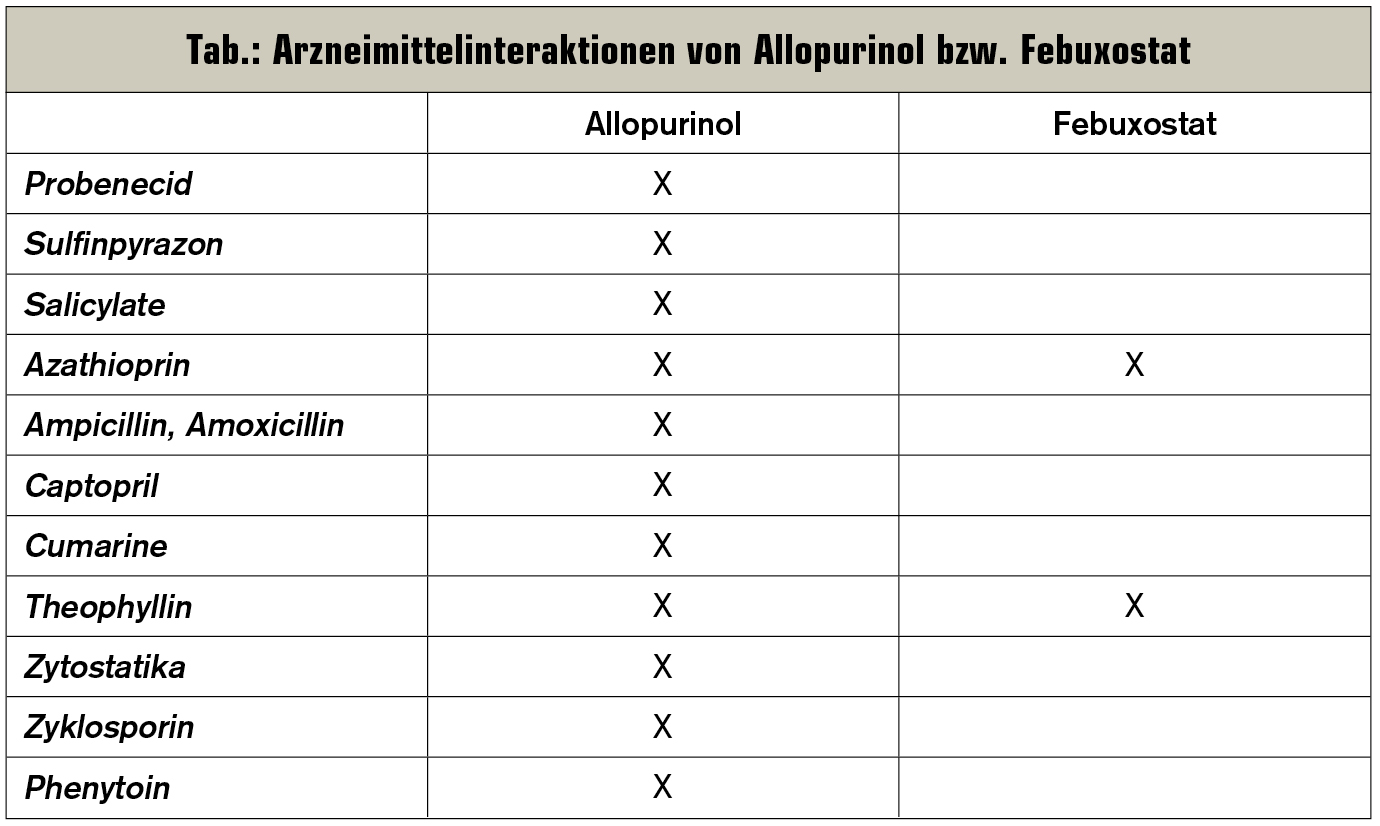
Seit 2012 steht – bei Allopurinolunverträglichkeit, Kontraindikation oder ungenügender Wirksamkeit – als Alternative zu Allopurinol der nicht purinanaloge Xanthinoxidase-Hemmer Febuxostat zur Verfügung. Dieser kann auch bei fortgeschrittener, chronisch renaler Insuffizienz bis KDOQI-Stadium IV gegeben werden. Unter laufender Therapie sind regelmäßige Kontrollen von Leber- und Schilddrüsenparametern erforderlich. Kontraindikationen stellen unter anderem die koronare Herzerkrankung, eine kardiale Insuffizienz ab NYHA-Stadium III und – wie bei Allopurinol – eine laufende Azathioprintherapie dar. Dermatologische Nebenwirkungen sind ebenfalls beschrieben, Arzneimittelinteraktionen sind unter Febuxostat jedenfalls seltener (Tab.).
Urikosurika sind derzeit in Österreich nicht mehr auf dem Markt, können aber über die internationale Apotheke bezogen werden. Benzbromaron ist aufgrund toxischer Leberschäden mittlerweile in Österreich nicht mehr am Markt, aber z. B. in Deutschland noch erhältlich, ebenso wie Probenecid und Sulfinpyrazon – begleitend sollte hier zur Nierensteinprophylaxe eine Harnalkalisierung mit z. B. Uralyt-U erfolgen.
Bestandteil jeder langfristigen Gichttherapie sollte ein Gespräch bezüglich Lifestyle-Modifikation mit Betonung einer bewussten, fruktose- und alkoholarmen Ernährung, einer gezielten Gewichtskontrolle und – falls notwendig – langsamen Gewichtsreduktion sein. Crash-Diäten sind aufgrund des Risikos, einen akuten Gichtanfall durch vermehrten Anfall von Stoffwechselprodukten auszulösen, strikt zu meiden. Das kardiovaskuläre Risikoprofil sollte evaluiert werden, falls möglich sollten auch entsprechende Therapieadaptationen vorgenommen werden, wie z. B. Reduktion bzw. Ersatz von Diuretika bzw. Einsatz von Losartan und Fibraten wegen ihrer uratsenkenden Wirkung.
Wie eminent wichtig eine ernsthafte Diskussion über das Thema Arthritis urica ist, zeigt eine Untersuchung aus England, die einen nur sehr geringen Grad der Kohärenz zwischen täglicher Praxis des Gichtmanagements und den EULAR-Empfehlungen zeigt. Die Gicht kann mit dem heute verfügbaren diagnostischen und therapeutischen Armamentarium zu den Erkrankungen mit sehr guter Prognose, ja zu den heilbaren Krankheiten gerechnet werden, allerdings bei Einsatz aller Möglichkeiten in geeigneter Weise. Eine breite Diskussion über vorliegende Empfehlungen, Reflexion der täglichen Praxis, Berücksichtigung der Patientenperspektive und stetige Forschungstätigkeit werden hoffentlich letztlich zu einer Optimierung der Betreuung von Gichtpatienten führen.