Immuncheckpointinhibitoren und ihre renalen Auswirkungen
Immuncheckpointinhibitoren (ICPIs) haben die Tumortherapie und somit das Überleben für viele Patienten dramatisch verbessert. Diese humanen oder humanisierten Antikörper (meist Subtyp IgG1, Ausnahme Nivolumab [Subtyp IgG4]) gegen verschiedene Rezeptoren und Liganden entfesseln das Immunsystem, um Tumorzellen zu detektieren und zu zerstören. ICPIs ermöglichen erhöhte Antitumoraktivität, bringen aber auch ein ganzes Spektrum von autoimmunen Nebenwirkungen bzw. immunmediierten Endorganschädigungen mit sich – unter anderem in Lunge, Leber, Pankreas, Gelenken, Nervensystem, Blutgefäßen, Herz, Augen und eben auch in der Niere. Am häufigsten sind Haut und Gastrointestinaltrakt betroffen. Das tritt bei mehr als 50 % der Patienten auf, schwere Toxizitäten entwickeln sich in etwa 20 % der Fälle. Das Auftreten von Nebenwirkungen mit einem bestimmten ICPI lässt nicht den Schluss zu, dass diese auch mit einem anderen auftreten müssen. Nur ungefähr 50 % der Patienten, die reexponiert wurden, entwickeln nochmals dieselbe Nebenwirkung. Im Gegensatz zu extrarenalen Manifestationen ist die Inzidenz an Nephrotoxizität bzw. renalen immunmediierten Nebenwirkungen allerdings deutlich geringer. Unter Monotherapie mit einem der ICPIs findet man sie bei etwa 2 % der behandelten Patienten, in der Kombinationstherapie bei etwa 5 %. Da sich bisherige Daten auf kleine Studien und Fallberichte beschränkt haben, wird dies wahrscheinlich unterschätzt. Häufig wird als renale Nebenwirkung akute/akutes Nierenschädigung/-versagen (AKI) beschrieben, hier vor allem häufig die akute tubulointerstitielle Nephritis.
Immuncheckpoints und Immuncheckpointinhibitoren
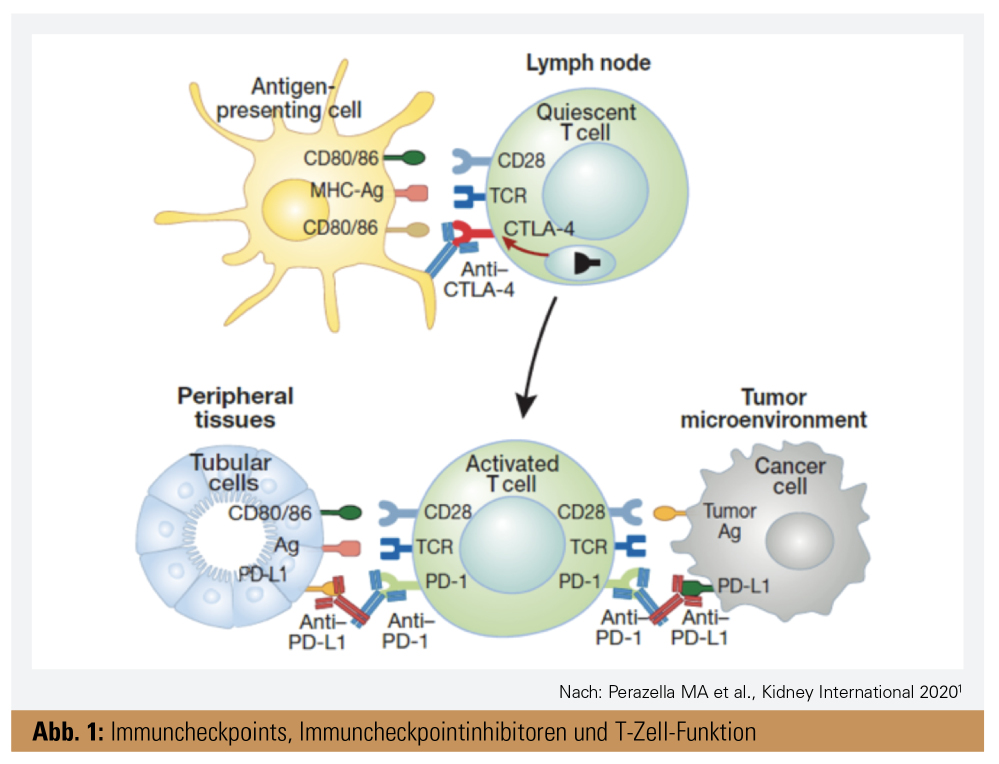
„Immuncheckpoints“ sind regulatorische Proteine (CD80/86, CTLA-4, PD-L1 und PD-1), die verantwortlich für die Balance zwischen T-Zell-Aktivierung (um die fremden Antigene zu detektieren und zu zerstören) und der Unterdrückung der T-Zell-Aktivierung gegen das eigene Gewebe und somit für die Vermeidung von Autoimmunreaktionen sind.
Im Bereich der Lymphknoten sind T-Zellen in einer Art Ruhezustand, können aber durch Präsentation eines fremden Antigens an den TCR (T-Zell-Rezeptor) aktiviert werden (Abb. 1). Die Interaktion findet zwischen Ligand CD80 bzw. CD86 an der antigenpräsentierenden Zelle und dem Rezeptor CTLA-4 an der T-Zelle statt und verursacht eine T-Zell-Suppression. Entsprechende ICPIs gegen CTLA-4 (Ipilimumab und Tremelimumab) blockieren diese inhibitorischen Signale, und so kann die Immunantwort aktiviert werden. In peripheren Geweben findet die Interaktion zwischen PD-L1 oder PD-L2 , die in einer Reihe von Gewebezellen exprimiert werden, wie Endothel oder Epithel, und PD-1-Rezeptoren auf T-Zellen statt, wodurch T-Zellen deaktiviert werden. Das bedeutet, dass eigenes Gewebe erkannt und somit eine Autoimmunreaktion verhindert wird. Tumorzellen haben die besondere Eigenschaft, ihre Antigene zu modifizieren, sie exprimieren sogar die gleichen Immuncheckpoints wie normale Zellen (PD-L1), dadurch ändert sich ihr Phänotyp, und die Immunantwort wird unterdrückt. Um diese Tumormimikry zu vermeiden, werden Immuncheckpointinhibitoren verwendet. Anti-PD-L1 und Anti-PD-1 unterbrechen die Interaktion zwischen PD-L1 (befindet sich an peripheren Gewebezellen oder an Tumorzellen) und PD-1 (an T-Zellen) und ermöglichen, dass das Immunsystem Tumorzellen detektiert und aggressiv zerstört. Basierend auf diesem Konzept werden die Antikörper Nivolumab, Pembrolizumab und Cemiplimab, die den PD-1-Rezeptor blockieren, oder die Antikörper Atezolizumab, Avelumab und Durvalumab, welche die PD-L1 blockieren, verwendet. Die Kombination von Medikamenten, die CTLA-4 und PD-/PD-L1-Signalwege als Ziel haben, stellen so eine effektive Tumortherapie dar.
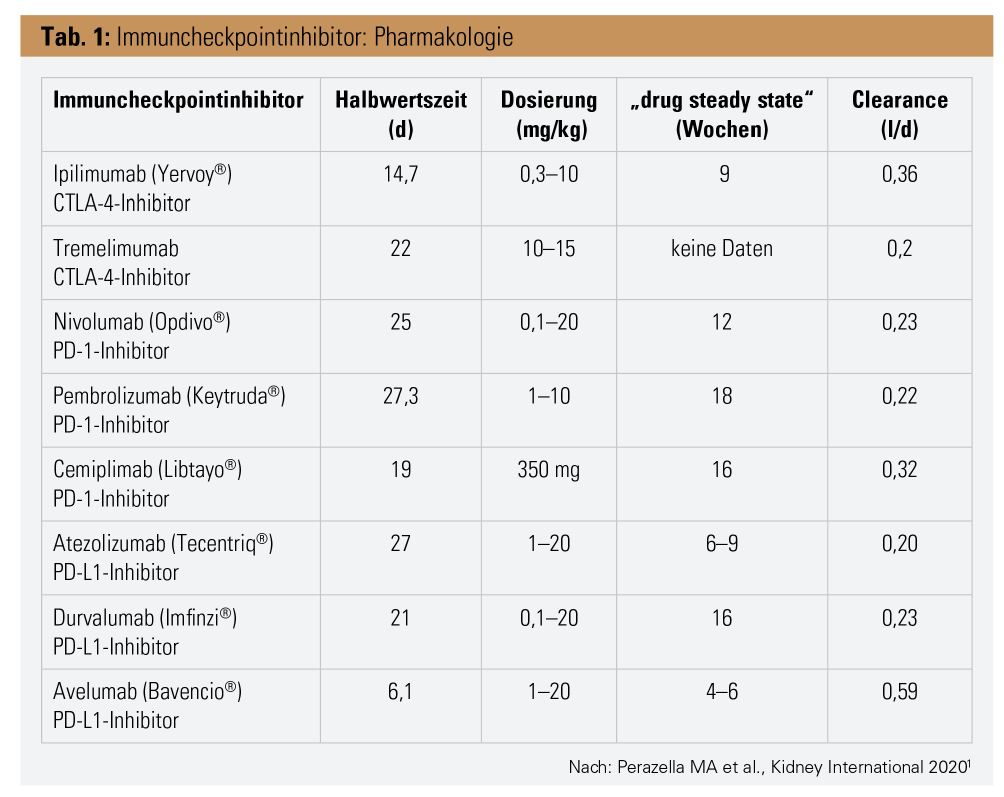
Pharmakokinetik der ICPIs
ICPIs werden nicht via Leber oder Nieren eliminiert, sondern durch Proteolyse im Plasma und im Zielgewebe nach rezeptormediierter Endozytose, weswegen keine Dosisanpassung auch bei Leber- oder Nierenfunktionsstörung notwendig ist.
Eine große Tumormasse ist mit einer erhöhten Clearance des Antikörpers assoziiert, die aber auch rückläufig ist, wenn der Tumor eradiziert wurde. ICPIs haben auch eine lange Halbwertszeit, was längere Dosierungsintervalle erlaubt und auch der Grund dafür ist, dass immunologische Nebenwirkungen erst innerhalb von Wochen bis Monaten nach der Exposition auftreten können. Nach der intravenösen Administration haben die ICPIs gleich wie andere monoklonale Antikörper ein kleines Verteilungsvolumen (4–7 l bei 80 kg Körpergewicht), weil sie sich hauptsächlich intravaskulär verteilen. Bei Auftreten einer hochgradigen nichtselektiven Proteinurie könnte es theoretisch zu einer verminderten Effizienz der ICPIs durch Verlust über den Harn kommen. Eine selektive Albuminurie sollte das nicht beeinflussen.
ICPI-mediiertes akutes Nierenversagen
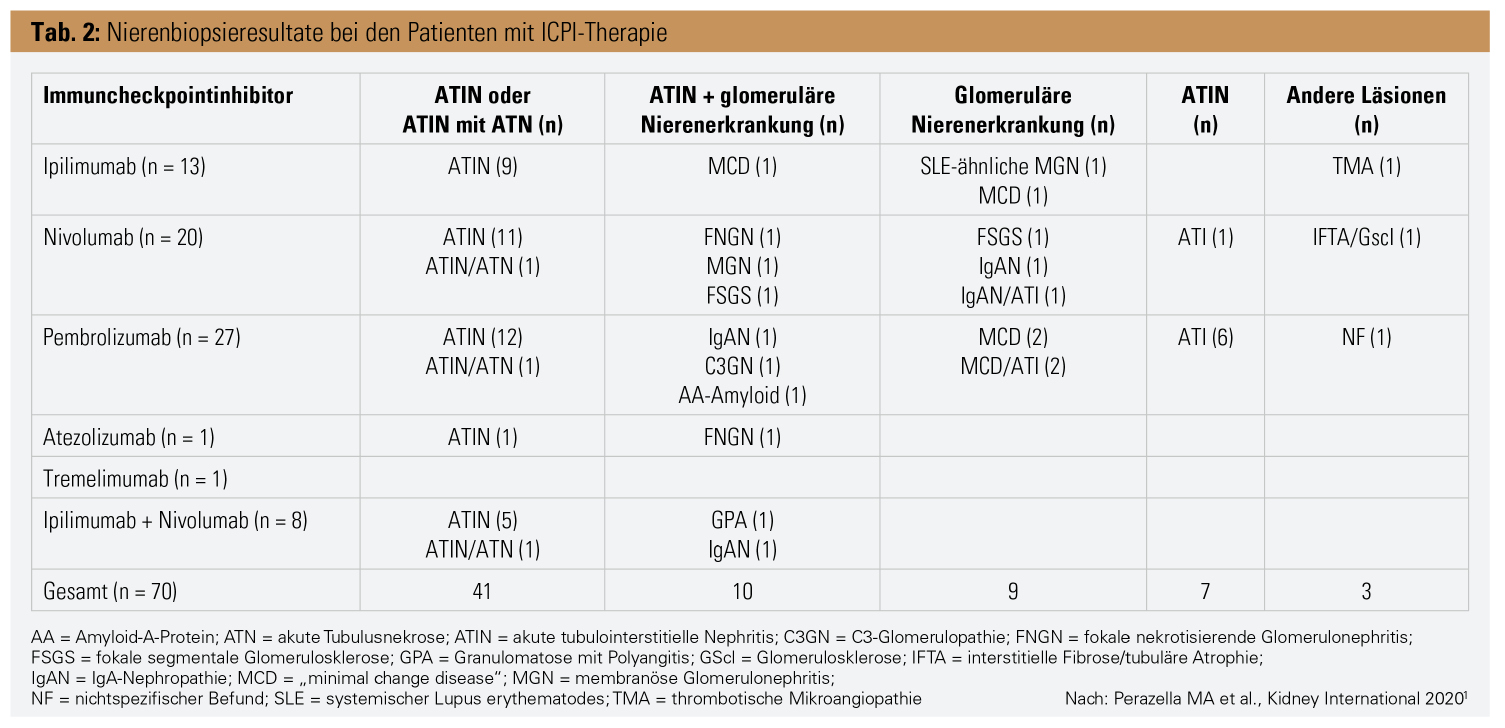
Ein akutes Nierenversagen (AKI) auf Grund einer akuten tubulointerstitiellen Nephritis (ATIN) entweder allein oder in Kombination mit anderen Nierenschädigungen wie akuter Tubulusnekrose (ATN) oder glomerulären Veränderungen ist die häufigste renale Komplikation. Eine kleine Anzahl von isolierten Fällen weisen nur ATN und glomeruläre Läsionen auf.
Die Literatur zum Auftreten von AKI bzw. akuter interstitieller Nephritis umfasst hauptsächlich Fallbeschreibungen oder auch Fallserien von verschiedenen ICPIs – wie in Tabelle 2 angegeben. Das Auftreten einer dialysepflichtigen Niereninsuffizienz ist eher selten. Bei verschiedenen Fällen kann nicht unterschieden werden, ob die interstitielle Nephritis von bekannten Substanzen wie Protonenpumpeninhibitoren (PPIs) oder nichtsterodialen Antirheumatika oder verschiedenen Antibiotika ausgelöst wird. Daher ist eine bioptische Diagnosesicherung gefolgt von einer entsprechenden Therapie als mehr als sinnvoll anzusehen. Eine rezente größere Arbeit aus den USA, die insgesamt 138 Patienten mit ICPI-assoziiertem AKI inkludierte, zeigte, dass die meisten Patienten eine subnephrotische Proteinurie aufwiesen und die Hälfte eine Pyurie. Extrarenale immunmediierte Nebenwirkungen traten bei 43 % der Patienten auf, 69 % nahmen zusätzlich potenzielle tubulointerstitielle nephritisauslösende Medikamente wie zum Beispiel PPIs. Gleichzeitiges Auftreten einer tubulointerstitielle Nephritis war die in den Biopsien häufigste Variante (bei 93 % von 60 biopsierten Patienten). Davon wurden 86 % der Patienten mit Steroiden behandelt. Eine komplette oder partielle Remission wurde bei 85 % der Patienten gesehen, bei 50 % kam es zu keiner kompletten Wiederherstellung der Nierenfunktion. Gleichzeitig auftretende extrarenale Immunphänomene waren mit einer schlechteren renalen Prognose assoziiert, während gleichzeitig tubulointerstitielle Nephritis auslösende Medikamente und die Behandlung mit Steroiden mit einer verbesserten renalen Prognose assoziiert waren. Wenn es zu keiner Wiederherstellung der Nierenfunktion nach ICPI-assoziiertem akutem Nierenversagen kam, war dies unabhängig davon mit einer höheren Mortalität assoziiert. Bei 22 % der Patienten wurden trotz AKI ICPIs wiederverwendet, von denen wiederum 23 % ein AKI entwickelten. Es sei an dieser Stelle auch noch angemerkt, dass bei Nierentransplantierten in der Anwendung Vorsicht geboten ist. Es konnte in Fallberichten gezeigt werden, dass es bei der Therapie mit ICPIs in 20 % der Fälle zu akuten Abstoßungen kam.
Zusammenfassung
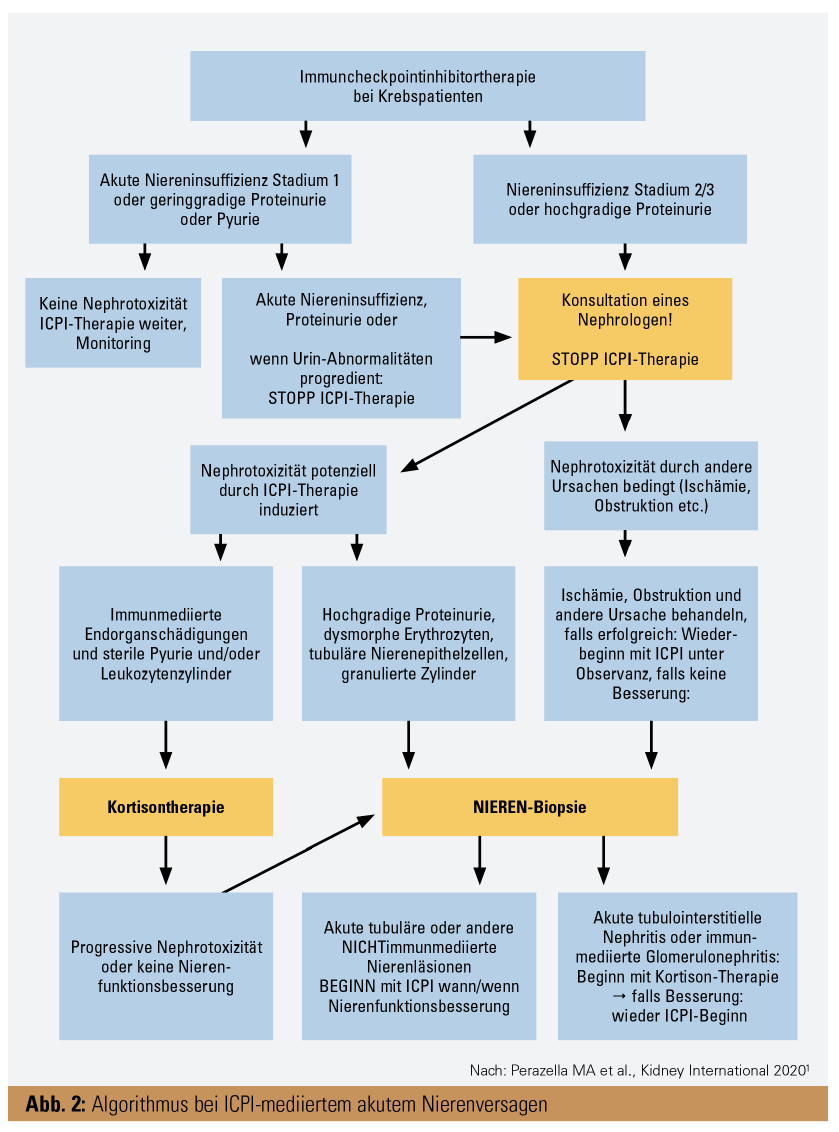
Trotz fehlender Daten, aber auf Grund der bekannten Pharmakokinetik, geht man davon aus, dass keine Dosismodifikation bei Patienten mit Niereninsuffizienz notwendig ist. Vorsicht ist bei der ICPI-Therapie bei Patienten mit präexistierender Autoimmunerkrankung geboten, wo es zu einem Wiederauftreten der Erkrankung kommen kann (bis zu 50 % und mehr), und bei Nierentransplantierten (akute Abstoßung in 20 % der Fälle). Um die Nierenkomplikation definitiv zu diagnostizieren und eine potenzielle Therapie einzuleiten, ist in vielen
Fällen eine Nierenbiopsie notwendig (Abb. 2). Die häufigste Komplikation ist akute tubulointerstitielle Nephritis. In diesem Fall wird Absetzen der ICPIs und der Beginn mit Kortisontherapie vorgeschlagen. Eine Entscheidung, ob der Patient mit einem ICPI reexponiert werden soll, ist mit diesem und in einer multidisziplinären (Nephrologe und Onkologe) Diskussion zu treffen.