Primärer Hyperaldosteronismus
Die kardiovaskuläre Endokrinologie ist eine aufstrebende Disziplin, die sich mit den kardialen und vaskulären Auswirkungen dysregulierter endokrinologischer Systeme auseinandersetzt. Ein alarmierender WHO-Bericht aus dem Jahr 2002 rückte die arterielle Hypertonie als weltweit dritthäufigste Todesursache zunehmend in den Fokus der kardiovaskulären Endokrinologie. Die enorm hohe Prävalenz des absoluten (und relativen) Aldosteronexzesses unterstreicht die Bedeutung des „silent killers“ Aldosteron als Risikofaktor der arteriellen Hypertonie und der kardiovaskulären Herzerkrankung in der Bevölkerung.
Definition des PHA
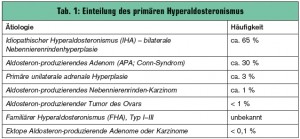
Der primäre Hyperaldosteronismus (PHA) ist durch eine inadäquat gesteigerte Aldosteronproduktion und -wirkung, die relativ autonom vom Renin-Angiotensin-System (RAS) und nicht durch Kochsalzzufuhr supprimierbar ist, charakterisiert. PHA ist mit seinen kardiovaskulären Komplikationen sowohl eine Domäne der Kardiologie als auch der Endokrinologie. Bereits 1954 konnte J. W. Conn bei einer 34-jährigen Frau mit langjähriger therapieresistenter arterieller Hypertonie, Hypokaliämie und metabolischer Alkalose erstmals einen PHA nachweisen. Nach der operativen Entfernung eines 4 cm großen Aldosteron-produzierenden Nebennierenadenoms („Conn-Syndrom“) kam es zu einer raschen Normalisierung des Blutdrucks und der metabolischen Veränderungen. Eine ätiologische Einteilung des PHA zeigt die Tab. 1.
Die Detektion und spezifische Therapie des PHA sind entscheidend, um Organkomplikationen des absoluten Aldosteronüberschusses zu vermeiden. Milliez P. et al. (J Am Coll Cardiol 2005) dokumentierten, dass verglichen mit alters-, geschlechts- und blutdruckgematchten PatientInnen mit einer primären essenziellen Hypertonie jene mit einem PHA ein signifikant höheres Risiko für einen Schlag anfall (3,4 % vs. 12,9 %), Myokardinfarkt (0,6 % vs. 4 %) und Vorhofflimmern (0,6 % vs. 7,3 %) aufweisen. Zudem weisen weitere aktuelle Untersuchungen auf einen massiven Einfluss des relativen Aldosteronüberschusses im Sinne einer inadäquat erhöhten, jedoch nicht autonomen Aldosteron-Konzentration und Aldosteron-Renin- Ratio (ARR) auf die Entwicklung und Progression des arteriellen Bluthochdrucks und kardiovaskulärer sowie renaler Schädigungen hin. In der Ludwigshafen Risk and Cardiovascular Health Study (LURIC; Tomaschitz A. et al., J Am Coll Cardiol und Eur Heart J 2010) konnte eindrucksvoll gezeigt werden, dass die ARR neben dem Alter der stärkste Prädiktor des arteriellen Blutdrucks ist. Zudem ist Aldosteron – im physiologischen Normbereich gelegen – mit einem deutlich erhöhten Risiko für kardiovaskuläre Mortalität assoziiert.
Frühe epidemiologische Studien schätzten die Prävalenz des PHA auf < 1 % bei Bluthochdruckpatienten – dabei galt eine Hypokaliämie als Conditio sine qua non des PHA. Nachfolgende Analysen zeigten jedoch, dass eine Hypokaliämie nur in ca. einem Drittel aller PHAFälle zu beobachten ist. Nach Einführung der ARR als Screeningmethode des PHA (siehe unten) durch Hiramatsu K. et al. (Arch Intern Med 1981) wurde der PHA häufiger detektiert, sodass die Prävalenz bei arterieller Hypertonie derzeit auf 5–13 % und bei therapieresistenter Hypertonie auf bis zu 23 % geschätzt wird. Damit stellt der PHA eine weltweite Herausforderung für das Gesundheitssystem dar. Unter einer konservativen Schätzung dürften rund 80.000 bis 300.000 ÖsterreicherInnen von dieser Erkrankung betroffen sein. An der University of Texas Southwestern Medical School (Dallas, USA) konnten Richard Auchus et al. in einem Zeitraum von 10 Jahren 250 PHA-Fälle detektieren. Geht man von davon aus, dass rund 20–30 % der lokalen Bevölkerung eine arterielle Hypertonie aufweisen (und davon 5–13 % durch einen PHA bedingt ist), dann würden (aufgrund der detektierten Zahl der PHA) die meisten PHA-Fälle unerkannt bleiben. Da der idiopathische Hyperaldosteronismus (IHA) mit dem so genannten Niedrig-Renin- Hypertonus (NRH) ein Kontinuum darstellt und eine partielle Abhängigkeit der Aldosteronproduktion von Renin bestehen bleibt, sollte man zwischen IHA und dem Aldosteron-produzierenden Adenom (APA) – bei dem die Regulationsfähigkeit durch Renin verloren geht – differenziert werden. Mehrere Studien zeigten, dass Patienten mit einem therapieresistenten Bluthochdruck häufig (zu ca. 60 %) einen NRH aufweisen. Durch das derzeitige Fehlen einer gültigen internationalen Nomenklatur zur Charakterisierung der Nebennierenadenome werden unterschiedliche Prävalenzzahlen der adrenalen Inzidentalome (1,0–8,7 %) berichtet. Gerade im Bereich der PHA-Diagnostik herrscht keine Einigkeit über die Charakterisierung von APA, sodass zum Teil auch mikronoduläre Veränderungen als Adenom registriert werden.
Screening mit der Aldosteron-Renin-Ratio
Das Screening mit der ARR darf nicht unkritisch durchgeführt werden, da zum einen die Aldosteronsekretion neben dem Renin-Angiotensin- System durch zahlreiche weitere Faktoren (z. B. Kalium, Kalzium, Parathormon, adrenokortikotropes Hormon [ACTH], Fettsäuren) beeinflusst wird; zum zweiten wird die ARR durch zahlreiche Faktoren (z. B. Tageszeit, Kochsalzzufuhr, Antihypertensiva wie ACE-Hemmer oder Diuretika) beeinflusst, was ebenfalls zu falsch-positiven oder negativen Screeningergebnissen führen kann.
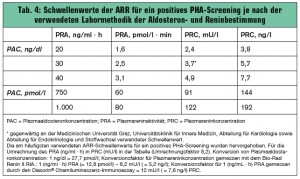
Die aktuell gültigen Richtlinien der Endocrine Society (2008) empfehlen ein Screening des PHA in Risikogruppen mit bekannt hoher Prävalenz des PHA unter der Einhaltung bestimmter Vorbedingungen (tab. 2 und 3). Da der bilaterale idiopathische PHA mit den NRH ein Kontinuum darstellt und für die Bestimmung von Aldosteron (aus Serum oder Plasma) und Renin (Aktivität oder Konzentration aus Plasma) unterschiedliche Labormethoden bestehen, gibt es derzeit keinen einheitlich gültigen Cut-off-Wert der ARR für ein positives Screening (tab. 4). Für die Berücksichtigung eines Schwellenwertes der absoluten Aldosteronkonzentration zusätzlich zu einer erhöhten ARR gibt es derzeit ebenso keine eindeutige Empfehlung, obwohl dies möglicherweise eine bessere Abgrenzung eines PHA von einem NRH ermöglichen würde. Die meisten Experten empfehlen aber zumindest eine Aldosteronkonzentration von 9 (bis 15) ng/dl als Minimalkonzentration für einen PHA. Zur Bestimmung der Aldosteron- und Reninkonzentration (-aktivität) sollten nach internationalen Richtlinien aufgrund der Gefahr falsch-positiver/-negativer Screeningergebnisse ausschließlich validierte Labormethoden verwendet werden! Da eine starke Abhängigkeit der ARR von der Variabilität der gemessenen Reninkonzentration besteht, ist die Messgenauigkeit bei der Bestimmung der Plasmareninkonzentration gerade im niedrigen Bereich (auch zur Differenzierung zwischen einem PHA und einem NRH) entscheidend. Diesbezüglich zeigt die auf Chemilumineszenz basierende direkte Bestimmung der Plasmareninkonzentration von Diasorin (Liaison®, www.diasorin.it) eine erstaunliche Mess genauigkeit bis zu einer Plasmareninkonzentration von < 2 mU/l.
Bestätigung des PHA: Derzeit gibt es entsprechend den internationalen Richtlinien keinen Goldstandard für die Bestätigung des PHA. Grundsätzlich stehen vier Testmethoden für die Bestätigung des PHA zur Verfügung:
• oraler Kochsalzbelastungstest
• intravenöser Kochsalzbelastungstest
• Fludrocortison-Hemmtest
• Captopril-Test
Die Wahl der Testmethode richtet sich gegenwärtig nach den Kosten, der Patienten-Compliance, der Laborexpertise und der lokalen klinischen Expertise. Derzeit wird von dem meisten Zentren im deutschsprachigen Raum der i. v. Kochsalzbelastungstest favorisiert, wohingegen insbesondere der Captopril-Test aufgrund weniger guter Testcharakteristika in den Hintergrund gedrängt wurde. Grundsätzlich sollte die Bestätigung eines PHA an einem erfahrenen Zentrum erfolgen.
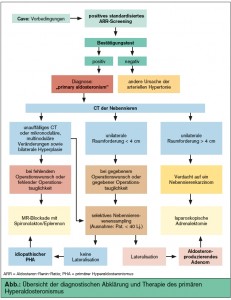
Eine Klassifizierung des PHA-Subtyps im Falle einer Bestätigung eines PHA sollte eingeleitet werden (Tab. 1). Dabei wird die Durchführung einer CT-Untersuchung der Nebennieren empfohlen (mehrere Studien konnten keinen Vorteil hinsichtlich Spezifität und Sensitivität der MRT-Untersuchung in der Detektion von APA nachweisen). Ingesamt ergeben sich jedoch bei der Beurteilbarkeit der CT-Untersuchung zahlreiche Einschränkungen. So können kleinere APA meist nur schwer von einer bilateralen IHA differenziert werden; zudem können hormonell inaktive unilaterale Makroadenome (die zunehmend ab dem 40. Lebensjahr auftreten) von APA nicht differenziert werden. Nur 25 % der APA < 1 cm können im CT detektiert werden. Wichtige Informationen kann das CT vor allem durch die Detektion größerer adrenaler Tumoren (> 2,5 cm) liefern, wobei bei Nachw eis einer adrenalen Raumforderung > 4 cm auch die Möglichkeit eines Nebennierenkarzinoms in Betracht gezogen werden soll.
Ausschluss einer kardiovaskulären und renalen Schädigung: Nach dem Nachweis eines PHA sollte auch eine ausführliche Abklärung möglicher kardiovaskulärer und renaler Schäden (mittels transthorakaler Echokardiografie, Ergometrie und ggf. Myokardszintigrafie, Ultraschall der Karotiden und Über- prüfung der Harn eiweißausscheidung) initiiert werden.
Der Nachweis einer lateralisierten Aldosteronüberproduktion erfolgt ausschließlich durch ein selektives Nebennierenvenensampling (adrenales Venensampling – AVS) und ist für das weitere Management der Betroffenen essenziell. Sollte jedoch grundsätzlich kein Operationswunsch oder keine Operationstauglichkeit gegeben sein oder durch die CT-Untersuchung bei einem PHA-Patienten unter dem 40. Lebensjahr eindeutig ein Adenom der Nebenniere bei bestätigtem PHA nachweisbar sein, ist die AVS nicht indiziert.
Derzeit können drei verschiedene Protokolle des AVS zur Anwendung kommen:
• unstimulierte sequenzielle oder bilateral simultane AVS
• unstimulierte, sequenzielle oder simultane bilaterale AVS nach i. v. Bolus-Stimulation durch ACTH (Consyntropin)
• AVS unter kontinuierlicher Consyntropin- Stimulation bei sequenzieller bilateraler AVS)
Die Untersuchung ist invasiv, technisch herausfordernd, kostenaufwändig (die durchschnittlichen Kosten einer AVS an europäischen Zentren liegen bei 1.750 Euro) und fehleranfällig. Die Erfolgsrate liegt gemäß einer kürzlich publizierten großen retrospektiven Analyse zwischen 31 % und 61 %. Die Komplikationsrate liegt je nach Erfahrenheit des durchführenden Radiologen bei 0,6 % (Ruptur einer Nebennierenvene und/oder Nebennierenblutungen). Auch durch eine unterschiedlich weite Insertion des Katheters in die Nebennierenvenen, durch anatomische Venenanomalien und durch Fluktuationen der Aldosteronkonzentration (und Kortisolkonzentration) können falsch-positive und falsch-negative Ergebnisse der AVS resultieren. Schließlich liegen derzeit keine international gültigen Schwellenwerte für eine Lateralisation der Aldosteronproduktion vor, sodass je nach Zentrum von einer unterschiedlichen Prävalenz des lateralisierenden PHA berichtet wird. Aufgrund der ähnlichen Langzeitdaten hinsichtlich der protektiven Effekte der Adrenalektomie und der Mineralokortikoid- Rezeptor-(MR)-Blockade sollte sowohl die Indikationsstellung als auch die Interpretation der Lateralisation mit Zurückhaltung erfolgen.
Therapie
Bei Vorliegen eines unilateralen PHa ist entsprechend den aktuellen internationalen Richtlinien die laparoskopische unilaterale (partielle) Adrenalektomie Therapie der 1. Wahl. Nach der operativen (partiellen) Resektion der entsprechenden Nebenniere kommt es in 59–100 % der Fälle zu einer Besserung der Blutdruckund metabolischen Situation (Kurationsrate: ca. 38–42 %). In erfahrenen Zentren liegt bei einer durchschnittlichen stationären Aufenthaltsdauer von 3 Tagen die Morbidität einer laparoskopischen Adrenalektomie bei 5–14 % (z. B. intra- und postoperative transfusionspflichtige Blutungen) und die Mortalität bei < 1 %. Eine kleinere kanadische Studie wies darauf hin, dass die operative Therapie des PHA im Vergleich zu medikamentösen Therapie bis zu einem Zeitraum von 97 Monaten kosteneffektiver erscheint. Bei Vorliegen eines bilateralen PHa oder fehlendem Operationswunsch bzw. fehlender Operationstauglichkeit sollte unbedingt eine MR-Blockade eingeleitet werden. Dabei ist die kardiovaskuläre und renale Protektivität der MR-Blocker- Therapie bei PHA-PatientInnen vergleichbar mit jener der Adrenalektomie. Die Therapie mit Spironolakton sollte mit 12,5–25 mg 1-mal täglich eingeleitet und unter regelmäßiger Kontrolle der Nierenfunktion und des Serumkaliumspiegels (cave: Hyperkaliämie) je nach Therapieansprechen adaptiert werden. Insgesamt ist gemäß zahlreichen Interventionsstudien das Risiko einer Hyperkaliämie unter einer MR-Blockade mit Spironolakton oder Eplerenon unter regelmäßigem Monitoring des Serumkaliumspiegels und der Nierenfunktion und bei Bedachtnahme einer zusätzlichen Hyperkaliämie-induzierenden Pharmakotherapie gering.
Bei Unverträglichkeit oder Auftreten von spironolaktonspezifischen Nebenwirkungen (ca. 2–9 % z. B. Gynäkomastie oder Libidoverlust) sollte eine Therapieumstellung auf Eplerenon (Startdosis: 25 mg/Tag) erfolgen. Ein Headto- Head-Vergleich ergab, dass Spironolakton und Eplerenon hinsichtlich des blutdrucksenkenden Effekts bei essenzieller Hypertonie und PHA ebenbürtig sind.
Bisher fehlen Studien, die eine Besserung der Lebensqualität sowie Reduktion der Mortalität durch die Adrenalektomie – auch im Head-to- Head-Vergleich mit einer MR-Blockade – im Rahmen eines PHA nachweisen. Jedoch konnten Studien mit kleinerer Fallzahl einen mit der Adrenalektomie vergleichbaren Effekt einer MR-Blockade auf die Blutdrucksenkung und Änderung der Serumkaliumspiegels bei PatientInnen mit einem APA nachweisen. Eine kürzlich publizierte retrospektive Analyse von PHA-PatientInnen dokumentierte eine Blutdrucksenkung bei 42 % durch die Adrenalektomie und bei 37 % durch eine MR-Blockade. Gegenwärtig scheint daher der kardiovaskuläre, renale und metabolische Benefit einer MRBlockade vergleichbar mit jener der Adrenalektomie. Angesichts der hohen Dunkelziffer undetektierter PHA-Fälle rückt die MR-Blockade als wirkungsvolle antihypertensive Alternative zunehmend in den Vordergrund.
Derzeit liegen für den europäischen Raum keine verlässlichen Kosten-Nutzen-Aufstellungen sowohl für das diagnostische Prozedere der PHA-Abklärung als auch für das Management nach Diagnosestellung eines PHA vor. Zudem fehlen weiterhin prospektive Analysen, die den Nutzen der diagnostischen Abklärung und die daraus resultierende PHA-spezifische Therapie in Hinblick auf die Sterblichkeit erfassen.
SCHLUSSFOLGERUNGEN: Metaanalysen wiesen auf den potenziellen Nutzen einer Low-Dose- MR-Blockade (12,5–25 mg) als wirkungsvolle antihypertensive Therapie hin. Es zeigte sich, dass die Kombination eines MR-Blockers mit einem RAS-Blocker effektiver den Blutdruck senkt als die duale RAS-Blockade. Auch höhere Dosierungen der MR-Blockade, z. B. mit Eplerenon (nach entsprechender Dosistitration und unter regelmäßigem Monitoring der Nierenfunktion und des Serumkaliumspiegels), sind eine relativ sichere antihypertensive Therapiestrategie, solange Indikationen/Kontraindikationen beachtet werden und ein entsprechendes Monitoring potenzieller Nebenwirkungen (z. B. Hyperkaliämie) erfolgt. Zusätzlich werden durch eine MR-Blockade auch blutdruckunabhängige kardio-, vaso- und renoprotektive Effekte erzielt. Die Umsetzung der aktuellen Richtlinien würde bei einer geschätzten Prävalenz des PHA von 5–13 % aller hypertensiven Patienten durch die aufwändige Diagnostik bei bestätigtem PHA zu einer erheblichen Belastung des Gesundheitssystems bzw. der auf PHA-Abklärung spezialisierten Zentren führen. Derzeit profitieren vor allem jene Personen von der PHADiagnostik, die durch die betreuenden ÄrztInnen mit einem entsprechenden Bewusstsein für diese Erkrankung nach dem Screening durch Überweisung an ein spezialisiertes Zentrum initiiert werden können. Die neue Herausforderung PHA wird in Zukunft eine engere Zusammenarbeit der Kardiologie und Endokrinologie notwendig machen, um eine Optimierung der Detektion und des Managements dieser Erkrankung zu erzielen.
Literatur bei den Verfassern