Update 2012 – Medikamentöse GIST-Therapie
Metastasierte Erkrankung
Gastrointestinale Stromatumoren (GIST) sind die häufigsten mesenchymalen Tumoren des Gastrointestinaltraktes mit einer Häufigkeit von circa 10 Neuerkrankungen pro 1 Million Einwohner pro Jahr. 1 Mutationen von KIT und (allerdings seltener) von PDGFRA triggern die Entstehung von GIST. 30–50 % der initial operierten GIST-PatientenInnen rezidivieren innerhalb von 5 Jahren, wobei die Hochrisikopatienten sogar früher rezidivieren.2
Imatinib ist die Standarderstlinientherapie beim metastasierten GIST. Während bei den meisten Patienten eine Dosis von 400 mg/Tag Standard ist, benötigen Patienten mit einer KIT-Exon-9-Mutation 800 mg/Tag. Bei Krankheitsprogression unter 400 mg Imatinib sollte die Dosis auf 800 mg/Tag eskaliert werden. Bei Progress unter 800 mg Imatinib/Tag ist Sunitinib die Standardzweitlinientherapie. Durch diese Therapien ist es gelungen, das mediane Überleben nahezu zu verdreifachen, d. h. auf derzeit fast 5 Jahre zu verlängern.3 Patienten mit einer geringeren Tumorlast haben einen besseren Langzeitverlauf.4 Die Rationale, Imatinib in der adjuvanten Therapiesituation zu testen, war aufgrund der substanziellen Wirkung im metastasierten Stadium naheliegend.
Adjuvante Therapie mit Imatinib
Mittlerweile gibt es drei große, randomisierte, adjuvante Phase-III-Studien, wobei Ergebnisse von zwei Studien bereits vorliegen: ACOSOGZ9001 und SSG-XVIII/AIO.5–8
ACOSOG-Z9001: Die placebokontrollierte ACOSOG- Z9001-Studie bewies durch die einjährige adjuvante Therapie mit Imatinib (400 mg/Tag) eine statistisch signifikante Verlängerung des rezidivfreien Überlebens (RFS; 98 % versus 83 %). Eine Subgruppenanalyse nach Mutationsstatus zeigte, dass PatientenInnen mit Exon-11- und PDGFRA-Mutation (exclusive D842V!) eine statistisch signifikante RFSVerlängerung hatten, nicht aber jene mit Wildtyp oder Exon-9-Mutation.
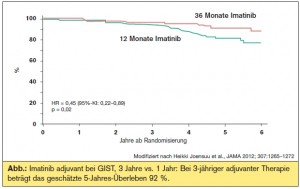
SSG-XVIII/AIO: Die SSG-XVIII/AIO-Studie verglich eine dreijährige adjuvante Imatinib-Therapie (400 mg/Tag) mit einer einjährigen adjuvanten Imatinib-Therapie (400 mg/Tag) bei Hochrisiko- GIST-PatientInnen. Das 5-Jahres-RFS (66 % vs. 48 %) sowie das 5-Jahres-Gesamtüberleben (92 % vs. 82 %) waren zu Gunsten der dreijährigen Therapie statistisch signifikant verlängert. (> Abb.) Gemäß der Hazard Ratio konnte eine mehr als 50%ige Reduktion tödlicher Ereignisse im „Dreijahres-Arm“ versus dem „Einjahres-Arm“ erreicht werden.
Was ist ein Hochrisikopatient?
Folgende Klassifikationen sollten dafür verwendet werden: AFIP-Miettinen (Risikostratifikation primärer GIST nach Mitoseindex, Größe und Lokalisa tion)9 oder modifiziertes NIH-Joensuu (National Institute of Health, Konsensuskonferenz)10 oder Gold-Nomogramm11.
Eine Mutationsanalyse wird dringend empfohlen falls eine adjuvante Imatinib-Therapie zur Diskussion steht:
• bei Exon-9-Mutation könnte z. B. überlegt werden, ob Imatinib auf 800 mg/d eskaliert wird (wenngleich es diesbezüglich nur Daten in der metastasierten Erkrankung gibt)
• die D842V-Mutation gilt als Imatinibresistent
Eine intraoperative Tumorruptur mit peritone – aler Kontamination ist ziemlich sicher mit einem zeitnahen Rezidiv verbunden, sodass hier definitiv eine mehr als dreijährige Therapie empfohlen wird. Wenn eine peritoneale Kontamination angenommen wird, kann eine Fernmetastasierung angenommen werden, die mit keiner zeitlichen Begrenzung der Therapie einhergeht.
Zusammenfassung Imatinib (400 mg/Tag) für 3 Jahre ist der neue adjuvante Therapiestandard für PatientenInnen mit signifikantem Rezidivrisiko.
FACT-BOX
• GIST ist eine orphan disease
• Die jährliche Neuerkrankungsrate liegt bei 10/1 Million. D. h., es gibt jährlich ca. 85 Neuerkrankungen in Österreich.
• Die Hälfte der PatientInnen ist durch eine alleinige Operation geheilt. Die Hälfte der PatientInnen braucht eine medikamentöse Therapie.
• Eine 3-jährige adjuvante Therapie mit Imatinib 400 mg/Tag ist der Goldstandard bei PatientInnen mit signifikantem Rezidivrisiko nach Resektion des Primärtumors.
1 Miettinen M. et al., Arch Pathol Lab Med 2006; 130:1466-1478
2 Nilsson B. et al., Cancer 2005; 103:821-829.
3 Blanke C.D. et al., J Clin Oncol 2008; 26:620-625
4 Blesius A. et al., ASCO Meeting Abstracts 2011; 29:10048
5 Dematteo R.P. et al., Lancet 2009; 373:1097-1104
6 Corless C.L. et al., 2010 ASCO Annual Meetin g Proceedings (Post-Meeting Edition). 2010; 28:10006
7 Blackstein M.E. et al., ACOSOG Z9001. 2010 Gastro – intestinal Cancers Symposium
8 Joensuu H. et al., SSGXVIII/AIO, ASCO Meeting Abstracts 2011; 29:LBA1
9 Miettinen M. et al., Semin Diagn Pathol 2006; 23:70-83
10 Rutkowski P. et al., Eur J Surg Oncol 2011; 37:890-896
11 Gold J.S. et al., Lancet Oncol 2009; 10:1045-1052