Diagnose und Therapie eines häufigen Problems
Unter einem gastroduodenalen Ulkus versteht man einen Gewebedefekt im Magen oder Duodenum, der tiefer als bis zur Lamina muscularis mucosae reicht. Handelt es sich nur um eine oberflächliche Läsion, bei der die Lamina muscularis mucosae intakt ist, so spricht man definitionsgemäß von einer Erosion.
Epidemiologie und Ätiologie
Die gastroduodenale Ulkuskrankheit stellt nach wie vor weltweit ein bedeutendes medizinisches und gesundheitsökonomisches Problem dar. Die Inzidenz unkomplizierter gastroduodenaler Ulzera in der Allgemeinbevölkerung wird auf 1 pro 1.000, die Inzidenz komplizierter Ulzera auf 0,7 pro 1.000 Personen-Jahre geschätzt, wobei die Inzidenz entscheidend von der Prävalenz von Helicobacter pylori in der Bevölkerung abhängt. Bei H.-pylori-infizierten Personen ist das Risiko der Entwicklung eines Ulkus im Vergleich zu nichtinfizierten Menschen um das 6–10-Fache erhöht.
Die meisten gastroduodenalen Ulzera werden entweder durch die Einnahme von NSAR oder eine Infektion mit H. pylori verursacht. Dabei kann man sich die Ulkuspathogenese als einen zweistufigen Prozess vorstellen: Zunächst wird die Schleimhaut durch NSAR oder eine H.-pylori-Infektion vorgeschädigt. In weiterer Folge kann dann Magensäure in tiefere Wandschichten eindringen und relevante Gewebedefekte verursachen. Seltene Ursachen gastroduodenaler Ulzera umfassen unter anderem Tuberkulose, Sarkoidose, Morbus Crohn, Ischämie und Zollinger-Ellison-Syndrom.
H. pylori und Ulkuspathogenese
Etwa 50 % der Weltbevölkerung sind mit H. pylori infiziert, wobei die Prävalenz stark variiert und vom Lebensstandard bzw. von den Hygienebedingungen abhängt. Die meisten Übertragungen erfolgen während der frühen Kindheit, Infektionen im Erwachsenenalter werden nur selten beobachtet. Der Übertragungsweg ist fäkal-oral oder oral-oral. Nach der Infektion kommt es zunächst zur Besiedelung der Schleimhaut des Magenantrums, wo sich eine Gastritis vom Typ B entwickelt. Bei einem Teil der Patient:innen (bevorzugt bei jenen mit relativ niedriger Magensäureproduktion) kommt es im Laufe von Jahren zur Ausbreitung der Infektion in Richtung Kardia und zur Entwicklung einer Pangastritis. Bei anderen Patient:innen (besonders bei jenen mit hoher Magensäureproduktion) kommt es als Reaktion auf die hohe Säureexposition im Duodenum zur Entstehung von gastralen Metaplasien im Bulbus duodeni. Diese gastralen Metaplasien können in weiterer Folge durch H. pylori besiedelt werden; die dadurch induzierte Entzündung stellt den Boden für die spätere Entwicklung von Ulcera duodeni dar. Es wird geschätzt, dass etwa 10 % aller H.-pylori-infizierten Personen im Laufe ihres Lebens gastroduodenale Ulzera entwickeln. Noch deutlich seltener sind andere Komplikationen wie Magenkarzinom und MALT-Lymphom.
Klinische Symptomatik und Komplikationen
Das klassische Symptom der gastroduodenalen Ulkuserkrankung ist ein Schmerz im Epigastrium, der in den rechten Oberbauch oder seltener in den Rücken ausstrahlen kann. Für das Ulcus duodeni ist ein Nüchternschmerz typisch, der 2–5 Stunden nach Nahrungsaufnahme auftritt, wenn Säure ohne gleichzeitige Nahrung in den Bulbus duodeni gelangt. Wichtig ist, zu bedenken, dass bis zu 70 % aller Ulzera klinisch ohne Symptome verlaufen; insbesondere bei NSAR-induzierten Ulzera ist aufgrund der analgetischen Wirkung von NSAR ein asymptomatischer Verlauf sehr häufig. Komplikationen der gastroduodenalen Ulkuskrankheit umfassen Blutung, Penetration, Perforation sowie Magenausgangsstenose. Auch diese Komplikationen werden häufig ohne vorausgehende typische Ulkussymptomatik beobachtet.
Diagnostik
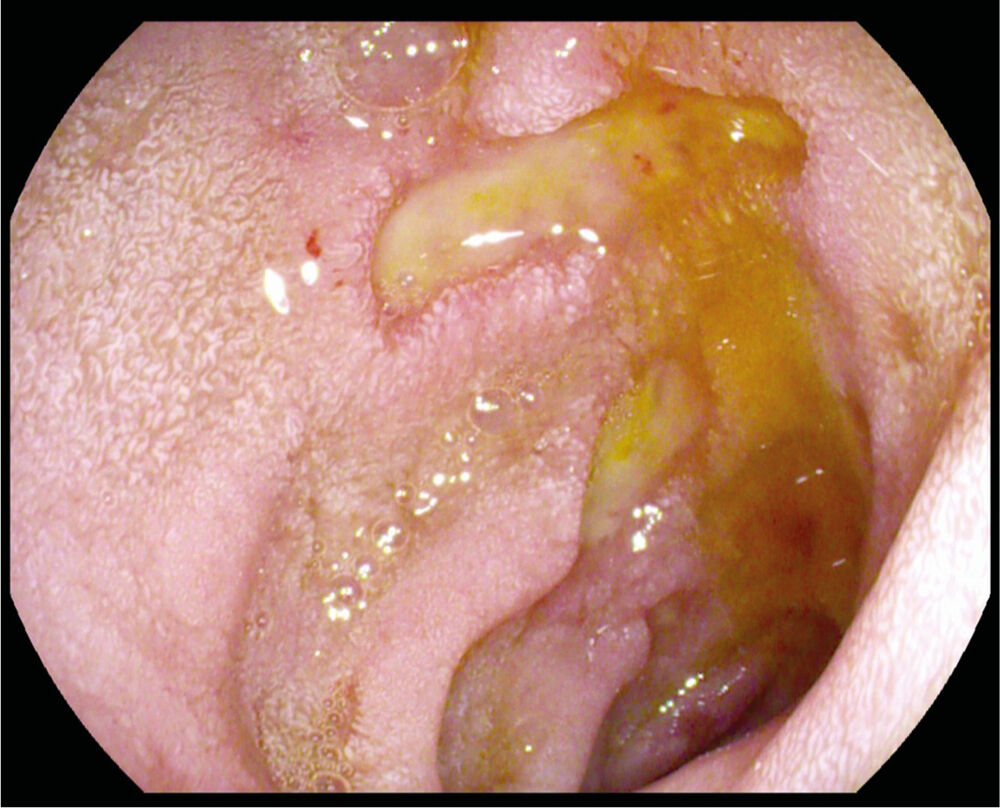
Die Diagnosestellung einer gastroduodenalen Ulkuserkrankung erfolgt in der Regel endoskopisch. Ein Ulcus ventriculi muss unbedingt biopsiert werden, um ein Malignom auszuschließen. Ulcera duodeni (Abb.) müssen bei unverdächtiger Makroskopie nicht biopsiert werden, da Duodenalkarzinome extrem selten sind. Bei jedem/jeder Patient:in mit gastroduodenaler Ulkuserkrankung werden jedoch Biopsien aus der Magenmukosa (zumindest je 2 Biopsien aus Antrum und Korpus) entnommen, um eine zugrunde liegende Gastritis (B-Gastritis bei H.-pylori-Infektion, bzw. C-Gastritis bei NSAR-Einnahme) festzustellen.
Zur Diagnostik einer H.-pylori-Infektion stehen biopsiebasierte Methoden (Histologie, H.-pylori-Kultur, Urease-Schnelltest) und nichtinvasive Methoden (Stuhlantigen-Test, 13C-Atemtest, Serologie) zur Verfügung. Alle genannten Methoden mit Ausnahme der Serologie sind auch zur Verlaufskontrolle nach Eradikationstherapie geeignet. Eine H.-pylori-Diagnostik sollte im Idealfall erst 4 Wochen nach dem Beenden einer Antibiotikatherapie und 2 Wochen nach Absetzen eines Protonenpumpenhemmers (PPI) erfolgen, da ansonsten gehäuft falsch negative Ergebnisse zu erwarten sind.
Therapie der gastroduodenalen Ulkuskrankheit
Alle Patient:innen mit peptischem Ulkus sollten einen PPI in Standarddosierung erhalten; bei Vorliegen von Ulkuskomplikationen sollte initial eine höhere Dosierung (doppelte Standarddosis zunächst i. v., später p. o.) gewählt werden. Die Therapiedauer richtet sich nach den klinischen Charakteristika des Ulkus und beträgt meist zwischen 4 und 12 Wochen. Zusätzlich zur Säuresuppression sollte bei jedem peptischen Ulkus die auslösende Ursache behandelt werden. Diese kausale Therapie besteht beim H.-pylori-induzierten Ulkus in der Durchführung einer Eradikationstherapie. Bei NSAR-induzierten Ulzera sollte die NSAR-Therapie – wenn klinisch vertretbar – beendet werden; ist dies nicht möglich (z. B. wegen gleichzeitig vorliegender rheumatologischer Erkrankungen), so sollte ein PPI zur Ulkusprophylaxe als Dauertherapie verordnet werden.
Kontrollendoskopien beim Ulcus duodeni sind meist nicht indiziert. Im Falle einer H.-pylori-Infektion kann der Erfolg der Eradikationstherapie nichtinvasiv mittels Stuhlantigen-Test oder 13C-Atemtest überprüft werden. Im Gegensatz dazu muss jedes Ulcus ventriculi endoskopisch und bioptisch nachkontrolliert werden, um das Vorliegen eines Malignoms sicher auszuschließen.
Helicobacter-pylori-Eradikationstherapie
Aufgrund der hohen Rate clarithromycinresistenter H.-pylori-Stämme in Österreich (> 20 %) sollen zur H.-pylori-Eradikation keine clarithromycinbasierten Tripeltherapieschemata mehr eingesetzt werden – es sei denn, dass mittels Resistenztestung das Vorliegen einer Clarithromycin-Resistenz ausgeschlossen werden konnte. Bei fehlender Resistenztestung empfehlen aktuelle Guidelines als First-Line-Therapie zur Eradikation von H. pylori eine bismuthbasierte Quadrupeltherapie (bestehend aus Tetrazyklin, Metronidazol, Bismuthsubcitrat und einem PPI) über zumindest 10 Tage. Alternativ kann eine Quadrupeltherapie aus Amoxicillin, Clarithromycin, Metronidazol und PPI über 14 Tage verordnet werden. Bei beiden Regimen liegt die Eradikationsrate bei etwa 90 %.
Bei fehlendem Erfolg der Erstlinientherapie sollte eine Resistenztestung erfolgen und als Zweitlinientherapie eine Tripeltherapie über 14 Tage unter Berücksichtigung des Antibiogramms verabreicht werden. (Bei fehlender Resistenztestung nach Versagen der Erstlinientherapie kann eventuell als Alternative eines der beiden zur Erstlinientherapie empfohlenen Regime eingesetzt werden). Eine Drittlinientherapie soll jedenfalls durch eine:n Spezialist:in nach genauer Resistenztestung erfolgen.