Präzision statt Pauschaltherapie
Morbus Crohn (MC) ist eine chronisch entzündliche Erkrankung des Gastrointestinaltraktes mit komplexer, multifaktorieller Genese. Genetische, immunologische und Umweltfaktoren beeinflussen den Krankheitsverlauf maßgeblich. Charakteristisch ist der segmentale, diskontinuierliche, transmural betonte Entzündungsprozess, der den gesamten Verdauungstrakt betreffen kann. Die Erstbeschreibung erfolgte 1932 durch Crohn, Ginzburg und Oppenheimer. In Österreich liegt die Inzidenz bei 20–25 Neuerkrankungen/100.000 Einwohner:innen jährlich.
Diagnostik: je früher, desto besser!
Eine frühe und präzise Diagnosestellung ist essenziell für ein effektives Management. Sie basiert auf einer ausführlichen Anamnese (Diarrhö, Gewichtsverlust, rechtsseitige Unterbauchschmerzen, Obstipation, Familienanamnese), Laborbefunden (BSG, CRP, Calprotectin im Stuhl) und endoskopischen (Koloskopie und eventuell auch Gastroskopie inkl. Histologie) sowie bildgebenden (Sonografie, Hydro-MRT) Untersuchungen.
Therapie: vom Symptom zur Remission
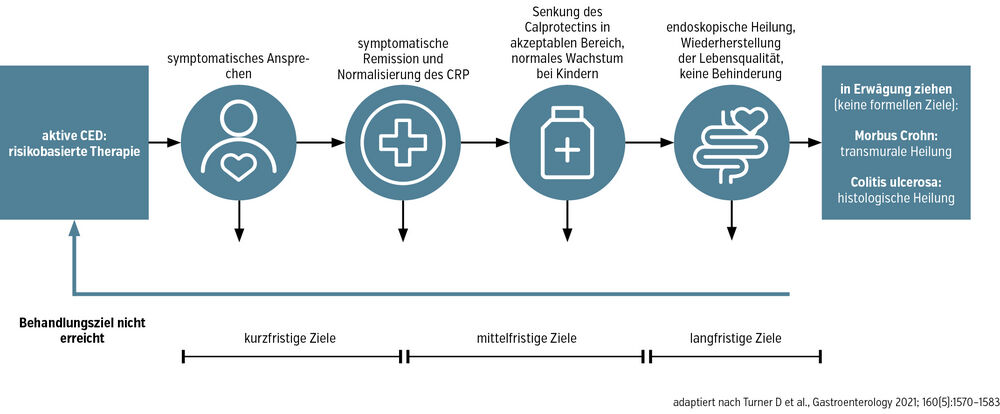
Die moderne Therapie folgt einem personalisierten, zielgerichteten Ansatz, geleitet durch die STRIDE-II-Kriterien (Abb.).
Kurz- und mittelfristige Therapieziele beinhalten die Symptomkontrolle und Steigerung der Lebensqualität innerhalb von Wochen bzw. die Normalisierung des CRP und Calprotectins (klinische Remission) innerhalb von Monaten. Langfristige Therapieziele sind die endoskopische und transmurale Heilung, Steroidfreiheit sowie die OP-Vermeidung. Als Zukunftsvision ist eine histologische Remission ähnlich wie bei Colitis ulcerosa zu nennen.
Risikogruppen (z. B. Raucher:innen, Alter <30Jahre, perianaler Befall) profitieren besonders von einem „Hit hard and early“-Ansatz, und auch Patient:innen mit extraintestinalen Manifestationen sollten frühzeitig interdisziplinär betreut werden.
Therapiestandards 2025
Auch 2025 kommen weiterhin Glukokortikoide zur Einleitung der Remission zur Anwendung. Diese sollten aber möglichst gezielt und kurzfristig eingesetzt werden. Immunmodulatoren, wie z. B. Azathioprin verschwinden mehr und mehr von der Therapieliste und finden eher als Kombinationstherapie bzw. zur Behandlung vereinzelter extraintestinaler Manifestationen ihre Berechtigung.
TNF-a-Inhibitoren. Bewährte Substanzen, die schon lange zum Einsatz kommen, sind Infliximab und Adalimumab. Diese sind auch effektiv bei extraintestinalen Manifestationen, Infliximab vor allem bei fistulierenden Verläufen. Auf Kontraindikationen (latente Tbc, NYHA III–IV) ist zu achten.
Integrin-Antagonisten. Der Integrin-Antagonist Vedolizumab blockiert a4b7-Integrin und wird vor allem beim frühen MC angewendet. Vedolizumab zeichnet sich durch ein sehr gutes Sicherheitsprofil aus, eine subkutane Erhaltungstherapie ist möglich.
IL-12/IL-23-Inhibitoren. Ustekinumab hemmt die p40-Untereinheit von IL-12 und IL-23 und somit die Th1-/Th17-vermittelte Entzündung. Die Substanz zeigt eine gute Wirksamkeit auch bei Versagen von TNF-Blockern und ein günstiges Sicherheitsprofil. Darüber hinaus ist Ustekinumab auch bei extraintestinalen Manifestationen, insbesondere Psoriasis, wirksam.
IL-23-Inhibitoren. Risankizumab bewirkt eine selektive Hemmung von IL-23 und ist durch ein gutes Sicherheitsprofil und eine hohe Wirksamkeit charakterisiert, weshalb eine Gabe sowohl bei biologikanaiven als auch bei -erfahrenen Patient:innen sowie nach Ustekinumab-Vorbehandlung möglich ist.
JAK-Inhibitoren. Upadacitinib hemmt die intrazelluläre JAK-1-abhängige Zytokin-Signaltransduktion. Hierbei handelt es sich um den ersten oralen Wirkstoff bei MC mit schnellem, effektivem Wirkeintritt. Er ist auch bei extraintestinalen Manifestationen und Biologika-Vorbehandlung wirksam. Ein engmaschiges Monitoring (Lipide, Leberfunktion, Infektionen) sowie die passive Herpes-Zoster-Impfung vor Therapiebeginn sind erforderlich.
Gamechanger: Kandidaten der Zukunft
Mirikizumab und Guselkumab. Die beiden IL-23-Inhibitoren erweitern zukünftig nach der Anwendung bei Colitis ulcerosa nun auch bei MC die Therapieoptionen. Mirikizumab ist bereits von der EMA zugelassen, während für Guselkumab rezent eine Zulassungsempfehlung des Ausschusses für Humanarzneimittel vorliegt. Zusätzlich bietet Guselkumab erstmals auch eine subkutane Induktionsmöglichkeit für IL-23 Inhibitoren.
Obefazimod (ABX464). Ein innovatives Small Molecule, das microRNA-124 hochreguliert und proinflammatorische Zytokine reduziert. Obefazimod hat sich in der klinischen Entwicklung auch als vielversprechend bei „Difficult to treat“-Patient:innen erwiesen.
TL1A-Inhibitoren. Anti-TL1A-Antikörper befinden sich ebenfalls noch in klinischer Entwicklung als mögliche Behandlung für MC und blockieren den TL1A/DR3-Signalweg. Neben dem antiinflammatorischen Effekt haben diese Substanzen auch eine potenziell antifibrotische Wirkung.
MORF-057. Der oral verfügbare Integrin-Antagonist mit vedolizumabähnlicher selektiver Wirkung und guter Verträglichkeit ist ebenso eine neue vielversprechende Substanz in der Pipeline.
Lutikizumab. Der innovative IL-1a/b-Blocker befindet sich auch in Kombinationstherapie mit Risankizumab in klinischer Testung.
Duale Therapien. Die duale Biologika-Therapie könnte eine künftige Behandlungsoption bei MC darstellen, wodurch neue Möglichkeiten bei refraktären Verläufen zur Verfügung stehen. Die Nutzen-Risiko-Bewertung muss dabei individuell abgewogen werden.
Fazit: individualisierte Therapie als Schlüssel
Mit einem breiten Portfolio zugelassener und in Entwicklung befindlicher Substanzen rückt das Ziel der langfristigen Remission immer näher. Entscheidend bleiben eine frühzeitige, risikoadaptierte Intervention sowie die enge interdisziplinäre Zusammenarbeit – für eine optimale Versorgung unserer MC-Patient:innen.