Künftige medikamentöse Therapie – „the future is bright“
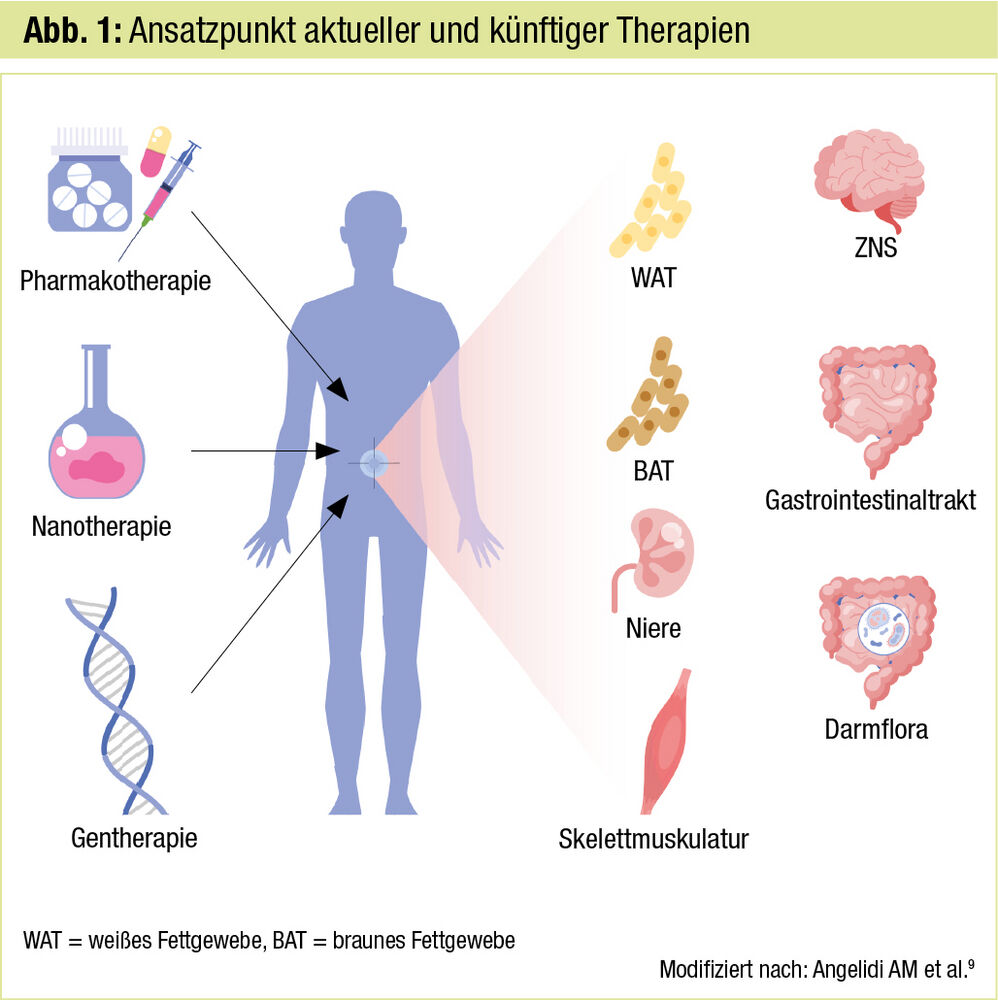
Die konservative Therapie der Adipositas mittels Ernährungsmodifikation und Fokussierung auf vermehrte körperliche Aktivität zeigt langfristig nicht die gewünschten Erfolge. Auch rigorose Interventionen wie Programme mit Inklusion von Mahlzeitenersatz belegen zwar eine günstige Wirkung auf Komorbiditäten wie den Typ-2-Diabetes1, es fehlen jedoch Langzeit- und Endpunktdaten. Von den zugelassenen oralen Medikamenten zur Behandlung der Adipositas sind lediglich der Lipase-Inhibitor Orlistat und Naltrexon/Bupropion im Handel, spielen jedoch wegen limitierter Wirksamkeit, Nebenwirkungen und eingeschränkter Verschreibbarkeit bei bestimmten Komedikationen keine signifikante Rolle. Erst die Verfügbarkeit von GLP-1-RA (Glucagon-like-Peptide-1-Rezeptoragonisten) erbrachte in der Therapie der Adipositas entscheidende Fortschritte. Abbildung 1 zeigt die möglichen Ansatzpunkte gegenwärtiger und zukünftiger Therapien. Im Folgenden kann bei der Vielzahl von Kandidaten nur exemplarisch auf einige wenige, allerdings vielversprechende Optionen eingegangen werden.
Die Gegenwart
Mono-Agonisten und eine Orphan Drug: Zur Behandlung der Adipositas sind derzeit in Europa die GLP-1-RA Liraglutid 3 mg (Saxenda®) und Semaglutid 2,4 mg (Wegovy®) zugelassen, Letzteres ist jedoch noch nicht verfügbar. Die Wirkung besteht neben den bekannten Effekten auf Betazellen (Steigerung der Insulinsekretion) und Alphazellen (Suppression der Glukagonsekretion) in einer Verzögerung der Magenentleerung sowie Verminderung von Hunger- und Verstärkung von Sättigungsgefühlen. Letzteres erfolgt durch die Bindung an GLP-1-Rezeptoren im ventromedialen Thalamus und in der Area postrema sowie dem Nucleus tractus solitarius. Mit Liraglutid 3 mg kann man von einer durchschnittlichen Gewichtsreduktion von 8,0% nach einem Jahr ausgehen.2 Die höhere Dosis von Semaglutid 2,4 mg erbrachte im STEP-Programm bei adipösen Menschen ohne manifesten Diabetes eine Gewichtsreduktion von 14,9% (placebosubtrahiert 12,5%) über 68 Wochen.3 An Nebenwirkungen sind vor allem gastrointestinale wie Übelkeit, Obstipation oder Diarrhöen erwähnenswert, die allerdings in Intensität und Häufigkeit mit Fortdauer der Behandlung abnehmen.
Sehr seltene Formen der monogenetischen Adipositas können durch eine Defizienz des Leptinrezeptors bzw. von Proopiomelanocortin (POMC), einem Sättigungshormon, verursacht sein. Setmelanotid (Imcivree®) ist ein Melanocortin-4-(MC4-)Rezeptoragonist und wird einmal täglich subkutan injiziert. Es führt über den Zeitraum von einem Jahr zu einer Verminderung des Körpergewichts von mindestens 10%.
Die nahe Zukunft
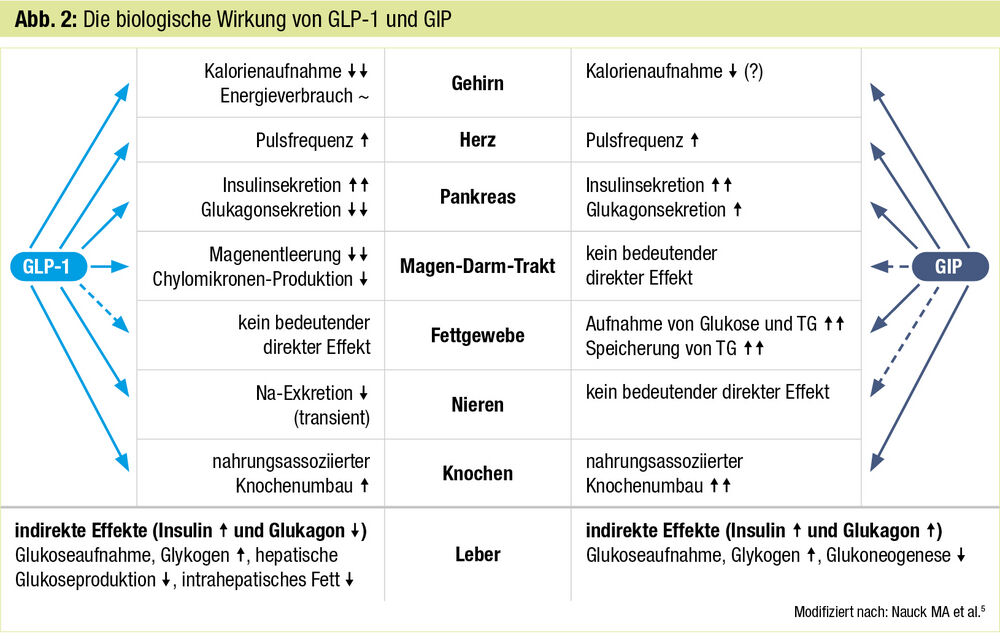
Der erste duale Agonist Tirzepatid: Nach Nahrungszufuhr werden aus dem Darm eine Reihe von Sättigungshormonen, darunter GLP-1 aus den L-Zellen des Duodenums und GIP (Glucose-dependent Insulinotropic Polypeptide oder Gastric Inhibitory Peptide) aus den K-Zellen des Jejunums, sezerniert. Gemeinsam ist diesen beiden Darmhormonen die glukoseabhängige Stimulation der Insulinsekretion. Während GLP-1 die Glukagonsekretion supprimiert und die Magenentleerung verzögert, weist GIP eine glukoseabhängige Steigerung von Glukagon auf und hat keinen Effekt auf die Magenentleerung. Allerdings kommt es vorwiegend im subkutanen weißen Fettgewebe zu einer Verbesserung der Insulinsensitivität mit verbesserter Lipidspeicherkapazität durch Aktivierung der Lipoproteinlipase.4 Beide Darmhormone vermindern Appetit bzw. Hungergefühl und wirken somit anorektisch (Abb. 2).5 Die Kombination dieser Rezeptoragonisten im Molekül Tirzepatid führt zu additiven Effekten in der Wirkung auf Blutzucker und Körpergewicht, wie in den SURPASS-Studien bei Menschen mit Typ-2-Diabetes eindrucksvoll gezeigt werden konnte. Bei Menschen mit Adipositas ohne Diabetes erbrachte die einmal wöchentliche subkutane Gabe von Tirzepatid in der Dosis von 15 mg über einen Zeitraum von 72 Wochen eine Gewichtsreduktion von 22,5% vom Ausgangsgewicht. 63% der Teilnehmer:innen erreichten eine Gewichtsreduktion von über 20% vom Ausgangsgewicht.6 Das Spektrum der Nebenwirkungen entspricht dem der GLP-1-RA, wobei GIP eine antiemetische Wirkung zugeschrieben wird. Tirzepatid ist für die Behandlung des Typ-2-Diabetes unter dem Handelsnamen Mounjaro® bereits in den USA und in Europa zugelassen, allerdings in Europa noch nicht verfügbar. Die Zulassung für die Behandlung der Adipositas steht noch aus, diesbezüglich sind auch schon kardiovaskuläre Endpunktstudien im Stadium der Rekrutierung.
Die weitere Zukunft
Weitere duale und Tripleagonisten: Einen attraktiven Kombinationspartner für einen GLP-1-RA stellt Glukagon dar, das den Energieumsatz steigert und antifibrotisch wirkt, weshalb sich auch ein Einsatz bei nichtalkoholischer Steatohepatitis (NASH) anbietet. Derzeit ist Cotadutid als GLP-1/Glukagon-Koagonist am weitesten in der klinischen Evaluierung, vor allem hinsichtlich der NASH.
Cagrilintid hat eine 84%ige Homologie zu Amylin, das mit Insulin von den Betazellen sezerniert wird und die Insulinsekretion steigert, die Glukagonsekretion vermindert, die Magenentleerung verzögert und ein Sättigungsgefühl induziert. Während Cagrilintid in Monotherapie das Körpergewicht bis ca. 7,5% vermindert, kommt es dosisabhängig in Kombination mit 2,4 mg Semaglutid (CagriSema) zu einer Reduktion von bis zu 17%.6 Diese Kombination wird derzeit bei Menschen mit Adipositas ineinem klinischen Studienprogramm getestet.
Der GLP-1-, GIP- und Glukagon-Triagonist LY3437943 konnte in einer Phase-I-Studie dosisabhängig über einen Zeitraum von drei Monaten das Körpergewicht bei Menschen mit Typ-2-Diabetes um bis zu 8,7% senken, was für diesen kurzen Zeitraum sehr eindrucksvoll erscheint.8 Zugleich kam es zu einer Senkung des HbA1c um 1,9%, verbunden mit einer Reduktion des Blutdrucks um bis zu 12/2,2 mmHg. Diese Substanz wird nun weiter zur Therapie der Adipositas und evtl. auch des Typ-2-Diabetes erforscht.
Die ferne Zukunft
Hier sei exemplarisch Bimagrumab erwähnt, ein monoklonaler Antikörper, der an den Activin-Typ-II-Rezeptor bindet und natürliche Liganden, die das Skelettmuskelwachstum hemmen, inaktiviert. Im Tierversuch kommt es nach einer einzigen intravenösen Gabe zu einer Verminderung der Fettmasse um 8%, verbunden mit einer Zunahme der Muskelmasse.
Utopien: Dazu zählen gentherapeutische Verfahren mittels viralen Vektors oder der „Genschere“ CRISPR, Vakzine (z. B. gegen das Hungerhormon Ghrelin) sowie neue Formen der Medikamentenapplikation mittels Nanotechnologie, die an Prohibitin binden und zur Apoptose von vaskulären Zellen im weißen Fettgewebe führen.9
Resümee
„The future is bright!“ Die rezenten Fortschritte in der Therapie der Adipositas mit Peptidanaloga, die in die Regulation des Körpergewichts eingebunden sind, ermöglichen in Mono- und Kombinationstherapie ein Ausmaß der Gewichtsreduktion, das beinahe im Bereich bariatrischer Verfahren liegt. Diese Effekte werden bei einem günstigen Nebenwirkungsprofil erzielt. Die Ergebnisse bereits konzipierter kardiovaskulärer Endpunktstudien werden die weitere Rolle dieser Medikamentenklasse für eine effektive und evidenzbasierte Behandlung der Adipositas bestimmen. Die vorliegenden Effekte auf kardiovaskuläre Risikofaktoren im Rahmen von Studien zur Gewichtsreduktion geben bereits Anlass zur Hoffnung auf positive Ergebnisse.



















































































