Effekte von Antidiabetika auf den Knochen
In den vergangenen Jahren erweiterte sich das Spektrum der antidiabetischen Therapie beträchtlich. Unterschiedliche Ansatzpunkte und auch pleiotrope Effekte der Antidiabetika mit durchaus gewünschten Nebenwirkungen ermöglichen uns nun je nach Begleiterkrankungen eine individualisierte Therapiestrategie. In den großen Outcome-Studien wurden zwar hauptsächlich kardiovaskuläre und renale Endpunkte untersucht, allerdings konnte über die letzten Jahre auch das Verständnis hinsichtlich der Wechselwirkungen von Diabetes mellitus, antidiabetischer Therapie und dem Knochen deutlich verbessert werden. Bei PatientInnen mit Osteoporose und Diabetes erscheint es daher sinnvoll, eine individuelle Auswahl der Diabetestherapie zu treffen, um dadurch nachteilige Effekte auf den Knochen vermeiden zu können.
Diabetes und Knochen
Die systemische Erkrankung Diabetes mellitus ist per se mit einem deutlich erhöhten Risiko für Fragilitätsfrakturen vergesellschaftet. Dabei sind neben dem Alter der Betroffenen auch die Qualität der glykämischen Kontrolle, die Diabetesdauer sowie mit dem Diabetes assoziierte Begleiterkrankungen wesentliche Risikofaktoren. Direkte Einflüsse auf die Knochenqualität haben die eingeschränkte Durchblutung durch mikroangiopathische Veränderungen, vermehrte Einlagerung von Advanced Glycation End Products (AGEs) in die Knochenmatrix sowie lokale Effekte mit Hemmung der Osteoblasten und vermehrter Transformation von Vorläuferzellen zu Osteoklasten. Zu beachten ist, dass die Porosität des Knochens bei Menschen mit Diabetes durch herkömmliche Methoden der Knochendichtemessung üblicherweise unterschätzt wird.1
Antidiabetika und Knochen
Neben den direkten Effekten der chronischen Hyperglykämie auf den Knochen beeinflusst auch die antidiabetische Medikation mit ihren unterschiedlichen Ansatzpunkten maßgeblich die Knochenqualität und das Frakturrisiko. Je nach Substanzklasse sind hier positive, neutrale, aber auch negative Auswirkungen auf den Knochen zu erwarten.
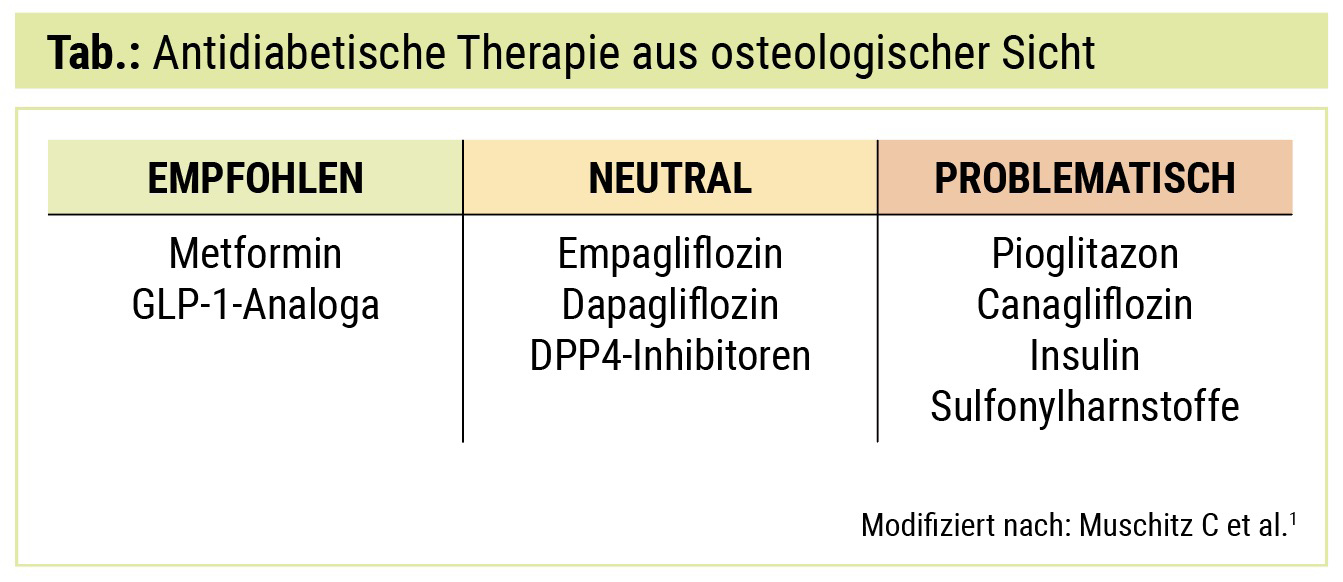
Metformin: Sowohl in vitro als auch in vivo konnten Beobachtungsstudien zeigen, dass sich unter einer Therapie mit Metformin neutrale bis protektive Effekte auf den Knochen ergeben. Im Vordergrund steht hier die vermehrte Differenzierung und Aktivierung der Osteoblasten, die letztlich eine tendenziell verbesserte Knochenqualität mit sich bringen dürfte.2, 3 Metformin wird daher sowohl aus diabetologischer als auch aus osteologischer Sicht bei Fehlen von Kontraindikationen als First-Line-Therapie des Diabetes mellitus Typ 2 empfohlen.
Sulfonylharnstoffe: Obwohl Sulfonylharnstoffe wahrscheinlich keine direkten Effekte auf den Knochenstoffwechsel haben, gilt es zu beachten, dass sich durch verstärkte Hypoglykämieneigung ein erhöhtes Sturzrisiko mit konsekutiver Frakturgefährdung ergeben kann. Dies bestätigt auch eine Metaanalyse aus dem Jahr 2019, wo sich ein um 14 % höheres Frakturrisiko unter Sulfonylharnstoffen zeigte.4
Bei PatientInnen mit bestehender Osteoporose sollte daher eine Therapie mit Sulfonylharnstoffen im Sinne einer Nutzen-Risiko-Abwägung eher vermieden werden.
Thiazolidindione (Pioglitazon): Mehrere randomisierte Studien sowie eine Metaanalyse zeigten insbesondere bei Frauen, teilweise aber auch bei Männern ein signifikant erhöhtes Frakturrisiko unter Therapie mit Thiazolidindionen. Ursächlich ist hier wahrscheinlich eine vermehrte Differenzierung mesenchymaler Stammzellen zu Adipozyten mit zugleich verminderter Bildung von Osteoblasten. Bei postmenopausalen Frauen oder Männern mit bekannter Osteoporose erscheint eine Therapie mit Pioglitazon daher nicht sinnvoll.5, 6
Dipeptidyl-Peptidase-4-(DPP4-)Inhibitoren: In einer Metaanalyse von insgesamt 87 randomisiert kontrollierten Studien ergab sich bei DPP4-Inhibitoren insgesamt ein neutraler Effekt hinsichtlich des Frakturrisikos.7 Gemäß der aktuellen Datenlage können DPP4-Inhibitoren uneingeschränkt bei PatientInnen mit Diabetes und Osteoporose angewendet werden.
Glucagon-like-Peptide-1-(GLP-1-)Analoga: GLP-1-Rezeptoren finden sich an Osteoblasten, Osteozyten und Osteoklasten. In vitro konnte unter Einfluss von GLP-1 eine Stimulation der Osteoblasten und eine Hemmung der Knochenresorption beobachtet werden, dies durch teils direkte zelluläre Effekte, aber auch über indirekte Wirkung auf Hormone wie Calcitonin und Sclerostin. Außerdem wird durch GLP-1 die Durchblutung des Knochens verbessert. Insgesamt ergibt sich in vivo ein neutraler bis leicht positiver Effekt auf Knochenarchitektur und Frakturrisiko, die gemessene Knochendichte wird jedoch auch hier nicht signifikant beeinflusst.8 In Zusammenschau erscheint die Anwendung von GLP-1-Analoga bei PatientInnen mit Osteoporose sicher und wird von Seiten der Österreichischen Diabetes Gesellschaft bei Erfüllung der Verordnungskriterien auch explizit empfohlen.
Sodium-Glucose-Cotransporter-2-(SGLT2-)Inhibitoren: SGLT2-Inhibitoren zeigten bisher vielversprechende Daten bezüglich kardiovaskulärer und renaler Endpunkte, teilweise konnte unter dieser Therapie eine signifikante Reduktion der Gesamtmortalität erzielt werden. Am Knochen sind zwar keine SGLT2-Rezeptoren vorhanden, allerdings könnte unter SGLT2-Inhibition durch verstärkte Rückresorption von Phosphat im proximalen Tubulus eine vermehrte Sekretion von Parathormon und FGF-23 mit negativen Auswirkungen auf den Knochen induziert werden. In der CANVAS-Studie wurde für Canagliflozin eine Abnahme der Knochendichte sowie ein erhöhtes Frakturrisiko beschrieben, in der CREDENCE-Studie konnte dieses Signal bei PatientInnen mit chronischer Niereninsuffizienz jedoch nicht nachgewiesen werden. Auch in den anderen SGLT2-Inhibitor-Studien (EMPA-REG OUTCOME, DECLARE-TIMI 58 sowie DAPA-HF) zeigte sich hinsichtlich des Frakturrisikos kein signifikanter Unterschied zwischen Verum- und Placebogruppe. Diese neutralen Ergebnisse werden auch durch zwei rezente Metaanalysen gestützt, sodass insgesamt von keinem signifikanten klinischen Effekt der SGLT2-Inhibitoren auf Knochenqualität und Frakturrisiko auszugehen ist.9 SGLT2-Inhibitoren können daher aus osteologischer Sicht mit Ausnahme von Canagliflozin ebenfalls zur Therapie eines Diabetes mellitus Typ 2 empfohlen werden.
Insulin: Die Abschätzung der Auswirkungen von Insulin auf das Frakturrisiko basiert hauptsächlich auf Observationsstudien. Signifikante anabole Effekte des Insulins auf den Knochen konnten in experimentellen Studien nicht nachgewiesen werden, vielmehr steht unter Insulintherapie wiederum das Hypoglykämierisiko mit konsekutiver Sturzneigung und die dadurch erhöhte Frakturrate im Vordergrund.10, 11 Insulintherapie soll daher bei gleichzeitig bestehender Osteoporose nur bei klarer Indikation und mit entsprechend vorsichtiger Dosistitration verwendet werden.
Die Empfehlungen zur antidiabetischen Therapie bei PatientInnen mit Osteoporose sind in der Tabelle nochmals zusammengefasst.
Resümee
Diabetes mellitus ist eine systemische Erkrankung, die durch unterschiedliche Mechanismen negative Effekte auf die Knochenqualität haben kann. Antidiabetika können sich wiederum positiv, neutral, aber auch negativ auf den Knochen auswirken. Vor Beginn einer antidiabetischen Therapie macht es daher Sinn, das individuelle Osteoporoserisiko abzuschätzen und bei gleichzeitigem Vorliegen einer Osteoporose die antidiabetische Therapie bewusst auszuwählen. So kann neben einer ausreichenden glykämischen Kontrolle auch das individuelle Frakturrisiko maßgeblich beeinflusst werden.
- Muschitz C et al., Wien Klin Wochenschr 2019; 131(Suppl 1): 174–185
- Pauschou SA et al., J Clin Endocrinol Metab 2017; 102: 3621–34
- Bahrambeigi S et al., Biomed Pharmacother 2019; 109: 1593–601
- Zhang Z et al., Diabetes Res Clin Pract 2020; 159: 107990
- Dormuth CR et al., Arch Intern Med 2009; 169(15): 1395–402
- Viscoli CM et al., J Clin Endocrinol Metab 2017; 102(3): 914–22
- Chen Q et al., Diabetes Ther 2019; 10: 1879–92
- Mabilleau G et al., J Endocrinol 2018; 236(1): R29–R42
- Erythropoulou-Kaltsidou A et al., Diabetes Ther 2020; 11: 7–14
- Cipriani C et al., Front Endocrinol (Lausanne) 2020; 11: 122
- Losada-Grande E et al., Sci Rep 2017; 7: 3781