Epidemiologie, Pathogenese und Co.: Was ist NAFLD?
Der Begriff nichtalkoholische Fettlebererkrankung (NAFLD) umfasst ein weites Spektrum an Erkrankungen, die von einer simplen Steatose über eine nichtalkoholische Steatohepatitis (NASH) bis hin zu Zirrhose und hepatozellulärem Karzinom (HCC) reichen.1 Grundsätzlich spricht man von einer Steatose, wenn mehr als 5 % der Hepatozyten Lipidablagerungen aufweisen. Das Fortschreiten der Erkrankung zu NASH und Fibrose ist durch das zusätzliche Vorkommen von lobulärer Inflammation, hepatozellulärem Ballooning und Bindegewebsvermehrung gekennzeichnet.2 Die steigende Anzahl der betroffenen Patienten sowie die mannigfaltigen systemischen Auswirkungen der NAFLD haben das Krankheitsbild in den letzten Jahren zu Recht in den Fokus des allgemeinen Interesses gerückt.
Epidemiologie
In den letzten Jahren kam es zu einem weltweiten Anstieg der Mortalität durch chronische Lebererkrankungen.3 Diese Beobachtung ist unter anderem durch einen rapiden Anstieg in der Prävalenz der NAFLD bedingt.4 Die Prävalenz der NAFLD wird in der allgemeinen Bevölkerung auf etwa 25 % geschätzt.5 In den westlichen Ländern rechnet man damit, dass die NAFLD in der Zukunft die häufigste Ursache für eine Lebertransplantation darstellen wird.6 In einer 2018 veröffentlichten Hochrechnung aus den USA wurde geschätzt, dass im Jahr 2030 die Prävalenz der NAFLD in der allgemeinen Bevölkerung auf 33 % und damit einhergehend auch die Zahl der Patienten mit dekompensierter Leberzirrhose und schließlich die Anzahl von leberassoziierten Todesfällen erheblich steigen wird.7 Grundsätzlich kommt es zu einem Anstieg der Prävalenz mit zunehmendem Alter. Bezüglich der Geschlechtsverteilung wird meist eine höhere Prävalenz der NAFLD bei Männern angegeben, jedoch wurde in manchen Studien auch ein höheres Risiko für Frauen berichtet, sodass hier insgesamt widersprüchliche Daten vorliegen.8 Dies ist wohl auf unterschiedliche Studienpopulationen vor allem in Bezug auf Begleiterkrankungen und ethnischen Hintergrund zurückzuführen. Eine besonders starke Assoziation besteht zwischen Adipositas und NAFLD. Bei adipösen Patienten, welche sich einer bariatrischen Operation zur Gewichtsreduktion unterziehen wollen, ist von einer Prävalenz der NAFLD bis zu 90 % auszugehen.8
Pathogenese
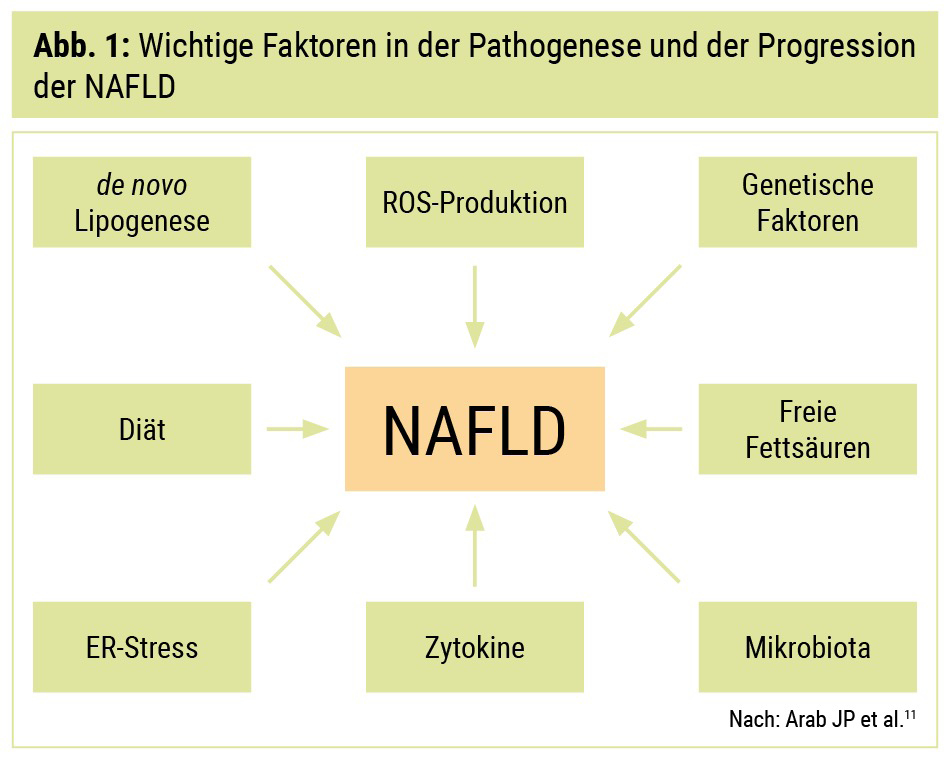
Die Grundlage in der Entwicklung einer NAFLD ist eine Imbalance zwischen Lipidaufnahme in die Leber und Verarbeitung bzw. Abtransport von Lipiden aus der Leber. Diese Imbalance kann durch multiple Faktoren beeinflusst werden und führt im Endeffekt zu einer intrahepatischen Lipidakkumulation.9 Eine erhöhte Lipidzufuhr kommt, vor allem bei Patienten mit Diabetes mellitus Typ 2, durch eine erhöhte Lipolyse im Fettgewebe mit nachfolgend verstärktem Transport von Fettsäuren in die Leber zustande. Zusätzlich spielen eine erhöhte Aufnahme von Fett durch die Nahrung sowie eine verstärkte De-novo-Lipogenese (DNL) eine Rolle. Untersuchungen bezüglich der Herkunft der intrahepatischen Triglyzerid-(TG-)Ablagerungen konnten zeigen, dass etwa 60 % durch zirkulierende Fettsäuren, 25 % durch DNL und 15 % durch Nahrungsfette bedingt sind.10 Störungen der intrahepatischen Lipidverarbeitung sind ebenfalls von Bedeutung und umfassen unter anderem eine gestörte hepatische Fettsäureoxidation sowie eine veränderte Formation von Very-low-Density-Lipoproteinen (VLDL), welche einen entscheidenden Einfluss auf den Export von Lipiden aus der Leber haben. Die Progression der Erkrankung von einer Steatose zu NASH und schließlich Zirrhose wird unter anderem durch eine verstärkte Produktion reaktiver Sauerstoffspezies (ROS), ER-(Endoplasmatisches-Retikulum-)Stress und eine vermehrte Expression von proinflammatorischen Zytokinen bestimmt.11 Zusätzlich werden Veränderungen in der mitochondrialen Funktion diskutiert, die einerseits die Energieverarbeitung, aber auch die beschriebene ROS-Produktion beeinflussen könnten.12 Des Weiteren konnten in den letzten Jahren genetische Faktoren identifiziert werden, die einen entscheidenden Einfluss auf die Entstehung einer NAFLD haben. Ein Beispiel hierfür sind Polymorphismen im Patatin-like Phospholipase Domain-containing Protein 3-(PNPLA3-)Gen. Dieses Gen codiert für das Protein Adiponutrin, welches die TG-Hydrolyse im Fettgewebe beeinflusst. Eine genomweite Assoziationsstudie konnte zeigen, dass Varianten im PNPLA3-Gen mit einem höheren hepatischen Fettgehalt und vermehrter hepatischer Inflammation assoziiert sind.13 Neben intrahepatischen Mechanismen spielen auch systemische Faktoren, wie zum Beispiel die begleitende Insulinresistenz und die damit einhergehenden Veränderungen, eine bedeutende Rolle.14 Einen weiteren extrahepatischen Faktor in der Pathogenese der NAFLD stellen Veränderungen der intestinalen Mikrobiota dar. Die Verbindung zwischen intestinaler Mikrobiota und der Leber wird hierbei bidirektional unter anderem durch inflammatorische Faktoren, Gallensäuren und bakterielle Produkte bestimmt.15, 16
All diese Faktoren können schließlich die Progression der Erkrankung vorantreiben und die Sequenz von Steatose zu Inflammation, Fibrose und maligner Transformation beeinflussen, welche zusammen mit den extrahepatischen Auswirkungen der NAFLD für die Prognose der Erkrankung entscheidend ist. Die Abbildung zeigt einen Überblick über wichtige Faktoren in der Pathogenese der NAFLD.
Prognose
Wie schon zuvor erwähnt, wird die Prognose der Erkrankung sowohl durch die hepatischen Veränderungen als auch durch die assoziierten extrahepatischen Veränderungen bestimmt. Im Vergleich zu Kontrollpopulationen konnte in einigen Studien eine erhöhte Mortalität bei Patienten mit NAFLD gezeigt werden.17, 18 Die Mortalität von Patienten mit NAFLD wird durch leberassoziierte Faktoren, aber auch durch kardiovaskuläre Erkrankungen und das massiv erhöhte Diabetesrisiko bedingt.1 Die Angaben über den zeitlichen Verlauf und das Risiko für die Progression der Erkrankung selbst – von einer Steatose zu NASH und Fibrose – divergieren stark. In manchen Studien wird eine Progressionsrate zu einer Fibrose von bis zu 30 % angegeben.1, 19 Kommt es im Verlauf der Erkrankung zu einer Fibrose, stellt dies einen robusten Prädiktor für die Entwicklung leberassoziierter Komplikationen dar.20
Koexistenz mit dem metabolischen Syndrom
Das metabolische Syndrom vereint klinische und metabolische Faktoren unter Berücksichtigung von: Bauchumfang, Glukose, Triglyzeriden, High-Density-Lipoproteinen (HDL) und arterieller Hypertonie.21 In vielen Querschnittstudien wurde eine Assoziation zwischen NAFLD und dem metabolischen Syndrom beschrieben.22 Unter den verschiedenen Aspekten des metabolischen Syndroms besteht, wie schon zuvor erwähnt, eine besonders starke Assoziation zwischen NAFLD und Adipositas.8 Allerdings ist zu erwähnen, dass das Vorkommen der NAFLD nicht auf adipöse Patienten beschränkt ist und die Diagnose NAFLD auch zu einem erheblichen Anteil an schlanken Personen gestellt wird.23 In diesem Zusammenhang scheint besonders die Fettverteilung, insbesondere der Anteil an viszeralem Fett, von Bedeutung zu sein. Zusätzlich besteht eine enge Beziehung zwischen NAFLD und Störungen des Glukosemetabolismus.24 Die genauen Ursachen dieser Assoziation sind bislang noch weitgehend unklar. In einer bereits 2006 veröffentlichten Studie konnte der enge Zusammenhang zwischen der Progression der Erkrankung und der Entwicklung einer Glukosestoffwechselstörung gezeigt werden, die von einer höheren Gewichtszunahme und einem höheren Grad der Steatose in der Verlaufsuntersuchung begleitet war.17 Insgesamt verdeutlicht die enge Assoziation von NAFLD mit verschiedenen Komponenten des metabolischen Syndroms die immense Bedeutung des zentralen Stoffwechselorgans Leber und unterstreicht die Tatsache, dass die NAFLD sowohl aufgrund ihrer hepatischen als auch ihrer systemischen Auswirkungen von großer Bedeutung ist.
Resümee
Die NAFLD umfasst ein weites Spektrum von pathologischen Veränderungen, das von einer Steatose bis hin zu NASH und Fibrose mit dem Potenzial zur Entwicklung eines HCC reicht.
Die Prävalenz der Erkrankung ist in den letzten Jahren stark angestiegen und stellt schon jetzt eine der häufigsten Ursachen für eine Lebertransplantation dar.
Die Auswirkungen einer NAFLD gehen über den Einfluss auf das zentrale Stoffwechselorgan Leber hinaus, und sowohl die Progression der Erkrankung als auch die Komplikationen der Erkrankung werden maßgeblich durch extrahepatische Effekte beeinflusst.
1 Ekstedt M et al., Curr Hepatol Rep 2017; 16(4): 391–7
2 Brunt EM, Nat Rev Gastroenterol Hepatol 2010; 7(4): 195–203
3 Mokdad AA et al., BMC Med 2014; 12: 145
4 Younossi Z et al., Nat Rev Gastroenterol Hepatol 2018; 15(1): 11–20
5 Younossi ZM et al., Hepatol Baltim Md 2016; 64(1): 73–84
6 Cholankeril G et al., Dig Dis Sci 2017;62(10):2915–22.
7 Estes C et al., Hepatol Baltim Md 2018; 67(1): 123–33
8 Younossi ZM, J Hepatol 2019; 70(3): 531–44
9 Ress C et al., World J Gastroenterol 2016; 22(4): 1664–73
10 Donnelly KL et al., J Clin Invest 2005; 115(5): 1343–51
11 Arab JP et al., Ann Rev Pathol 2018; 13: 321–50
12 Koliaki C et al., Cell Metab 2015; 21(5): 739–46
13 Romeo S et al., Nat Genet 2008; 40(12): 1461–5
14 Byrne CD et al., J Hepatol 2015; 62(Suppl.1): S47-64
15 Adolph TE et al., Trends Immunol 2018; 39(9): 712–23
16 Wieland A et al., Aliment Pharmacol Ther 2015; 42(9): 1051–63
17 Ekstedt M et al., Hepatol Baltim Md 2006; 44(4): 865–73
18 Adams LA et al., Gastroenterology 2005; 129(1): 113–21
19 McPherson S et al., J Hepatol 2015; 62(5): 1148–55
20 Ekstedt M et al., Hepatol Baltim Md 2015; 61(5): 1547–54
21 Grundy SM et al., Circulation 2005; 112(17): 2735–52
22 Lonardo A et al., Dig Liver Dis Off J Ital Soc Gastroenterol Ital Assoc Study Liver 2015; 47(3): 181–90
23 Kim D et al., Clin Gastroenterol Hepatol Off Clin Pract J Am Gastroenterol Assoc 2017; 15(4):474–85
24 Tilg H et al., Nat Rev Gastroenterol Hepatol 2017; 14(1): 32–42