Brust- und Eierstockkrebs – Wie erkenne ich eine Hochrisikofamilie?
Derzeit kennen wird mehrere Gene, deren Mutation in der Keimbahn mit einem deutlich erhöhten Risiko für Mamma- und/oder Ovarialkarzinom verbunden ist – und damit ein so genanntes Tumordispositions-Syndrom verursachen. Das immer weiter verbreitete Wissen um diese genetische Komponente bei manchen Brustkrebserkrankungen hat letztendlich zu einer größeren Nachfrage nach Information, Screening und vermehrt zu Zuweisungen zu genetischen Beratungen und Testungen geführt.
Familienanamnese als Basis der genetischen Beratung
Die exakte und genaue Abfrage und Analyse der individuellen Familienanamnese ist nicht nur in Bezug auf vererbbaren Brust- und Eierstockkrebs von immanenter Wichtigkeit, sondern kann auch Hinweise auf andere erbliche Risikofaktoren liefern, die für eine präventivmedizinische Betreuung des Patienten und seiner Familie erhebliche Bedeutung haben. In manchen Situationen ist die Information über die familiäre medizinische Vorgeschichte alleine eine Basis für entsprechend maßgeschneiderte präventive Maßnahmen. In anderen Situationen kann die Familiengeschichte wertvolle Hinweise in Bezug auf gezielte genetische Tests geben, die eine weitere Risikoabklärung in der Familie erlauben, wie etwa eine Testung auf BRCA1- oder BRCA2-Mutationen. Im Nachhinein kann der prädiktive Wert einer solchen Testung, die z .B. eine hochpenetrante Mutation im BRCA1- oder BRCA2-Gen nachweist, durch die Familienanamnese weiter modifiziert werden. Dies erlaubt die Identifizierung möglicher Personen in einer Familie, die ebenfalls Mutationsträger mit hohem Erkrankungsrisiko sind. Im Konkreten heißt dies, dass z. B. der Zeitpunkt für intensivierte Früherkennung oder prophylaktische Operationen je nach Mutation, aber auch je nach Familiengeschichte variieren kann. Die positive Familienanamnese alleine stellt trotz vieler molekularmedizinischer Untersuchungsmethoden nach wie vor einen wichtigen Risikofaktor für mehrere Krebsarten darunter anderem, weil man sicher ist, dass es außer den routinemäßig untersuchten Genen noch andere, zum Teil unbekannte Gene geben muss, deren Mutation ein hohes Risiko für Mamma- und ggf. auch Ovarialkarzinome verursacht. So ist schon längere Zeit bekannt, dass auch ohne den Nachweis einer derzeit bekannten Mutation das Risiko bei einer stark positiven Familienanamnese das Lebenszeitrisiko bei erstgradig Verwandten von Erkrankten bei bis zu 30% liegen kann. Somit sollten diese Frauen ebenfalls in ein entsprechendes Screening bzw. Früherkennungsprogramm integriert werden.
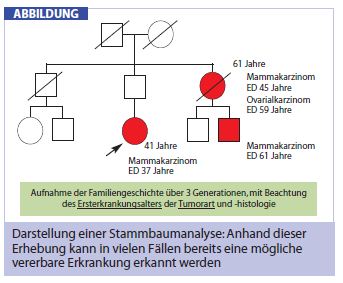
Die Stammbaumerhebung stellt ein Fundament in der Darstellung der Familienanamnese dar. Da diese Erhebung sehr gut standardisiert werden kann, sollte sie als integraler Bestandteil in der Beurteilung des Erkrankungsrisikos für jede Ratsuchende durchgeführt werden. Die Familiengeschichte sollte über 3 Generationen, mit Beachtung des Erkrankungsalters, der Tumorart und der Histologie erhoben werden (Abb.).
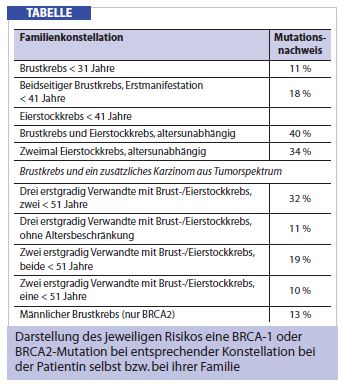
Bestimmung des individuellen Brust- und Eierstockkrebsrisikos: Aufgrund der derzeitigen Inzidenz des Mammakarzinoms kann von einem Risiko von 10-12% für jede Frau, im Laufe des Lebens an einem Mammakarzinom zu erkranken, ausgegangen werden. Die Wahrscheinlichkeit, niemals an Brustkrebs zu erkranken, liegt somit bei 88%. Das Risiko für Eierstockkrebs liegt mit einem Lebenszeitrisiko von etwa 1% in der Allgemeinbevölkerung deutlich niedriger. Diese Risiken können durch genetische Veränderungen deutlich erhöht sein. Bei Frauen mit einer BRCA1-Mutation liegt das Lebenszeitrisiko für ein Mammakarzinom beispielsweise bei etwa 80% und für ein Ovarialkarzinom bei etwa 40%. Aus prospektiven Untersuchungen ist bekannt, dass auch trotz negativer Testung auf eine BRCA1- oder BRCA2-Mutation bei entsprechender Familienanamnese das Risiko, an Brustkrebs zu erkranken, bei bis zu 40% liegt. Um entsprechende Vorsorgemaßnahmen treffen zu können, ist es wichtig, sowohl Familien, in denen eine Risikoerhöhung vorliegt, als auch die Frauen in diesen Familien, die individuell von einem erhöhten Risiko betroffen sind, zu identifizieren (Tab.).
Identifikation von Frauen mit individuell erhöhtem Brustkrebsrisiko
Familienanamnese: Sehr viele Frauen können – schlicht aufgrund der Inzidenz des Mammakarzinoms – auf einen weiteren Brustkrebsfall in der Familie verweisen. Allerdings hat nur ein Bruchteil der weiblichen Bevölkerung durch das Auftreten einer weiteren Brustkrebserkrankung in der Familie mit einer substantiellen Erhöhung des Mammakarzinomrisikos zu rechnen. Die Erhebung der Familienanamnese in Bezug auf Mamma- und Ovarialkarzinome (aber auch andere Karzinomerkrankungen) ist derzeit das wichtigste Mittel in der Beurteilung eines klinisch relevanten Risikos. Zur Beurteilung ist die Verteilung der Brustkrebsfälle bei weiteren Familienmitgliedern und auf andere Generationen, das Erkrankungsalter und das Auftreten syndromal verwandter Krebsarten, wie des Ovarialkarzinoms oder in seltenen Fällen anderer Tumorarten, wichtig. Insgesamt sind etwa 5-8% aller Brustkrebserkrankungen durch die Vererbung von Mutationen in so genannten “High Penetrance”-Genen verursacht, wie etwa dem BRCA-1-Gen. Bei Verdacht auf das Vorliegen einer solchen Mutation sind gezielte molekulargenetische Untersuchungen möglich, um eine weitere Risikoabklärung zu ermöglichen. Konkrete Hinweise auf ein erblich erhöhtes Risiko für Brustkrebs in einer Familie bieten beispielsweise folgende Kriterien:
-
eine betroffene Person in der Familie:
– Brustkrebs mit Erstmanifestation bis zum Alter von 35
– beidseitiger Brustkrebs mit Erstmanifestation bis zum Alter von 50
– Brust- und Eierstockkrebs bei einer Frau unabhängig vom Alter -
mehrere betroffene Personen in einer Familienlinie:
– 2 Frauen mit Brustkrebs, davon eine mit einer Erstmanifestation bis zum Alter von 50
– eine Frau mit Brust- und eine Frau mit Eierstockkrebs
– 2 Frauen mit Eierstockkrebs
– 3 oder mehr Frauen mit Brustkrebs
– ein Mann mit Brustkrebs und eine Frau mit Brust- und Eierstockkrebs
– Brust-/Eierstockkrebs bei einer Frau unabh. vom Alter
Falls sinnvoll und gewünscht, sollte versucht werden, das individuelle Risiko einer Person in einer Hochrisikofamilie durch molekulargenetische Untersuchungen bei der Person selbst und in manchen Fällen auch im familiären Umfeld abzuklären. Falls dies nicht möglich sein sollte oder keine genetische Ursache in der Familie identifiziert werden kann, besteht die Möglichkeit, anhand der Familienanamnese einzelne Ratsuchende nach Risikogruppen (durchschnittliches, moderates und hohes Risiko) zu klassifizieren. Folgende Definitionen werden verwendet:
-
durchschnittliches Risiko: keine erstgradigen Verwandten mit Brust- oder Eierstockkrebs, nicht mehr als eine zweitgradige Verwandte mit Brust- oder Eierstockkrebs
-
moderates Risiko: eine erstgradige Verwandte mit Brustoder Eierstockkrebs oder 2 zweitgradige Verwandte von gleicher Familienseite mit Brust- oder Eierstockkrebs
-
hohes Risiko: mindestens 2 erstgradige Verwandte mit Brustoder Eierstockkrebs
Basierend auf dieser Definition konnte anhand einer gepoolten Analyse festgestellt werden, dass in der westlichen Welt 92,7% der Bevölkerung der durchschnittlichen Risikogruppe angehören, 6,9% der moderaten Risikogruppe und 0,4% der Hochrisikogruppe zuzuordnen sind. Die weiteren Früherkennungsprogramme sollten an die Einordnung in die Risikogruppen angepasst werden.
Weitere Hilfsmittel zur Beurteilung des individuellen Risikos: Die Verwendung von modellgestützten Computerprogrammen, um das individuelle Risiko und damit auch das Risiko weiterer Familienmitglieder zu beurteilen, erleichtert dem Arzt die Beratung hilfesuchender Frauen. Solche Modelle berücksichtigen alle die Familienanamnese als wesentlichsten Einflussfaktor zur Risikobeurteilung, je nach Modell aber auch andere Risikofaktoren wie vorangegangene abnorme Biopsien aus der Brust oder auch die reproduktive Vorgeschichte. Frauen die aus so genannten High-Risk-Familien kommen, sollten jedoch unabhängig von solchen Programmen immer an speziell für diese Fragen ausgerichteten Institutionen beraten werden, um eine definitive Risikobeurteilungen zu ermöglichen.
Breast Cancer Risk Assessment Tool: Hier handelt es sich um ein vom National Cancer Institute und der Studiengruppe National Surgical Adjuvant Breast and Bowel Project (NSABP) enwickeltes, interaktives Hilfsmittel, um das individuelle Brustkrebsrisiko zu beurteilen. Das Breast Cancer Risk Assessment Tool ist unter der Webpage des NCI (http://www.cancer.gov/bcrisktool/) frei für jeden zugänglich. Dieses Werkzeug wurde basierend auf dem ursprünglichen Gail-Modell entwickelt und beinhaltet folgende Risikofaktoren: derzeitiges Alter, ethnischer Hintergrund, Alter zum Zeitpunkt der Menarche, Alter zum Zeitpunkt der ersten Geburt, Anzahl der erstgradig Verwandten mit Brustkrebs, Anzahl vorangegangener Brustbiopsien und das Vorhandensein einer atypischen duktalen Hyperplasie in der Brustbiopsie. Mit diesem Rechenmodell kann die Wahrscheinlichkeit der zu Beratenden, in den nächsten 5 Jahren bzw. im Laufe ihres Lebens (bis zum 90. Lebensjahr) an Brustkrebs zu erkranken, berechnet werden. Aufgrund der Tatsache, dass dieses Modell in großen Populationen validiert wurde, zeigt es sich jedoch nur als bedingt nützlich in der Beurteilung des individuellen Risikos. Schwachpunkte sind die Tatsache, dass dieses Rechenmodell die paternale Familienanamese, zweitgradig Verwandte oder das Erkrankungsalter nicht in die Risikobeurteilung aufgenommen hat. Insbesondere diese Faktoren sind aber wichtig, um das erbliche Risiko abschätzen zu können.
Claus-Modell: Das Claus-Modell (http://www4.utsouthwestern. edu/breasthealth/cagene/default.asp) berechnet die Wahrscheinlichkeit einer Frau, an Brustkrebs zu erkranken, ausschließlich basierend auf ihrer Familienanamnese. Eine detaillierte Beurteilung der Erkrankungen in der Familie ist in der Berechnung inkludiert, andere Risikofaktoren fehlen jedoch. Mit diesem Rechenmodell kann das Risiko für die Lebenszeit bzw. für jeweils 10-Jahres-Intervalle berechnet werden. Eine Berechnung anhand dieses Modells ist jedoch nur sinnvoll für Frauen mit mindestens einer erstgradig Verwandten mit Brustkrebs. Faktoren wie Alter zum Zeitpunkt der Menarche, Alter zum Zeitpunkt der ersten Geburt oder Fälle von Ovarialkarzinom in der Familie werden hier nicht berücksichtigt.
BRCAPRO: Trotz der Tatsache, dass weniger als 10% aller Brustkrebserkankungen eine direkte Verbindung zu bekannten genetischen Mutationen wie BRCA-1 und BRCA-2 aufweisen, haben Frauen mit einer derartigen Mutation ein extrem hohes Brustkrebsrisiko. Der Informationsgewinn aus einer genetischen Testung ist für eine weitere Beratung der Betroffenen unumstritten. Allerdings ist eine universelle genetische Analyse auch mit Problemen assoziiert. Insbesondere die hohen Kosten und die nach wie vor unklare Vorgehensweise bei Mutationen unklarer klinischer Signifikanz (UVs) macht es notwendig, die zu testenden Personen genau zu selektionieren. Generell wird eine Testung bei Individuen, deren Risiko für eine Mutation über 10% liegt, empfohlen. BRCAPRO ist ein Programm, welches die Wahrscheinlichkeit berechnet, dass ein bestimmtes Familienmitglied eine Keimbahnmutation im BRCA-1- und/oder BRCA-2-Gen trägt (http://www4.utsouthwestern.edu/breasthealth/cagene/default.asp). Die Berechnung basiert auf den Bayes-Regeln zur Beurteilung der Mutationswahrscheinlichkeit aufgrund der Familienanamnese. Es werden auch Tumorprädispositions-Syndrome bewertet, bei denen Mammakarzinome nicht die primäre Neoplasie darstellen, wie etwa das Lynch-Syndrom (http://www4.utsouthwestern. edu/breasthealth/cagene/default.asp).
Tyrer-Cuzick-Modell: Dieses Risikoberechnungsmodell verbindet genetische und nicht-genetische Faktoren. Ein Stammbaumerhebung über 3 Generationen soll über die Wahrscheinlichkeit des Vorliegens einer BRCA-1/BRCA-2 oder einer möglichen “Low Penetrance”-Genmutation Aufschluss geben, also einer Mutation in einem Gen, die alleine nur ein moderates Brustkrebsrisiko verursacht. Zusätzlich sind in diesem Modell persönliche Risikofaktoren wie Parität, Body-Mass-Index, Größe, Alter zum Zeitpunkt der Menarche, Menopause, erste Geburt sowie die Histologie einer eventuell vorhandenen Biopsie inkorporiert. Somit werden hier ebenfalls genetische und nicht-genetische Faktoren kombiniert um ein Risiko zu kalkulieren.
Weitere Programme: The Breast and Ovarian Analysis of Disease Incidence and Carrier Estimation Algorithm (BOADICEA) beinhaltet ebenfalls die Familienanamnese und BRCA-1- und BRCA-2-abhängige und eine davon unabhängige multigene Risikokomponente. Daneben existieren noch weitere Modelle wie CancerGene, Progeny, Cyrillic. Allerdings sind diese Rechenmodelle derzeit nicht öffentlich zugänglich.
Fazit: Frauen, die in der gynäkologischen Praxis als “High Risk” klassifiziert werden oder aus einer Familie stammen, die eines der oben genannten Kriterien für ein erbliches Brustkrebsrisiko erfüllt, sollten für eine genetische Beratung und Risikobeurteilung an das entsprechende Zentrum überwiesen werden. Insbesondere auch, da vor einer eventuell indizierten weiteren molekulargenetischen Abklärung eine weitere humangenetische und ggf. psychoonkologische Beratung stattfindet. Die Vielzahl der angebotenen Programme zeigt die Problematik auf, solche Modelle zu entwerfen. Entsprechend hat jedes Modell spezifische Einschränkungen. Daher sollten solche Modelle in jedem Fall nur als beigeordnetes Hilfsmittel verwendet werden.