Ursachen und Behandlungsmöglichkeiten – Tumoranämie
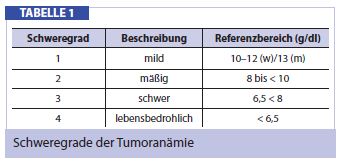
Unter Tumoranämie versteht man eine Blutarmut mit Hämoglobinwerten von unter 12 g/dl bei Frauen bzw. unter 13 g/dl bei Männern. Nach der NCCN unterscheidet man 4 Grade der Tumoranämie, wobei eine Behandlung ab Grad 2 indiziert ist (Hb < 10 g/dl) (Tab. 1).
Ursachen
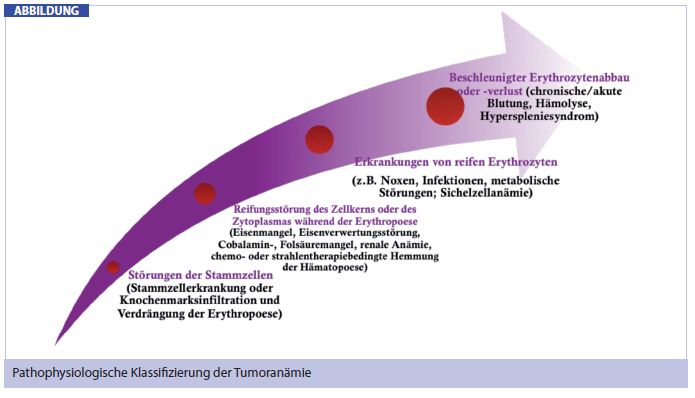
Die Tumoranämie weist eine multifaktorielle Pathogenese auf. Generell entwickelt sich eine Blutarmut aufgrund einer Störung auf einer der folgenden 4 Ebenen: (a) der Ebene der Stammzellen, (b) der Erythropoese, (c) der Zirkulation von reifen Erythrozyten und (d) auf der Ebene der Lebenszeit der roten Blutkörperchen (Abb.).
Therapieassoziiert: Die häufigste Ursache der Tumoranämie liegt in einer direkten Reifungsstörung des Zellkerns von reifen Erythrozyten während einer chemotherapeutischen Behandlung. Insbesondere Taxan- und Anthrazyklinhältige Schemata weisen eine hohe Anämieinzidenz von 70% bzw. 90% auf. Zytostatika können jedoch auch direkt nephrotoxisch wirken und im Zuge eines Schadens an den Nierenzelltubuli eine verminderte Produktion des Hormons Erythropoetin bewirken. Auch die Strahlentherapie der Brustwand kann aufgrund einer eventuellen Mitbestrahlung des blutbildenden Knochenmarks im Sternum an der Pathogenese einer Tumoranämie mitverantwortlich sein.
Krankheitsassoziiert: Krebs ist eine chronische Erkrankung und wirkt daher per se über die Freisetzung von Zytokinen als Ursache einer Anämie. Je länger der Krankheitsverlauf und je fortgeschrittener das Tumorstadium, desto ausgeprägter manifestiert sich die Tumoranämie. Proinflammatorische Zytokine, wie z. B. TNF-alpha, IL-1, IL-6, IFN-gamma, behindern einerseits die Produktion des Hormons Erythropoetin in der Niere, andererseits führen sie in der Leber zu einer vermehrten Bildung von Hepcidin, einem Akute-Phase-Protein, welches für den Eisenstoffwechsel von Bedeutung ist. Bei einer Überproduktion von Hepcidin werden die gastrointestinale Aufnahme des Eisens und dessen Transport gehemmt, weshalb viele Tumorpatienten über eine verminderte Eisenkapazität verfügen. Die Messung des Ferritins und der Transferrinsättigung sollten daher in jeder Anämiediagnostik miteinbezogen werden. Die Indikation zur therapeutischen Eisensubstitution ergibt sich bei einem Ferritin-Wert von < 800 ng/ml und einer Transferrinsättigung von unter 20%.
Zu den weiteren Ursachen einer Tumoranämie zählen u. a. Malnutrition, die Infiltration des Knochenmarks mit Tumorzellen oder akuter/chronischer Blutverlust.
Klinische Symptome
Die Symptome dieser häufigen Nebendiagnose von Krebspatienten sind zwar unspezifisch, dennoch schränken sie die Lebensqualität der Betroffenen maßgeblich ein: Als häufigstes Symptom der Tumoranämie werden eine leichte Ermüdbarkeit, schnelle Erschöpfung, Lethargie, Depressionen und kognitive Defizite genannt, doch lässt sich generell sagen, dass Krebspatienten mit einer unbehandelten Anämie weitaus schlechtere Prognosen haben als nach einer behandelten.
Therapie Die wichtigsten Therapieziele der Tumoranämie sind nach allen Leitlinien der internationalen Gesellschaften die gleichen: die Hebung des Hämoglobinwertes auf 11-12 g/dl, die Verbesserung der Lebensqualität und die verminderte Notwendigkeit von Bluttransfusionen.
Bluttransfusionen: Lange Zeit galt die Bluttransfusion als die einzige Therapieoption zur Behandlung einer Tumoranämie. Als 1989 jedoch das erste rekombinant hergestellte Erythropoetin am Markt zugelassen war (Epogen®, Epoetin alpha der Firma Amgen), wurden die Weichen für weitere Therapiemöglichkeiten geöffnet. Heutzutage hat die Bluttransfusion ihre Berechtigung in einer schweren, lebensbedrohlichen Anämie, insbesondere wenn sich diese sehr schnell entwickelt hat.
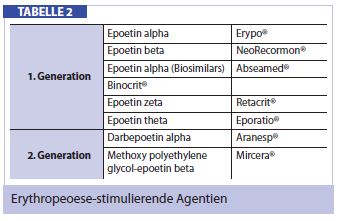
Erythropoese-stimulierenden Agentien (ESAs): Zum Standard der modernen Tumoranämie-Behandlung gelten jedoch in erster Linie die Erythropoese-stimulierenden Agentien (ESAs) der 1. und 2. Generation, welche sich in ihrer Wirkungsdauer voneinander unterscheiden (Tab. 2). Gemäß internationalen Richtlinien liegt der Einsatz von ESAs bei einer symptomatischen Anämie mit einem Hb < 11 g/dl. Die Ziel-Hämoglobinkonzentration liegt bei 12 g/dl. Der Zielwert sollte nicht überschritten werden, da es aufgrund des gesteigerten Hämatokrits zu potenziell lebensgefährlichen thromboembolischen Ereignissen kommen kann. Weitere Nebenwirkungen sind ein Blutdruckanstieg bis hin zur hypertensiven Krise (in den ersten 4 Wochen nach Beginn der ESA-Therapie), Kopfschmerzen, Hautreaktionen oder unspezifische Arthralgien. Etwa 60% der mit ESAs behandelten Patienten sprechen jedoch nicht mit einem Hb-Anstieg von 1-2 g/dl innerhalb von 6 bis 8 Wochen an und gelten somit als “Non-Responder”. In solchen Fällen sollte man zu diesem Zeitpunkt eine Untersuchung des Ferritins und der Transferrinsättigung einleiten, falls diese noch nicht erfolgt ist. Es konnte gezeigt werden, dass viele Non-Responders einen manifesten oder latenten Eisenmangel hatten, wobei sich die zusätzliche Gabe von Eisen in solchen Fällen als sinnvoll herausgestellt hat.
Bei Patientinnen mit Eisenmangel eignet sich eine orale Substitution mit Eisenglukonat, Eisensulfat oder Eisenfumarat bzw. intravenös mit Eisendextran, Eisensucchrose oder Eisenglukonat. Der Vorteil von oralem Eisen liegt in der Einfachheit der Gabe. Das Ansprechen auf die alleinige Gabe von Eisen ist jedoch einerseits langwierig (kann bis zu 10 Wochen dauern) und ist andererseits nicht immer gewährleistet. Etwa 20% der Patienten brechen die Therapie aufgrund der gastrointestinalen Unverträglichkeiten und Nebenwirkungen (Obstipation, Diarrhö, Gastritis, Geschmacksverlust) ab.
Zusammenfassend lässt sich sagen, dass die Anämie eine wichtige Nebendiagnose in der gynäkologischen Onkologie darstellt und einer stadiengerechten Therapie bedarf, da sie unbehandelt mit einem schlechteren Outcome assoziiert ist.