Komplikationen der operativen Therapie bei tief infiltrierender Endometriose
Tief infiltrierende Endometriose (TIE) des Rektums, rektovaginalen Septums (RVS) oder des Harntrakts (Urinary Tract Endometriosis – UTE) wird bei 10–20 % aller Endometriosepatientinnen beobachtet. Die Indikation zur operativen Therapie stellt eine therapieresistente, die Lebensqualität beeinträchtigende Schmerzsymptomatik und/oder Infertilität der Patientin dar. Die operative Resektion der TIE ist in der Regel anspruchsvoll und erfordert ein ausreichendes Maß an chirurgischer Erfahrung, eine exakte präoperative Diagnose sowie ein funktionierendes interdisziplinäres Management.
Klassifikation und Prävalenz
Etwa ein Fünftel aller Frauen mit Endometriose weisen tief infiltrierende Läsionen im Bereich der Vagina, des Septum rectovaginale (RVS) oder Rektosigmoids auf. Bei etwa 15 % dieser Patientinnen zeigt sich eine Infiltration der Harnblase und/oder des Harnleiters. Eine konsekutive Hydronephrose (HN) kann unbehandelt zum Verlust der Nierenfunktion führen. Während die Blasenendometriose in 70–80 % der UTE diagnostiziert wird, ist eine Ureterbeteiligung in 10 bis 20 % der Fälle wesentlich seltener.1 Die Beteiligung des Rektosigmoids wird in 6–12 % der Patientinnen mit Endometriose beobachtet.2 Durch partielle Resektion der Harnblase, Teilresektion oder Neuimplantation des Ureters und partieller oder kompletter Resektion des Colon sigmoideum, der Vagina oder des Rektums birgt die operative Behandlung der TIE das Risiko von Komplikationen. Im Zuge der steigenden Kosten und des Bedarfs an medizinischen Ressourcen ist die Messung, die Quantifizierung und der Vergleich der Versorgungsqualität und somit auch interventions-assoziierter Komplikationen essenziell. Objektive und verlässliche Aussagen zum Outcome operativer Eingriffe werden seitens Patienten als auch von sogenannten „health policy makers“ zunehmend und berechtigterweise eingefordert. Im Zuge dessen wurde von Dindo et al. eine überarbeitete und mittlerweile weltweit akzeptierte Klassifikation operationsbedingter Komplikationen vorgeschlagen.
Die Clavien-Dindo-Klassifikation teilt prinzipiell 4 Schweregrade ein und wurde erfolgreich bei über 6.000 Patientinnen und Patienten an 10 internationalen chirurgischen Zentren validiert3 (Tab. 1). Die Klassifikation korreliert signifikant mit der Komplexität des chirurgischen Eingriffs, der Hospitalisationsdauer und wurde von über 140 Chirurgen als einfach anwendbar, reproduzierbar, brauchbar und logisch beurteilt. Die Verwendung der Clavien-Dindo-Klassifikation ist daher im CORDES-Statement zur Dokumentation operativer Eingriffe bei TIE4 klar empfohlen und sollte nach Ansicht der Autoren routinemäßig und uneingeschränkt angewandt werden.
Die publizierten Häufigkeiten von Clavien- Dindo Grad III und IV bei operativer Therapie der UTE und rektovaginalen TIE variieren sehr stark und scheinen auch abhängig von Fallzahl und Arbeitsgruppe zu sein.
Betreffend der operativen Therapie der UTE ist die partielle Zystektomie bei TIE der Harnblase ein sicheres und effektives Operationsverfahren mit Clavien-Dindo-II-III-Komplikationen in 0–5 %1. In einer vom Autor publizierten Serie von 30 partiellen Zystektomien bei TIE konnten weder Rezidive noch eine „major complication“ wie Fistelbildung, Infektion oder Leakage beobachtet werden.5 Operationen des Ureters wie Ureterolyse, Uretersegmentresektion oder Ureteroneozystostomie (UNC) können ebenso zu einer Leakage, postoperativem Peritonitis-assoziiertem Ileus oder Re- Stenose bei Ureter-erhaltendem Vorgehen führen. Prinzipiell ist der Erhalt des Harnleiters unter Vermeidung einer UNC in bis zu 70 % der Patientinnen mit TIE-bedingter Obstruktion des Ureters und Hydronephrose möglich und möglicherweise sinnvoll.6 Die publizierten Raten an Re-Stenose bei Ureterolyse oder Uretersegmentresektion variieren zwischen 0–20 %, wobei Komplikationen häufiger bei langstreckiger Infiltration (über 4 cm) beobachtet wurden.7 Die Rate an Leakagen bei End-zu-End-Anastomose beträgt in der bis dato publizierten Literatur 0%–16,6 %.5–7 Obwohl die UNC als urologische Standardoperation bei Ureterstenose und HN angesehen werden kann – speziell bei langstreckiger Stenose und blasennaher Obstruktion –, ist auch sie komplikationsbehaftet. Die bis dato publizierten Fälle geben Grad-II–IV-Komplikationen in 0–41 % an.7 Eine passagere postoperative Blasenentleerungsstörung wurde in bis zu 25 %, eine Fistelbildung in bis zu 41 % beschrieben.7 Die bis dato größte publizierte Fallserie von 160 Patientinnen mit UNC bei TIE-assoziierter HN weist jedoch eine relativ niedrige Komplikationsrate von 4,4 % auf.8
Die Technik und postoperative Morbidität der Resektion der intestinalen TIE ist aktuell Gegenstand jeder Kongressveranstaltung zum Thema TIE. Prinzipiell stehen sich Shaving- Technik, Disc-Resektion und Segmentresektion gegenüber. Im Folgenden sollen nur die postoperativen Komplikationen der Darmchirurgie beleuchtet werden. Die Shaving-Technik wird in 0,03–2,2 % mit postoperativer Darmperforation und notwendiger sekundärer Ileostomie assoziiert, wobei die kumulative Gesamtrate an Darmkomplikationen mit 0,08 % (n = 4/4.568 Patientinnen) angegeben wird9; die Rate der rektovaginalen Fistelbildung zwischen 0–2,6 % (kumulative Gesamtrate 0,24 %; n = 13/5.297 Patientinnen). Dem steht die Teilresektion oder „full thickness disc resection“ gegenüber, bei welcher entweder transanal oder endoskopisch mittels Stapler oder Exzision/Naht ein rundliches Teilstück des Rektums entfernt wird. Die Disc- Resektion weist eine kumulative Gesamtrate an Fistelbildung bzw. Leakage von 3,6 % bei 372 Fällen auf, mit Raten zwischen 0–7,2 %. Ähnlich werden die kumulativen Anastomoseninsuffizienzraten und Fistelraten bei Segmentresektion mit 3,9 % bzw. 4,3 % bei 3.982 Patientinnen angegeben. Die Fallzahlen und Raten variieren jedoch stark zwischen 0–4,8 % bzw. 0–18 %.9 In einer vom Autor publizierten Serie von 102 Patientinnen mit nerven-/gefäßsparender Segmentresektion betrug die Rate an Leakagen und rektovaginaler Fistelbildung 1,9 % bzw. 0,9 %.10
Diagnostik
Möglichkeiten zur Diagnosestellung der Fistel oder Leakage bei operativer Behandlung der UTE stellen primär bildgebende Verfahren dar: wie Zystografie nach partieller Zystektomie oder UNC, intravenöse Pyelografie (IVP) mit Harnleiterdarstellung, die Computertomografie (CT) des Abdomens mit Darstellung der ableitenden Harnwege in einer Spätserie oder die Magnetresonanztomografie bzw. die Magnetresonanz-Urografie (MRT bzw. MRU) bei Verdacht auf Ureterfistel nach Ureterolyse oder Uretersegmentresektion.
Die urämische Peritonitis verläuft im Gegensatz zum Austritt von Darminhalt in das Abdomen meist langsamer und klinisch weniger auffällig. Im Zuge der peritonealen Reizung kann Abwehrspannung auftreten. Fieber und entsprechende Erhöhung der Entzündungsparameter (Leukozyten, CRP) werden früher oder später bei persistierendem Harnaustritt in das Abdomen manifest. Thermisch bedingte Läsionen treten typischerweise am Tag 4–8 postoperativ auf, während Nahtinsuffizienzen oder frische Verletzungen des Ureters bereits wenige Stunden postoperativ eine peritonitische Reizung nach sich ziehen können.
Die Klinik der Anastomoseninsuffizienz nach darmchirurgischen Eingriffen beinhaltet Zeichen einer primär pelvinen, später abdominalen Peritonitis bis zum Bild des akuten Abdomens. In Frühstadien (Tag 2–5) kann Faeces-tingierte Drainageflüssigkeit (immer riechen!) und eine Erhöhung des CRP über 150 bis 200 mg/dl, Tachykardie oder Arrhythmie sowie Ileuszeichen erste Verdachtsmomente erhärten, später weist die Patientin so gut wie immer Fieber, Abwehrschmerzen und Krankheitsgefühl auf. Auch hier korreliert die Zeitspanne zwischen Diagnosestellung und Intervention mit der komplikationsassoziierten Morbidität und auch Mortalität. Die Association of Surgeons of Great Britain and Ireland weist in ihrem Konsensuspapier zur Diagnose und Behandlung der Anastomoseninsuffizienz treffend darauf hin: „… it cannot be emphasised strongly enough that failure to make anticipated postoperative progress in any patient with a colorectal anastomosis should, above all, raise the suspicion of anastomotic leakage“ 11. Im Zuge dessen hat sich die Anwendung der „septic six criteria“ bewährt (Tab. 2). Bei Sepsis sollten mindestens 2 von 6 Kriterien vorhanden sein, während das SIRS (Systemic iInflammatory Response Syndrome) sich durch alle 6 Kriterien kennzeichnet.
Die transvaginalsonografische Darstellung des Anastomosenbereichs kann eine echoarm imponierende Flüssigkeitsansammlung aufweisen, ist jedoch wenig spezifisch. Das primär empfohlene Verfahren zur Diagnose der Anastomoseninsuffizienz ist die Kontrastmittel-gestützte (oral oder rektal) Darstellung des Anastomosenbereichs. Eine lokale Ausbildung von Lufteinschlüssen und/oder der Austritt von Kontrastmittel sind wegweisend. Es soll jedoch festgehalten werden, dass die bildgebende Abklärung einer bereits klinisch auffälligen bzw. kranken Patientin die Revision der Komplikation auch oft unnötig verzögern kann und somit nicht zwingend an erster Stelle steht.11
Interdisziplinäres Management früher Komplikationen
Es gilt prinzipiell: Je früher, desto besser. Die folgenden Empfehlungen sind nur zum Teil Leitlinien-basiert, da es zum Thema Komplikationsmanagement bei TIE-assoziierten Operationen nach Wissen der Autoren keine solchen gibt. Die Durchsicht der bis dato publizierten Arbeiten und die Empfehlung der Autoren legen bei Leakagen nach partieller Zystektomie das weitere Belassen des Harnkatheters nahe, idealerweise bis zum spontanen Verschluss der Läsion. Ebenso wird bei Verletzung des Ureters in der Regel eine Schienung bzw. JJ-Stent in den meisten Fällen ausreichen, um die Ureterovaginal-oder Abdominalfistel spontan zu verschließen. Die Dauer der Stentapplikation wird mit 6–8 Wochen angegeben. In Fällen einer frischen intraoperativen Verletzung des Ureters kann eine zusätzliche Übernähung des Defekts in Kombination mit einer Schienung erwogen werden. Bei ausgedehnten und langstreckigen Verletzungen des Ureters, Abriss oder persistierender Fistulierung nach intermittierender Schienung ist die UNC das Therapieverfahren der ersten Wahl. Besonders in solchen Situationen ist eine gute interdisziplinäre Zusammenarbeit zwischen Gynäkologie und Urologie wesentlich.
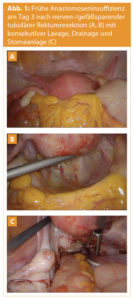
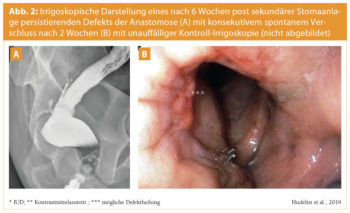
Insuffiziente Heilung der Darmanastomose zieht so gut wie immer das Anlegen einer Ileostomie sowie die lokale Lavage nach sich. In seltenen Fällen können hämodynamisch stabile Patientinnen ohne Hinweis auf Sepsis oder SIRS konservativ mittels suffizienter Flüssigkeitsgabe, intravenösen Antibiotika und engmaschiger klinischer und laborchemischer Observanz behandelt werden.11 Klinisch weisen diese Patientinnen einen verzögerten Heilungsverlauf (Mobilisierung etc.), abdominale Abwehrspannung, möglicherweise Subileus und mittelgradig erhöhte Entzündungsparameter auf. Die CT kann eine perianastomotische Flüssigkeitsansammlung ohne Kontrastmittelaustritt oder Lufteinschlüsse zeigen, welche mit sogenannten Mikroinsuffizienzen und einer geringen lokalentzündlichen Reaktion korrelieren. Eine selbstständige Heilung ist in diesen Fällen oft möglich, wobei der Übergang zur zunehmenden und interventionsnotwendigen Insuffizienz fließend sein kann. Die komplette Auflösung der Anastomose ist bei Patientinnen nach TIE sehr selten und wird öfter bei multimorbiden oder vorbestrahlten onkologischen Patientinnen zu sehen sein. Daher ist die nach Disc- oder Segmentresektion auftretende Anastomoseninsuffizienz nach TIE meist eine partielle Diskontinuität, welche frühe Lavage und Anlage einer Ileostomie erfordert (Abb. 1). Selten kann eine CT-oder TVS-gezielte Punktion und Drainage des Areals ausreichen, in ausgewählten Fällen jedoch erwogen werden. Eine Verschlechterung des Zustandsbildes nach versuchter konservativer Therapie oder versuchter Drainage soll jedoch immer die Re-Intervention, Lavage und – falls noch nicht vorhanden – Stomaanlage nach sich ziehen. An unserem Zentrum erfolgt die Rückoperation in der Regel nach 6 Wochen. Eine vorherige Darstellung des Anastomosenbereichs ist sinnvoll, um seltene persistierende Leakagen auszuschließen (Abb. 2). Eine Verlängerung des Intervalls auf weitere 4 Wochen führt meist zum spontanen und vollständigen Verschluss des Anastomosendefekts. Eine funktionierende interdisziplinäre Zusammenarbeit ist wesentliche Voraussetzung für das Management solcher Situationen.
Prävention von Komplikationen
Das Auftreten von Leakagen im Bereich der Anastomose nach kolorektalen Resektionen ist mit einer relevanten Morbidität, aber auch Mortalität verbunden. Die Leakagerate für Anastomosen auf das mittlere und obere Rektumdrittel liegt in der Literatur im einstelligen Prozentbereich, steigt aber auf bis 19,0 % bei Anastomosen, die auf das untere Rektumdrittel (innerhalb 6 cm ab ano) angelegt werden11, 12, wobei angemerkt werden muss, dass sich die Mehrzahl der Studien auf Ergebnisse der Rektumkarzinomchirurgie beziehen. Da Patientinnen mit TIE meist jünger sind und selten Komorbiditäten aufweisen, ist die Interpretation der genannten Daten unter diesem Aspekt zu sehen. Trotzdem gilt nach Ansicht der Autoren Selbiges auch für Rektumresektionen bei TIE – je tiefer die Anastomose, desto höher das Risiko für Insuffizienz oder Fistelbildung, speziell bei gleichzeitiger Eröffnung der Vagina.
Im Bezug auf präventive Maßnahmen konnte in mehreren Studien nachgewiesen werden, dass die Leakagerate durch eine präoperative orale Darmlavage in Kombination mit einer oralen antibiotischen Darmdekontamination (zumeist mit Aminoglykosiden) signifikant gesenkt werden konnte.11 Weiters scheint die Anzahl der Magazine, welche zur Rektumdurchtrennung verwendet werden, Einfluss auf die Leakagerate zu haben. So konnte in zwei Studien nachgewiesen werden, dass bei Verwendung von 3 oder mehr linearen Magazinen die Leakagerate sprunghaft (und signifikant) anstieg.13, 14 Ob durch die Verwendung der Indocyaningrün(ICG)-Fluoroskopie das Auftreten einer Leakage durch eine intraoperative Kontrolle der Darmdurchblutung verhindert werden kann, wird zurzeit untersucht. Immerhin führte eine derartige Durchblutungskontrolle in der PILLAR-II-Studie in 7,9 % der Operationen (11/139) zu einer Änderung des operativen Vorgehens, sodass bei dieser Subgruppe keine Leakage beobachtet wurden, in der gesamten ICG-Kohorte in 1,4 % der Fälle (2/139).15 Die Frage, ob eine transanale Drainage zur Druckentlastung der Anastomose die Rate an Leakage senken kann, wird seit Jahren kontrovers diskutiert. In rezenten Studien wurde durch eine derartige Entlastung in der frühen postoperativen Phase eine signifikante Reduktion der Leakagerate beobachtet. Problematischerweise werden derartige Drainagen von den Patientinnen jedoch schlecht toleriert. Sollte es im Rahmen der intraoperativen Integritätsprobe der Anastomose zu einem Luftaustritt aus dem Anastomosenbereich kommen, ist laut einer aktuellen Untersuchung an 2.360 Patienten von Mitchem et al. eine protektive Stomaanlage oder Anastomosen-Neuanlage zu empfehlen. Bei einer alleinigen Übernähung der intraoperativ detektierten Leakage kam es in 8,8 % (6/68) der Fälle in weiterer Folge zu einer Leakage.16
Schlussendlich stellt die Erfahrung und damit abhängige Fallzahl an ausgedehnten Interventionen einen möglichen Risikofaktor für Komplikationen dar. Die französische Arbeitsgruppe Endometriosechirurgie FRIENDS konnte in einer aktuellen Publikation klar zeigen dass eine „volume activity per year“ von mindestens 20 kolorektalchirurgischen Eingriffen bei TIE pro Zentrum mit einer individuellen Fallzahl pro Operateur von mindestens 7–13 ausgedehnten Operationen/Jahr die Mindestanzahl darstellt, um eine akzeptable Komplikationsrate zu erzielen. Diese Empfehlungen decken sich mit unserer Erfahrung und einer Fallzahl von etwa 50 Rektumresektionen bei TIE pro Jahr.10