Teil III: Frakturrisiko – Diagnostik und Therapie der Osteoporose*
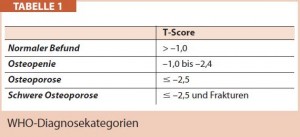
Densitometrie: Die Densitometrie, genauer die Dual-energy X-ray Absorptiometry (DXA), steht zweifellos im Zentrum der Osteoporose-Diagnostik, denn eine niedrige Knochendichte (Bone Mineral Density, BMD) ist einer der wichtigsten Risikofaktoren für osteoporotische Frakturen. So wichtig, dass die Weltgesundheitsorganisation (WHO) die Osteoporose seit 1992 über die BMD definiert und in der Folge die bis heute allgemein gebräuchliche Einteilung in so genannte Diagnosekategorien getroffen hat (Tab. 1).
Diese Kategorisierung ist in der Praxis eine große Hilfe, sowohl bei Therapieentscheidungen als auch bei der Kommunikation mit den Patientinnen. Leider birgt sie die Gefahr in sich, als „absolutistische“ Größe verkannt zu werden. Die Sozialversicherungspolitik (Kostenerstattung) unterstützt diesen Irrglauben und legt sich fest: bezahlt wird eine Therapie nur bei einem T-Wert von ≤ minus 2,5! Das kann fatale Folgen haben; denn andere Risikofaktoren nicht zu berücksichtigen, weil die BMD im osteopenischen oder normalen Bereich liegt, heißt etwa 80 % aller osteoporotischen Frakturen – und etwa 75 % der Hüftfrakturen – hinzunehmen, ohne an weitere diagnostische Maßnahmen und therapeutische Interventionen zu denken!
Der T-Wert gibt die Knochendichte der Patientin in Standardabweichungen von der „peak bone mass“ der Referenzbevölkerung an; gemessen entweder an der Lendenwirbelsäule oder am proximalen Femur. Die Referenzbevölkerung sind „junge Erwachsene“ zwischen dem 20. Und 40. Lebensjahr in der jeweiligen Region. Zu beachten ist, dass die Verwendung der T-Werte als Grundlage für Therapieentscheidungen nur für die DXA evidenzbasiert ist, nicht aber für die quantitative Computertomographie (QCT). Diese ist auch wegen der schwierig zu reproduzierenden Abgrenzung der Messregionen, der hohen Strahlenbelastung und der hohen Kosten für die Anwendung im Routinebetrieb abzulehnen. Die Stärke der QCT ist die differenzierte Beurteilung von trabekulärem und kortikalem Knochen im Rahmen wissenschaftlicher Untersuchungen.
Bei der Interpretation der Messergebnisse von DXA-Scans kann man in einige Fallen tappen. Angefangen von lagerungsbedingten Fehleinstellungen des Femurs und der Wirbelsäule über das Nichterkennen extravertebraler Ossifikationen bis zu der falschen Zahl und Auswahl der bewerteten Wirbelkörper kann bei der Befundung einiges schieflaufen. Es empfiehlt sich deshalb, die einschlägigen Leitlinien zu beachten und schwierig zu beurteilende Scans erfahrenen Mitarbeitern zu überlassen; denn die Zunahme unverwertbarer Befunde, die zu falschen Schlussfolgerungen und falschen Therapien führen, ist unübersehbar.
Deshalb lässt man die DXA besser an Zentren durchführen, die erstens mit der Synopse aller relevanten Daten aus Anamnese, Labor und BMD eine professionelle Risikoanalyse erstellen und die zweitens, weil sie z. B. auch als internationale Studienzentren fungieren, sich strengen internen und externen Qualitätskontrollen unterziehen. Nur dort lässt sich unter Berücksichtigung des individuellen Nutzen-Risiko-Profils der jeweiligen Patientin eine sinnvolle Therapieempfehlung abgeben bzw. dortselbst eine effiziente Therapie durchführen.
Anamnese: Ein Großteil wichtiger Risikofaktoren kann anam – nestisch erfasst werden; dazu gehören zahlreiche Erkrankungen und Nebenwirkungen von Medikamenten (Tab. 2 und 3). Typisch für die gynäkologische Praxis sind endokrine Funktionsstörungen, von der späten Menarche bis zur vorzeitigen Menopause, von der Essstörung bis zur Hyperprolaktinämie und von der 3-Monats-Spritze in der Kontrazeption bis zu den Aromataseinhibitoren in der Brustkrebstherapie. Allen gemeinsam ist der entweder idiopathische oder induzierte Östrogenmangel, der sich häufig als Oligo- oder Amenorrhö präsentiert und neben anderen Konsequenzen einen mehr oder weniger stark beschleunigten Knochenabbau zur Folge hat. Der Knochenmasseverlust durch Bewegungsmangel und Essstörungen bei Jugendlichen ist ein zunehmend ernstes Problem. Wenn der Knochenstoffwechsel bereits in der Jugend und Adoleszenz empfindlich gestört ist, wird die durchschnittliche „peak bone mass“ nicht erreicht und das Risiko für Frakturen steigt schon prämenopausal deutlich an. So haben Patientinnen mit Anorexia nervosa bei einer durchschnittlichen Erkrankungsdauer von 6 Jahren eine 7-mal höhere Frakturrate als Gesunde.
Die Höhe der „peak bone mass“ sollte deshalb gemeinsam mit anderen Faktoren die Entscheidungen für therapeutische Interventionen beeinflussen. Die BMD soll in diesen Fällen schon bei Jugendlichen gemessen werden, wobei vor dem 20. Lebensjahr eine spezielle Software notwendig ist. Zu beachten ist, dass prämenopausal der Z-Score die stärkste Aussagekraft hat. Die Befunde selbst und ihre Interpretation sind für die Motivation zur Therapie der Anorexie und des sekundären Knochenschwundes, für das Therapie-Monitoring und für die Förderung der Compliance von nicht zu unterschätzender Bedeutung. Depotmedroxyprogesteronacetat, z. B. in Form der zur Kontrazeption verfügbaren 3-Monats-Spritze, induziert eine verstärkte Knochenresorption und erfordert bei längerer Anwendung und bei der Anwendung in der Adoleszenz eine Überwachung mittels DXA und Knochenumbaumarkern.
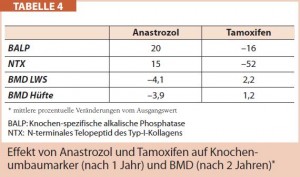
Aromataseinhibitoren, deren breiter Einsatz im Rahmen der Mammakarzinomtherapie die Prognose der Erkrankung deutlich verbessert hat, haben aufgrund ihrer rigorosen Östrogendepletion einen ungünstigen Einfluss auf den Knochenstoffwechsel. Im Gegensatz zum früher häufig verwendeten selektiven Östrogenrezeptor- Modulator (SERM) Tamoxifen, der eine Östrogen-analoge Wirkung auf den Knochen hat, können Aromataseinhibitoren, wie Anastrozol, schon innerhalb weniger Monate die BMD signifikant senken und das Frakturrisiko erhöhen. Deshalb sollen mit Aromataseinhibitoren behandelte Patientinnen engmaschig mittels DXA und Knochenumbaumarkern kontrolliert werden, um bei Bedarf rechtzeitig mit einer antiresorptiven Therapie beginnen zu können (Tab. 4).
Frauen mit vorzeitiger Menopause haben als Folge des länger andauernden Östrogendefizits ebenfalls ein erhöhtes Osteoporoserisiko und sollten unbedingt präventiv-therapeutisch vor osteoporotischen Frakturen geschützt werden. Hier ist eine Hormonsubstitution (Hormone Replacement Therapy – HRT) in den meisten Fällen das Mittel der ersten Wahl (die HRT ist nicht Gegenstand dieser Ausführungen und wird anderswo abgehandelt). Allerdings wird heutzutage diese in vielen Fällen ideale Form der Prävention zu selten angewendet, weil sich die zwar irrige aber weit verbreitete Ansicht, dass jede HRT mit schädlichen Nebenwirkungen einhergehen würde, hartnäckig hält. Wird aber die Prävention vernachlässigt, steigt die Zahl der Frauen, die später eine Therapie mit knochenspezifischen Medikamenten benötigen, an.
Einige der anamnestisch fassbaren Risikofaktoren bilden die Grundlage für ein computergestütztes Programm, dem ein Algorithmus mit einer Gewichtung der einzelnen Faktoren zugrunde liegt (Fracture Risk Assessment Tool – FRAX). Dieses Programm erlaubt bei 40- bis 90-jährigen Personen die quantitative Einschätzung des Risikos für osteoporotische Frakturen innerhalb der folgenden 10 Jahre. Berücksichtigt werden Lebensalter, Geschlecht, Gewicht, Größe, vorangegangene Frakturen, Hüftfraktur bei einem (oder beiden) Elternteilen, Rauchen, Therapie mit Glukokortikoiden, rheumatoide Arthritis, eine Reihe anderer sekundärer Osteoporoseursachen (z. B. Diabetes, Hyperthyreose, prämature Menopause), Alkoholkonsum (_ 3 Einheiten/Tag) und die mittels DXA gemessene BMD am Oberschenkelhals.
FRAX ist in den vergangenen Jahren zu einem brauchbaren Hilfsmittel der Diagnostik avanciert, hat aber auch beträchtliche Schwächen; z. B. werden wichtige Risikofaktoren, wie der Vitamin-D-Mangel, das Sturzrisiko (im australischen Garvan Calculator wird es z. B. berücksichtigt) und die BMD an der Wirbelsäule nicht mit einbezogen; außerdem ist FRAX nur bei unbehandelten Patientinnen anwendbar.
Klinische Untersuchung: Die klinische Untersuchung besteht in erster Linie aus der Inspektion der Patientin. Eine fortgeschrittene Osteoporose mit Wirbelkörpereinbrüchen führt zu einer Abnahme der Körpergröße und zur Kyphose der Brustwirbelsäule (Rundrücken). Dadurch verringert sich der Abstand zwischen Crista iliaca und Rippenbogen und es kommt zu einer Vorwölbung des Abdomens. Die von der Medianen nach lateral und kaudal ziehenden Hautfalten am Rücken erinnern an die schweren Zweige einer Tanne (Tannenbaum-Phänomen).
Röntgen: Lange vor diesen unübersehbaren äußeren Zeichen multipler Wirbelkörperfrakturen können im Röntgen diskrete Veränderungen in Form von Deckplatteneinbrüchen erkannt werden. Den ersten Hinweis auf eine Fraktur erhält man meis – tens bei der Auswertung des DXA-Scans durch eine im Vergleich mit den anderen Wirbeln höhere Dichte im Bereich der Fraktur. In der seitlichen Aufnahme lassen sich Form (bikonkave -, Keil- oder Kompressionsfraktur) und Schweregrad (mild, moderat, schwer) der Deformierung(en) gut darstellen und mit einem Score (nach Genant) quantifizieren.
Nach der ersten Fraktur sind ohne adäquate Therapie weitere Frakturen vorprogrammiert: in einer Metaanalyse von knapp 45.000 Frauen war das Risiko dafür um fast 90 % erhöht. Etwa die Hälfte der Frauen mit einer Hüftfraktur hatte vor dieser bereits eine Fragilitätsfraktur erlitten.
Laboruntersuchungen haben in der Diagnostik und Therapie der Osteoporose stark an Bedeutung gewonnen. Sie liefern nicht nur wertvolle Hinweise auf sekundäre Ursachen, sondern haben auch ihren festen Platz im Therapiemonitoring. Dort können sie wesentlich zu einer besseren Adhärenz und Compliance beitragen, wenn sie, ähnlich wie die Ergebnisse der DXA, in anschaulicher Weise mit den Patientinnen kommuniziert werden.
Die Auswahl der zu bestimmenden Parameter wird in erster Linie vom Risikoprofil der jeweiligen Patientin, ihrer Vorgeschichte, ihrem Beschwerdebild und den DXA-Werten abhängen. Relativ oft pathologisch und deshalb besonders zu beachten sind z. B. Schilddrüsenparameter, Sexualhormonspi e g e l bzw. Gonadotropine, Serum-Kalzium und -Phosphat, alkalische Phosphatase, Kreatinin, glomerulare Filtrationsrate, Knochenumbaumarker (Resorptions- und Formationsmarker), Parathormon und 25-OH-Vitamin D.
Besonders verbreitet, bei etwa 80 % unserer Patientinnen, ist ein Vitamin-D-Mangel, der häufig auch mit einem sekundären Hyperparathyreoidismus einhergeht. Ältere Patientinnen haben oft eine reduzierte Nierenfunktion (reduzierte Kreatinin-Clearance bzw. glomeruläre Filtration, erhöhtes Kreatinin), die die Möglichkeiten der medikamentösen Therapien einschränkt. Bei einer Niereninsuffizienz (Kreatinin-Clearance < 35 ml/min) sind die meisten antiresorptiv wirkenden Substanzen, z. B. Bisphosphonate, kontraindiziert. Einzig der monoklonale Antikörper Denosumab, der nicht über die Niere ausgeschieden wird, ist davon nicht betroffen und soll diesen Patientinnen ver – abreicht werden. Eine bestehende Hypokalzämie muss vor Beginn jeder Osteoporosetherapie ausgeglichen werden. Die Knochenumbaumarker, z. B. die Crosslaps (CTX) als Resorptions- und das Osteocalcin als Formationsmarker, sind für das Therapiemonitoring von besonderer Bedeutung. Schon nach kurzer Zeit (Tage bis Wochen) lässt sich die Effizienz einer antiresorptiven Therapie an einem signifikanten Absinken der Marker erkennen, wobei der intraindividuelle Vergleich mit den Werten vor Therapiebeginn von wesentlich größerer Aussagekraft ist als das Absinken unter populationsbezogene Normalbereiche.
Therapie**
Die Mehrzahl der zur der Therapie der Osteoporose geeigneten Substanzen wirkt über eine Hemmung der Resorption dem Knochenschwund entgegen. Dazu gehören Bisphosphonate, SERMs und das Biologikum Denosumab. Zwei Substanzen, das Parathormon und sein Derivat Teriparatid, wirken anabol und induzieren die Formation neuen Knochens. Strontiumranelat hat sowohl antiresorptive als auch anabole Eigenschaften.
Bisphosphonate stehen in oralen und intravenösen Applikationsformen zur Verfügung. Sie haben eine starke Bindungsaffinität zu den Kalziumhydroxylapatit-Kristallen des Knochens, an denen sie sich ablagern und auf diese Art die Osteoklasten an der Resorption hindern. Bisphosphonate senken die Inzidenz vertebraler und nicht-vertebraler Frakturen inklusive Hüftfrakturen.
Die für die orale Applikation geeigneten Wirkstoffe sind Alendronat und Risedronat. Beide werden einmal wöchentlich eingenommen. Da nur ein Bruchteil, weniger als ein Prozent, der verabreichten Dosis resorbiert wird und häufig gastrointestinale Nebenwirkungen auftreten, sollen die Einnahmemodalitäten genau befolgt werden: mindestens eine halbe Stunde vor der ersten Aufnahme von Nahrung, Getränken oder anderen Arzneimitteln mit Wasser die ganze Tablette schlucken und nicht mehr hinlegen.
Die parenterale Applikation erfolgt entweder 1-mal alle 3 Monate als intravenöse Injektion (Ibandronat) oder 1-mal pro Jahr als Infusion (Zoledronat). Die Nebenwirkungsrate während und nach der jährlichen Infusion ist relativ hoch und kann für die Patientinnen besonders unangenehm sein: grippeartige Beschwerden, Fieber, Kopfschmerzen, Übelkeit, Knochen-, Muskel- und Gelenkschmerzen etc. Die immer wieder angeführten Kiefernekrosen hingegen sind während der Osteoporose-Therapie außerordentlich selten. Sie werden in erster Linie bei onkologischen Patientinnen, z. B. mit multiplem Myelom, die Bisphosphonate in viel höherer Dosierung erhalten, beobachtet. Schon eher könnte es in Zukunft zu einem Anstieg der derzeit ebenfalls sehr seltenen atypischen Femurfrakturen, die vereinzelt nach langjähriger Anwendung auftreten, kommen. Sie dürften auf die außerordentlich lange, nicht beeinflussbare Verweildauer der Bisphosphonate im Knochen und der daraus resultierenden schlechten Steuerbarkeit zurückzuführen sein. Ein kausaler Zusammenhang ist jedoch nicht belegt.
SERMs: Die beiden zur Osteoporosetherapie zugelassenen selektiven Östrogenrezeptor-Modulatoren (SERMs) Raloxifen und Bazedoxifen (letzterer ist in Österreich nicht im Warenverzeichnis) agieren abhängig vom Zielgewebe entweder als Östrogenagonisten oder -antagonisten. Sie werden 1-mal täglich oral verabreicht. Obwohl ihr Wirkmechanismus nicht bis ins Detail geklärt ist, kann man davon ausgehen, dass der selektive Effekt durch die Dominanz einer über die andere Östrogenrezeptor-( ER)-Isoform, ER-_ und ER-_, in den Zielgeweben reguliert wird. Die agonistische Wirkung wird demnach erzielt, wenn die Interaktion mit dem ER-_ dominiert, die antagonistische Wirkung bei einer dominierenden Interaktion mit dem ER-_. Diese gewebespezifischen Effekte der SERMs erklären ihren Beitrag zur Osteoprotektion, der vor allem in einer Senkung der Inzidenz von Wirbelkörperfrakturen besteht, und ihre gleichzeitig schützende Wirkung vor dem Rezeptor-positiven Mammakarzinom. Typische Östrogen-agonistische Effekte sind auch die Erhöhung der venösen Thrombose- und Schlaganfallinzidenz, die einen Ausschlussgrund für die Therapie von Risikopatientinnen darstellen.
Parathormon und Teriparatid: Die anabole Wirkung von Parathormon (PTH) und seinem aktiven aminoterminalen Fragment, dem PTH-Analogon Teriparatid, ist durch seinen speziellen Applikationsmodus möglich. Denn während die kontinuierliche systemische Exposition, mit der wir beim Hyperparathyreoidismus konfrontiert sind, zu einer gesteigerten Differenzierung von Osteoklasten und einer verstärkten Knochenresorption führt, bewirkt die intermittierende Verabreichung über eine Stimulation der Osteoblastenaktivität die Formation neuen Knochengewebes. Sie werden 1-mal täglich subkutan für maximal 2 Jahre appliziert und sollen dann von einer antiresorptiven Behandlung abgelöst werden. Die Kostenerstattung in Österreich erfolgt nur dann, wenn unter laufender antiresorptiver Therapie Frakturen aufgetreten sind. Beide Präparate senken die Inzidenz weiterer vertebraler und nicht-vertebraler Frakturen.
Strontiumranelat: Seit mehreren Jahren ist eine Substanz verfügbar, die antiresorptive und anabole Eigenschaften in sich vereint: Strontiumranelat hemmt die Osteoklastendifferenzierung und -aktivität und fördert gleichzeitig die Replikation von Präosteoblasten und die Differenzierung zu Osteoblasten. Der anabole Effekt zeigt sich als verstärkte Kollagen Typ I-Synthese und Matrixmineralisation und resultiert in einer raschen Zunahme der BMD und einer Senkung der Inzidenz vertebraler und nicht-vertebraler Frakturen inklusive Hüftfrakturen. Strontiumranelat-Granulat wird als Suspension 1-mal täglich, vorzugsweise zwei Stunden nach der letzten Mahlzeit vor dem Zubettgehen eingenommen. Bei Patientinnen mit erhöhtem Risiko für venöse Thromboembolien soll das Präparat mit Vorsicht angewendet werden.
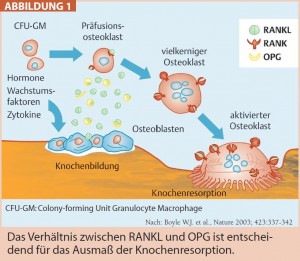
Denosumab: Die neueste antiresorptiv wirkende Substanz der Osteoporosetherapie heißt Denosumab. Denosumab ist ein monoklonaler RANKL-Antikörper (RANKL – Receptor Activator of NF-_B Ligand). Es bindet, wie das körpereigene Osteo – protegerin (OPG), den RANKL, bevor dieser an seinem Rezeptor RANK andocken kann, um die von den Osteoklasten zu exekutierende Knochenresorption einzuleiten. RANK wird u. a. an den Zellmembranen der Osteoklasten-Vorläuferzellen und den Osteoklasten selbst exprimiert. Präfusionsosteoklas – ten, die einkernigen Präkursoren, fusionieren durch die RANKRANKL- Bindung zu mehrkernigen inaktiven Osteoklasten, die durch die gleiche Signalinduktion zu aktivierten Osteoklasten transformiert werden. OPG, der natürliche körpereigene Gegenspieler, fängt RANKL ab, hemmt die Bildung, die Funktion und das Überleben der Osteoklasten und folglich die Knochenresorption (Abb. 1).
OPG wird, wie RANKL auch, von OPG wird, wie RANKL auch, von Osteoblasten synthetisiert. Bei gesunden prämenopausalen Frauen besteht ein Gleichgewicht der beiden Gegenspieler, woraus ein physiologischer Knochenmetabolismus resultiert, in dem sich Knochenresorption und -formation die Waage halten. Östrogene sind u. a. dafür verantwortlich, dass OPG und RANKL in einem harmonischen Verhältnis zueinander stehen und der resorbierte Knochen durch neuen ersetzt werden kann. Das postmenopausale Östrogendefizit veränderte die Syntheseleistung der Osteoblas – ten entscheidend: es werden vermehrt RANKL und vermindert OPG produziert, wodurch die Bildung, die Funktion und das Überleben der Osteoklasten gefördert werden und die Knochenresorption gegenüber der -formation deutlich überwiegt. Das führt zu einer Abnahme der BMD und einer Zunahme der Frakturinzidenz.
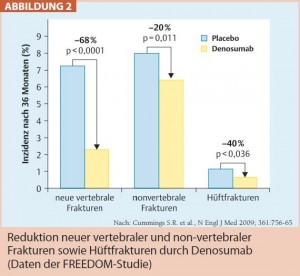
Der vollhumane monoklonale Antikörper Denosumab, ein Polypeptid, fungiert als OPG-Ersatz und wird wie dieses metabolisiert, d. h. es wird wie andere Polypeptide durch intrazelluläre Spaltung abgebaut. Deshalb wird seine Ausscheidung bei reduzierter Nierenfunktion oder Leberfunktionsstörungen nicht beeinträchtigt, und eine Dosisanpassung erübrigt sich. Im Gegensatz zu anderen Antiresorptiva, die bei eingeschränkter Nierenfunktion nur mit erhöhter Vorsicht und bei Niereninsuffizienz nicht angewendet werden dürfen, kann Denosumab auch bei der großen Gruppe der davon betroffenen Frauen in der üblichen Dosis verabreicht werden. Die für die Osteoporosetherapie übliche Dosis von 60 mg wird subkutan 1-mal alle 6 Monate injiziert. Sie reicht aus, um die Knochenresorption effizient zu hemmen und eine signifikante Zunahme der BMD im Bereich der LWS und der Hüftregion sowie eine signifikante Senkung vertebraler und nicht-vertebraler Frakturen inklusive Hüftfrakturen zu erzielen. Die Wirkung von Denosumab konnte in mehreren Studien nachgewiesen werden. In der FREEDOM-Studie (Fracture REduction Evaluation of Denosumab in Osteoporosis every six Months) wurde bei knapp 8.000 postmenopausalen Frauen im Alter von 60–90 Jahren nach 3 Jahren Denosumab in der üblichen Dosierung (60 mg s. c. alle 6 Monate) das Auftreten neuer vertebraler, nicht-vertebraler und Hüftfrakturen gegenüber Placebo signifikant gesenkt (Abb. 2).
In der DECIDE-Studie (Determining Efficacy: Comparison of Initiating Denosumab vs. Alendronate) wurden „head to head“ die Veränderungen der BMD nach 12 Monaten Denosumabvs. Alendronat-Therapie (70 mg/Woche) bei knapp 1.200 postmenopausalen Frauen verglichen. In allen 5 Messregionen (Hüfte gesamt, Trochanter, Schenkelhals, Lendenwirbelsäule und distaler Radius) war der Anstieg der BMD unter Denosumab signifikant höher. Auch in der STAND (Study of Transitioning from AleNdronate to Denosumab), in der mit Alendronat (durchschnittlich 3 Jahre lang) vorbehandelte postmenopausale Frauen randomisiert entweder weiter Alendronat oder Denosumab für ein weiteres Jahr erhielten, war die Zunahme der BMD unter Denosumab signifikant höher. Denosumab ist nicht nur wegen seiner guten Wirkung, sondern auch wegen seiner geringen Nebenwirkungsrate und seiner Patientinnen-freundlichen Anwendung eine besonders interessante Therapieoption. In der Studie mit den meisten Teilnehmerinnen, der FREEDOM-Studie, unterschieden sich die meisten unerwünschten Ereignisse in der Placebo- und der Denosumab-Gruppe nicht voneinander. Signifikant häufiger, insgesamt jedoch selten, waren in der Denosumab-Gruppe Ekzeme (3,0 % vs. 1,7 %), Flatulenz (2,2 % vs. 1,4 %) und Weichteilinfektionen bzw. Erysipele (0,3 % vs. < 0,1 %). Signifikant häufiger in der Placebogruppe waren Stürze (5,7 % vs. 4,5 %). Vor Therapiebeginn muss eine Hypokalzämie ausgeschlossen werden, und ein eventuell bestehender Vitamin-DMangel behandelt werden.
Die meisten Frauen bevorzugen die halbjährliche subkutane Injektion gegenüber anderen derzeit verfügbaren Therapieoptionen. Das lässt, gemeinsam mit der guten Verträglichkeit und Wirksamkeit, eine bessere Compliance als mit anderen Präparaten erwarten und kann entscheidend zum Erfolg der Behandlung beitragen.
ZUSAMMENFASSUNG: Das in den vergangenen 20 Jahren akkumulierte Wissen und das bessere Verständnis der komplexen Zusammenhänge des Knochenmetabolismus haben zu einem dynamischen Wandel in der Diagnostik und Therapie der Osteoporose geführt. Da sich ein Großteil aller osteoporotischen Frakturen bereits im osteopenischen und normalen Knochendichtebereich ereignet, gilt es möglichst viele von der BMD unabhängige Risikofaktoren zu erfassen, um das individuelle Risiko einer Patientin genauer einschätzen zu können. Computergestützte Programme wie FRAX können dabei hilfreich sein. Jedenfalls müssen die mittels DXA erhobenen BMD-Werte immer in Synopse mit anamnestischen und Labordaten beurteilt werden. Die Tücken der Diagnostik und die falsche Einschätzung des Frakturrisikos führen in der Praxis allzu häufig zur Unterlassung notwendiger therapeutischer Interventionen. Die meisten Frauen erhalten nicht einmal im ersten Jahr nach einer osteoporotischen Fraktur eine Behandlung. Dabei steht eine Reihe potenter Pharmaka zur Verfügung, die bei fachgerechter Anwendung das Auftreten von (weiteren) Frakturen um 40 % bis 70 % reduzieren können. Von jenen Frauen, die mit einer Osteoporosetherapie beginnen, führen weniger als 50 % diese länger als ein Jahr fort. Insbesondere die orale Bisphosphonattherapie setzen viele Patientinnen schon kurz nach Behandlungsbeginn wieder ab. Das liegt unter anderem an der relativ hohen Nebenwirkungsrate und der unpraktischen Art der Anwendung. Die neueren Therapieoptionen können hier Abhilfe schaffen. In erster Linie die Behandlung mit dem Biologikum Denosumab, das kaum Nebenwirkungen verursacht und nur alle 6 Monate subkutan verabreicht werden muss, lässt eine deutlich bessere Compliance und Effizienz der Osteoporosetherapie erwarten.