Akute Zystitis
In den vergangenen Jahren wurden im Bereich der Inneren Medizin Anstrengungen unternommen, Leitlinien für die Behandlung des akuten Harnwegsinfektes (HWI) zu implementieren. Die folgende Zusammenfassung basiert vor allem auf diesen Leitlinien (Wagenlehner et al., AWMF-Register-Nr. 043/044) und einem rezenten Konsensustreffen zu diesem Thema.
Definition der Harnwegsinfektion
Komplizierter Harnwegsinfekt: Im Harntrakt liegen funktionelle oder anatomische Anomalien vor und der Krankheitsverlauf wird durch andere relevante Erkrankungen (Nierenfunktionsstörung, Diabetes mellitus, Immunsuppression) beeinflusst. Ein Harnwegsinfekt kann sporadisch, sporadisch akut, rezidivierend (≥ 2 in 6 Monaten oder ≥ 3 in einem Jahr) oder chronisch auftreten. Bei Zystitis (unterer Harnwegsinfekt) ist die akute Symptomatik nur auf den unteren Harntrakt begrenzt. Bei einer Pyelonephritis kommen Flankenschmerz, klopfschmerzhaftes Nierenlager und/oder Temperaturerhöhung über 38°C hinzu. Die akut lebensbedrohliche Urosepsis entwickelt sich meist als Folge eines komplizierten Harnwegsinfektes.
Aufgrund fortbestehender Unklarheiten bei Diagnostik und Therapie wurden S3-Richtlinien „Harnwegsinfektion“ erstellt (Fünfstück et al., DMW 2012).
Entstehung und Verlauf von Harnwegsinfekten
Die Adhärenz von Bakterien am Urothel setzt spezifische Eigenschaften, wie z. B. Fimbrien und Pili bzw. nichtfimbrielle Adhäsine voraus. Einige dieser Adhäsine vermitteln auch die Internalisation in das Uroephithel. Nester von intrazellular persistierenden Bakterien können eine Quelle für rezidivierende Infektionen sein. Toxine wie E-Hämolysin beeinflussen die Signaltransduktion, modulieren das Abwehrverhalten des Wirtes (Zelle) und induzieren auch den Untergang von Uroepithel (Apoptose, Nekrose).
Siderophore wie Enterobactin u. a. binden mit hoher Affinität Eisen, das ein essenzieller Kofaktor vieler Enzyme ist und daher für das Überleben uropathogener Mikroorganismen eine Rolle spielt. Dies soll in der Praxis bei begleitender Eisentherapie entsprechend beachtet werden.
Die Expression verschiedener Pathogenitätsfaktoren ist strikt reguliert und wird durch genetische Determinanten kodiert. Dadurch können sich potenzielle Infektionserreger einerseits an wirtsspezifische Abwehrfunktionen adaptieren und andererseits bei deren Störung eine Infektion auslösen.
Seit einigen Jahren sind Toll-like-Rezeptoren Gegenstand von Untersuchungen zur Entstehung von HWI geworden. Toll-like-Rezeptoren sind wichtig zur Identifikation in den Harntrakt eingedrungener Infektionserreger. Sie erkennen bestimmte Erregermoleküle und induzieren Inflammation zur Infektabwehr (z. B. Toll-like Rezeptor 4; TLR4) (Gluba, Nat Rev Nephrol 2010). Eine geringe TLR4-Aktivität ist mit der Entwicklung einer asymptomatischen Bakteriurie assoziiert. Das von den Epithelzellen produzierte CXCL8 reguliert die Invasion von CXCR1-tragenden Makrophagen und Granulozyten unmittelbar am Infektionsort. Niedrige Konzentrationen auf den Abwehrzellen sind mit einer erhöhten Inzidenz von akuter Pyelonephritis assoziiert.
Letztendlich besitzt auch das Tamm-Horsfall-Protein Mannosestrukturen, die als Liganden für Typ-1-Fimbrien fungieren. Über diese Bindung können uropathogene E.-coli-Stämme aus dem Harntrakt eliminiert werden. In Zusammenschau gibt es bereits einige Aufklärungsarbeit über die Pathogenese des HWI. Die neuen Erkenntnisse erklären die unterschiedlichen Empfindlichkeiten der Patienten gegenüber Erregern.
Die Manifestation und der Verlauf eines HWI werden von der Pathogenität und Virulenz der Erreger einerseits und der Effektivität wirtsspezifischer Abwehrmechanismen andererseits beeinflusst. Anatomische Anomalien sowie Erkrankungen, die die körpereigene Abwehr stören, müssen erkannt werden, da sie den Therapieerfolg maßgeblich beeinflussen (Fünfstück et al., DMW 2012).
Diagnostik
Eine symptombezogene klinische Untersuchung sollte immer bei Erstmanifestation, bei Pyelonephritis und vor allem bei Verdacht auf einen komplizierten Krankheitsverlauf erfolgen. Für eine Urinuntersuchung wird Mittelstrahlharn gewonnen, am besten der erste Morgenharn. Im Idealfall liegen zwischen der Gewinnung der Harnprobe und der letzten Miktion 4 Stunden. Die Reinigung der Genitalregion erfolgt nur mit Wasser (Seife und Antiseptika stören die Kultivierbarkeit). Bei eindeutiger Anamnese ist eine Harnuntersuchung auch aus dem Spontanharn möglich. Bei unklaren mikrobiologischen Befunden oder rezidivierender unklarer Leukozyturie ist die Gewinnung mit Einmalkatheter vertretbar. Urinproben sind unverzüglich zu bearbeiten. Ist dies nicht möglich, dann sollen die Probe bei 4–8 °C gelagert werden. Ein Harnteststreifen ist gut zum Nachweis einer Leukozyturie oder der Nitritreaktion geeignet. Durch verschiedene Faktoren ist jedoch das Ergebnis beeinflussbar (Vitamin C, Urobilinogen, Proteinurie, Glukosurie). Der Nitrittest fällt bei 92 % der gramnegativen und bei 20 % der grampositiven Erreger positiv aus. Ein sicheres Testergebnis ist meist erst nach einer Blasenverweilzeit der Bakterien von über 4 Stunden zu erwarten. Bei Pollakisurie steigt daher das Risiko eines falsch negativen Befundes. Der Nachweis von Erythrozyten und Proteinurie als Folge der Infektion ist typisch, sollte aber bei Persistenz nach abgeklungenem Infekt weiter verfolgt werden.
Ein HWI kann mittels Harnmikroskopie bei entsprechender Erfahrung weitestgehend bewiesen oder ausgeschlossen werden (Harnsediment). Die Indikation zur Harnkultur soll in Abhängigkeit vom klinischen Befund getroffen werden. Wegen der stark gestiegenen Prävalenz resistenter Erreger auf Cotrimoxazol und Fluorchinolone ist selbst bei ambulant erworbenen Harnwegsinfekten die Bedeutung der Harnkultur gestiegen. Ein Harnkultur-Screening ist bei einer asymptomatischen Bakteriurie nicht gerechtfertigt. Ausnahmen stellen Schwangerschaft, Zustand nach Organtransplantation (innerhalb der ersten 6 Monate nach Nierentransplantation) und traumatisierende Eingriffe im Bereich der Harnwege dar.
Das Ausmaßes der Entzündung kann anhand von CRP und Blutbild beurteilt werden. Bei vorbestehender Niereninsuffizienz sollte eine Bestimmung der Nierenfunktion durchgeführt werden. Als bildgebende Verfahren zur Diagnostik eignen sich zur Abklärung komplizierender Faktoren primär die Sonographie, ansonsten CT- oder MR-Untersuchung. Die i. v. Urographie ist durch diese Untersuchungen großteils abgelöst worden.
Zusammenfassend ist festzuhalten, dass bei typischer Anamnese und klinischer Symptomatik (Dysurie, Pollakisurie, imperativer Harndrang) eine routinemäßige mikrobiologische Untersuchung bei sonst gesunden, nichtschwangeren Frauen nicht erforderlich ist. Unentbehrlich ist eine Harnkultur zur Erregeridentifikation und Sensibilitätstestung bei komplizierten und chronischen Harnwegsinfekten. Zum Ausschluss einer Harnstauung bzw. einer Obstruktion im Bereich der Harnwege gilt die Sonographie als das primäre Verfahren (Fünfstück et al., DMW 2012).
Therapie
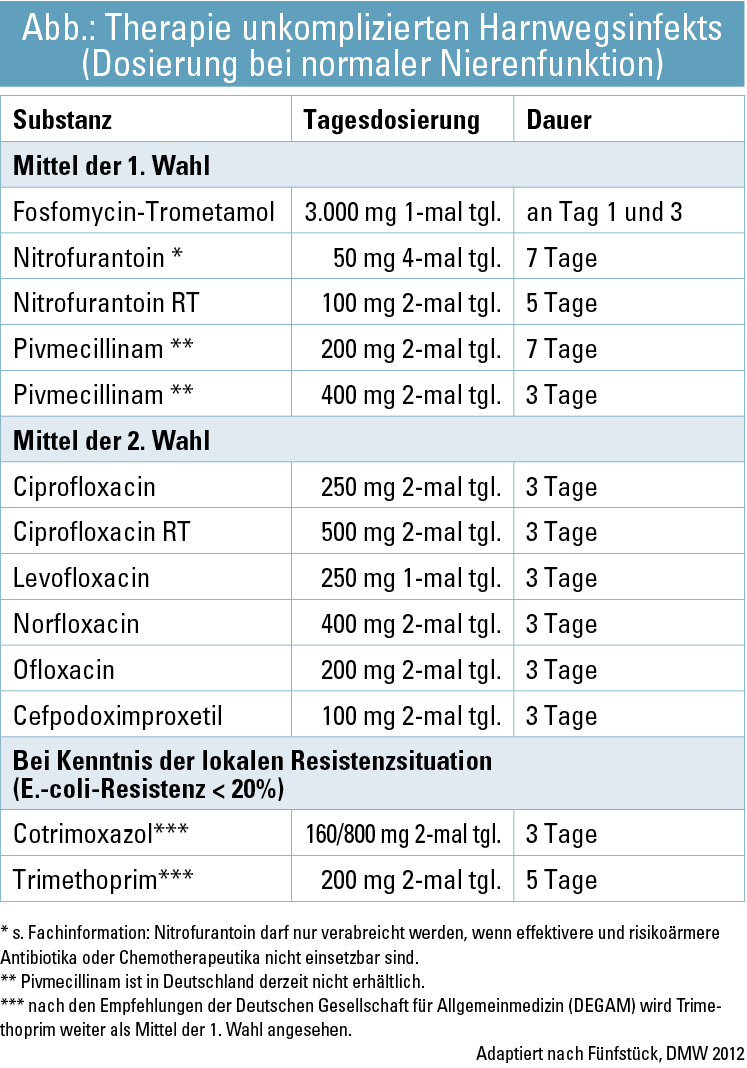
Eine unkomplizierte akute Zystitis weist eine Spontanheilungsrate von 30–50 % auf (Ferry, Scand J Prim Health Care 2007). Unter einer antimikrobiellen Therapie klingen die Beschwerden aber nicht nur rascher ab, diese sichert darüber hinaus eine weitgehende Erregerelimination. Bei akuter unkomplizierter Zystitis ist durch eine Kurzzeitbehandlung – meist über 1–3 Tage – eine Infektsanierung möglich. Dies gewährleistet eine gute Patientencompliance, reduziert Nebenwirkungen und begrenzt den Selektionsdruck für resistente Erreger. Eine Einmaltherapie, z. B. mit Fosfomycin, ist gleich effizient wie vergleichbare Antibiotika in längerer Therapie (Fallagas, J Antimicrob Chemother 2012). Aufgrund der Resistenzsituation muss die Verordnung von Cotrimoxazol/Trimethoprim kritisch bewertet werden. Empirische Therapieentscheidungen sind in Kenntnis der Infektionsanamnese und der regionalen Resistenzsituation zu treffen. Bei Chinolonen und Cephalosporinen besteht ein erhöhtes Risiko für mikrobiologische Kollateralschäden, die zu einer Selektion resistenter Erreger oder zu C.-difficile-Infektionen führen. Daher sollten diese bei der Zystitis nicht als Mittel der 1. Wahl verwendet werden.
Die Abbildung gibt einen Überblick über Mittel der 1. und 2. Wahl hinsichtlich der Behandlung eines unkomplizierten Harnwegsinfektes inklusive Dosierung bei normaler Nierenfunktion.
Unkomplizierte Zystitis: Bei unkomplizierter Zystitis ist eine empirische Therapie mit Antibiotika ohne oder mit nur geringer Resistenzproblematik indiziert.
Pyelonephritis: Insbesondere bei Verdacht auf Pyelonephritis sollte in Kenntnis der lokalen Resistenzsituation eine Behandlung so früh wie möglich begonnen werden, um die Entwicklung einer interstitiellen Nephritis oder eine Progression einer Niereninsuffizienz zu begrenzen. Komplizierte Harnwegsinfekte sind häufig Ursache einer Urosepsis. Therapiemaßnahmen müssen so früh wie möglich eingeleitet werden (innerhalb von einer Stunde). Die Antibiotikaauswahl erfolgt empirisch nach vorheriger Abnahme einer Harn- und Blutkultur. Die antimikrobielle Therapie muss sich an der lokalen Erregersituation und dann am mikrobiologischen Befund orientieren.
Asymptomatische Bakteriurie: Eine asymptomatische Bakteriurie erfordert nach heutigem Wissensstand keine Therapie. Eine Behandlung derselben sollte nur erfolgen:
1) in der Gravidität
2) nach einer Organtransplantation (Monat 1–6 nach Nierentransplantation)
3) vor traumatisierenden Eingriffen am Urogenitaltrakt.
Rezidivierender Harnwegsinfekt: Beim rezidivierenden Harnwegsinfekt gilt es zwischen Früh- und Spätrezidiven zu unterscheiden (innerhalb von 4–6 Wochen oder nach 4–6 Wochen). Frührezidive können durch persistierende Keime ausgelöst werden, bei Spätrezidiven kann es sich um eine Reinfektion mit anderen Erregern handeln.
Bei Rezidiven eines unkomplizierten HWI ist eine erneute Kurztherapie möglich, während komplizierte HWI auch nach rascher Besserung der klinischen Symptomatik eine längere Therapie bis zu 10 Tage erfordern. In beiden Fällen ist es ratsam, die Therapie mit einem Antibiotikum einer anderen Gruppe zu beginnen und diese gegebenenfalls dem mikrobiologischen Befund anzupassen.
Hinsichtlich der Prävention rezidivierender unkomplizierter Harnwegsinfekte bieten sich vielfältige Behandlungsmöglichkeiten an (kontinuierliche Verordnung von Antibiotika in reduzierter Dosis, Vakzination, Stabilisierung der lokalen Laktobazillenflora, lokale Östrogensubstitution, L-Methionin). Solche Therapiemaßnahmen können sinnvoll sein, wenngleich dazu keine randomisierten kontrollierten Studien vorliegen.
NephroSpot
Entstehung und Verlauf eines Harnwegsinfektes sind durch die Pathogenität und Virulenz der Infektionserreger sowie die Effizienz der wirtsspezifischen Abwehrreaktion geprägt. rationale diagnostische Strategien sollten sich vorrangig am klinischen Bild der Infektion orientieren. Zur Therapie der unkomplizierten spontanen Zystitis empfehlen sich Fosfomycin oder bei entsprechender Resistenzlage Nitrofurantoin. Bei Kenntnis der lokalen Resistenzsituation (E. coli-Resistenz!) können weiterhin Cotrimoxazol und Trimethoprim eingesetzt werden. Strategien zur Prävention rezidivierender HWI sollten darauf abzielen, die Virulenz uropathogener Erreger zu begrenzen, deren Adhäsion am Uroepithel zu hemmen sowie wirtsspezifische lokale Abwehrmechanismen zu stabilisieren. Zu betonen ist, dass eine kurzzeitige Stoßtherapie (1–3 Tage) bei der unkomplizierten Zystitis derzeit als Standardtherapie gilt.