Kontext kardiovaskuläres Risiko bei diabetischer Nephropathie – Diabetes mellitus Typ 2 und arterielle Hypertonie
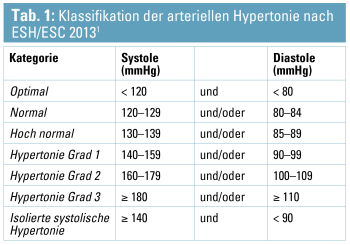
Diabetes mellitus und arterielle Hypertonie (aHT) sind Erkrankungen, die epidemische Ausmaße erreicht haben. Genaue epidemiologische Zahlen der primären aHT sind aufgrund einer hohen Dunkelziffer nicht bekannt, jedoch kann davon ausgegangen werden, dass die Prävalenz in Europa in der Allgemeinbevölkerung zwischen 30 und 45 % liegt.1 Bei Typ-1-Diabetikern beträgt die Inzidenz einer aHT 10 Jahre nach Diagnose ca. 5 % und nach 20 Jahren ca. 33 %.2 Bei Typ-2-Diabetikern ist die Inzidenz schon bei Diagnosestellung deutlich erhöht (39–50 %).3, 4 Zirka 95 % der Bluthochdruckpatienten fallen in die Kategorie der so genannten „primären“ oder „essenziellen“ aHT, deren Ursache noch nicht eindeutig geklärt ist. Bestimmte prädisponierende Risikofaktoren, wie Übergewicht, positive Familienanamnese, Diabetes etc. werden als mitverursachend gesehen. Definitionsgemäß spricht man von aHT ab einem Blutdruck von >140/90 mmHg, gemessen an zwei verschiedenen Zeitpunkten. Je nach Ausprägung kann von verschiedenen Graden gesprochen werden (siehe Tab. 1). Pathogenese und Therapie der insgesamt seltenen sekundären Hypertonieformen sind gut abgeklärt und sollen hier nicht weiter besprochen werden.
Zielwerte
Bevor eine Therapie begonnen wird, ist eine Erhebung von eventuell schon bestehenden Endorganschäden sinnvoll. Als Grundprogramm soll ein EKG, eine Messung der Albuminausscheidung und GFR sowie ein Labor (Blutbild, Elektrolyte, Lipidstatus) durchgeführt werden.1, 5, 6 Die Wirksamkeit einer Senkung von erhöhten Blutdruckwerten konnte durch zahlreiche Studien bewiesen werden.1–4, 7 Eine Reduktion des systolischen Blutdrucks um 10 mmHg führt zu einer um 22 % geringeren Gesamtsterblichkeit, einer um 11 % geringeren KHK-Eventrate und um 27 % weniger Schlaganfällen.8
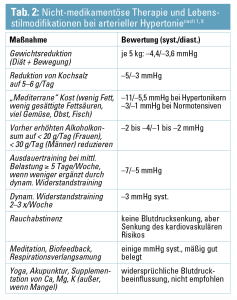
Zur Entscheidung, ab wann therapiert und welches Ziel gewählt werden soll, können die aktuellen Leitlinien der verschieden Fachgesellschaften zu Rate gezogen werden. Prinzipiell ist eine Indikation zur Therapie auf jeden Fall aber ab einer Hypertonie Grad 2 gegeben. Bei einer Hypertonie Grad 1 ohne Risikofaktoren (Endorganschädigung (i. e. KHK, Herzinsuffizienz, pAVK, Schlaganfall oder CKD-Stadium 3) bzw. Diabetes soll initial eine Lebensstilmodifikation (siehe Tab. 2) und anschließend eine Reevaluierung durchgeführt werden.1, 5
Als Therapieziel ist prinzipiell ein Blutdruck ≤ 140/90 mmHg anzustreben. Ausnahmen stellen Patienten mit cAVK oder Niereninsuffizienz dar (Zielblutdruck von < 130/85 mmHg) bzw. Patienten älter als 80 Jahre (Zielblutdruck < 150/90 mmHg).1, 9, 10
Eine strengere Blutdruckeinstellung („the lower the better“) ist wahrscheinlich mit keinem besseren kardiovaskulären Outcome vergesellschaftet.6, 10 Die Höhe des systolischen Blutdrucks ist zwar linear mit dem Risiko einer kardiovaskulären Erkrankung assoziiert – d. h. je niedriger der Wert, desto geringer die Mortalität11 – jedoch gibt es beim diastolischen Blutdruck diesbezüglich keine eindeutigen Daten. Die so genannte „J-Kurve“, d. h. niedrigstes Risiko bei diastolischen Werten von 80–90 mmHg, wie sie z. B. in der NHANES II, INVEST oder einer Post-hoc-Analyse der Irbesartan-Diabetic-Nephropathy-Studie gefunden wurde, scheint retrospektiv gesehen nur für bestimmte Patientengruppen wie Patienten mit bekannter KHK zu gelten, da die Füllung der Koronararterien in der Diastole stattfindet und zu niedriger Druck zu einer Minderversorgung führt.11–13 Im Gegensatz hierzu scheint ein möglichst niedriger diastolischer Blutdruck positiven Einfluss auf das Schlaganfallrisiko zu haben, wie unter anderem in der ACCORD-BP-Studie gezeigt werden konnte – wobei die NNT mit 89 doch sehr hoch ist.14
Medikamentöse Therapie
Prinzipiell kann zur medikamentösen Behandlung einer aHT auf alle zur Verfügung stehenden Antihypertensiva zurückgegriffen werden und somit ähnlich der Therapie bei Diabetes mellitus eine auf den jeweiligen Patienten individualisierte Therapie gestaltet werden. Sollte initial schon eine Hypertonie Grad 2 oder höher vorliegen, ist der sofortige Beginn einer Kombinationstherapie sinnvoll.
Als Grundpfeiler der Blutdrucktherapie sind folgende vier Gruppen besonders hervorzuheben: ACE-Hemmer (ACE-I) bzw. Angiotensin-Rezeptor-Blocker (ARB), Betablocker (BB), Ca-Kanal-Blocker (CCB) und Diuretika.
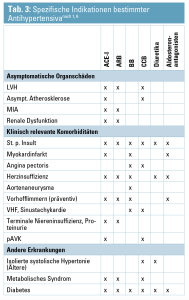
Einige Besonderheiten sollen im Folgenden erwähnt werden (siehe auch Tab. 3):
- Prinzipiell soll als Erstlinienmedikation ein ACE-I oder, bei Unverträglichkeiten, ein ARB begonnen werden – wobei regelmäßige Kontrolle der Elektrolyt- und Kreatininparameter durchgeführt werden sollen.5
- Als Add-on, bei unzureichender Blutdruckkontrolle unter ACE-I/ARB-Monotherapie, ist ein Dihydropyridin-CCB sinnvoll, da dies unter anderem in der ACCOMPLISH-Studie (siehe unten) einen signifikanten Benefit gegenüber Hydrochlorothiazid (HCT) bezüglich kardiovaskulärer Mortalität gezeigt hat.1, 5, 15
- Bei konkomitant bestehender Herzinsuffizienz sollten nach der derzeitigen Studienlage jedoch keine CCB oder Doxazosin als Monotherapie eingesetzt werden, da dies eine Verschlechterung der Grunderkrankung zur Folge haben kann.16, 17 Diese Patienten profitieren von einer Add-on-Therapie mit einem Diuretikum (z. B. HCT, Furosemid oder, bei erhaltener Nierenfunktion, Spironolakton) oder einem BB ohne intrinsisch sympathomimetische Aktivität wie Bisoprolol, Metoprolol oder Carvedilol.15
- Eine Kombination von ACE-I und ARB wird generell nicht empfohlen. Obwohl bessere Blutdruckwerte und weniger Proteinurie erzielt werden konnten, wurden vermehrt Nierenversagen und Todesfälle beobachtet.18
Generell ist, unter Berücksichtigung von Kontraindikationen, nicht die Wahl des Antihypertensivums ausschlaggebend für die Verbesserung des kardiovaskulären Outcomes wichtig, sondern der erreichte Blutdruck.
Diabetes und Hypertonie
Diabetiker mit aHT stellen eine besondere Risikogruppe dar. Das gleichzeitige Vorhandensein dieser Krankheitsbilder bedingt eine deutliche Risikosteigerung bezüglich makro- und mikrovaskulärer Ereignisse.1, 2, 5, 10, 19, 20 Jedoch können Studienergebnisse aus randomisiert kontrollierten Studien ohne vordefinierten Anteil von Patienten mit Typ-2-Diabetes mellitus nur bedingt pauschal auf diese Patientengruppe umgelegt werden. Auch gibt es wenige Hypertoniestudien, welche ausschließlich mit Diabetikern durchgeführt wurden. Eine rezente Metaanalyse von Emdin und Kollegen8, welche dezidiert solche Studien inkludierte, zeigte, dass eine Blutdrucksenkung – unabhängig von der Einzelsubstanz – zu einer deutlichen Reduktion der Gesamtmortalität und wesentlicher diabetesassoziierter, kardiovaskulärer Endpunkte (i. e. KHK, Insult, Retinopathie und Albuminurie) bei Patienten mit Diabetes mellitus führt. Die Studienautoren postulieren für Patienten mit einem hohen Risikoprofil für eine diabetische Nephro- oder Retinopathie bzw. einen Schlaganfall ein niedrigeres Blutdruckziel als die in den meisten internationalen Guidelines vorgeschlagenen < 130/85 mmHg, da dadurch unter anderem in der ACCORD-Blutdruck-Studie eine Risikoreduktion gezeigt werden konnte.8, 14 Diese Studie wurde mit zirka 5.000 Probanden mit Diabetes mellitus Typ 2 durchgeführt, wobei nicht die Intervention an sich, sondern ein bestimmter systolischer Zielblutdruck (< 120 vs. < 140 mmHg) untersucht wurde. Für die Gesamtmortalität konnte nach 5 Jahren jedoch keine Risikoreduktion durch die bessere Blutdruckeinstellung gefunden werden. Es kam allerdings in der intensivierten Gruppe häufiger zu einer Verschlechterung der eGFR (99 vs. 52 Fälle, p 0,001).14
Eine suffiziente Blutdruckeinstellung ist, bezüglich des kardiovaskulären Outcomes, sogar wirksamer als eine gute BZ-Einstellung.
In der UKPDS-38-Studie (Captopril vs. Atenolol vs. Kontrollgruppe; Zielblutdruck < 150/80 bzw. 180/105 mmHg), welche neu manifestierten Typ-2-Diabetes einschloss, konnte nach 9 Jahren in der Interventionsgruppe (144/82 mmHg vs. 154/87 mmHg) eine Reduktion aller diabetesbezogener Endpunkte um 24 % beobachtet werden – im Vergleich dazu zeigte die Interventionsgruppe in der Hauptstudie (UKPDS) eine Reduktion um lediglich 12 %. Weiters zeigte sich eine deutliche Reduktion von Schlaganfällen, Herzinsuffizienz und mikrovaskulären Ereignissen (–44 %, –56 %, –37 %).7
In der ADVANCE-Studie (Perindopril plus Indapamid vs. Placebo) mit über 11.000 langjährigen Typ-2-Diabetes-Patienten wurde eine signifikant niedrigere Rate an kardiovaskulären Ereignissen in der aktiven Gruppe beobachtet. Limitierend muss gesagt werden, dass in dieser Studie kein definiertes Blutdruckziel vorgegeben und Add-on-Medikation nicht reguliert war und beide Gruppen am Studienende nahezu idente Blutdruckwerte aufwiesen (136/73 mmHg vs. 140/73 mmHg).21 Dass eine konsequente dauerhafte Blutdrucktherapie notwendig ist, konnte in der Verlaufsbeobachtung der UKPDS-„Blutdruck-Subgruppe“ nachgewiesen werden: Überlebende der ersten Studie wurden in eine Follow-up-Beobachtungsstudie eingeschlossen. Nach ca. 2 Jahren war der in der Interventionsstudie erreichte Blutdruckunterschied ohne intensive Therapie nivelliert. Nach 10 Jahren zeigte sich kein Unterschied bezüglich kardiovaskulärer Mortalität. Auch in der Nachbeobachtungsstudie der ADVANCE-Probanden zeigte sich, dass, mit Ausnahme der Entwicklung einer terminalen Niereninsuffizienz (ESRD), keine Unterschiede bezüglich Mortalität festzustellen waren. Daraus lässt sich ableiten, dass – im Gegensatz zum „metabolic memory“ durch eine gute Blutzuckereinstellung – kein „cardiovascular memory“ besteht.22–24
Eine initiale Monotherapie, wie in der UKPDS 38, reicht allerdings oftmals nicht aus. Aus mehreren Studien weiß man, dass nach ca. 5 Jahren Therapie 40–60 % der Patienten mehr als ein Antihypertensivum zur Blutdruckkontrolle benötigen.7, 16
Eine große Vergleichsstudie mit dieser Rationale, die ACCOMPLISH-Studie, in der über 11.000 Probanden mit hohem kardiovaskulärem Risiko (Median 68 Jahre, KHK, St. p. Insult, pAVK, Diabetes mellitus, LV-Hypertrophie) eingeschlossen wurden. Insgesamt lag der Anteil der Diabetiker bei ca. 60 %. Verglichen wurde ein ACE-I (Benazepril) mit einem CCB bzw. Diuretikum (Zielblutdruck < 140/90 mmHg). Rescue-Medikation war erlaubt und wurde nach einem Jahr bei ca. 1/3 der Patienten eingesetzt. Obwohl sich der erreichte Blutdruck in beiden Gruppen kaum unterschied (ca. 75 % erreichten das Blutdruckziel), zeigte sich am Studienende nach 30 Monaten eine ca. 21-prozentige Reduktion der kardiovaskulären Endpunkte in der Benazepril-Amlodipin Gruppe (HR 0,8, p <0,001) verglichen zu Benazepril-HCT, unabhängig vom gleichzeitigen Bestehen eines Diabetes. Die Rate der Hospitalisierungen aufgrund einer kardialen Dekompensation waren in beiden Gruppen nahezu gleich (HR 1,04, p = 0,77).15
Eine weitere große Vergleichsstudie mit Patienten mit hohem kardiovaskulären Risiko war die ALLHAT-Studie (Chlortalidon [CTD]) vs. Amlodipin vs. Lisinopril; Zielblutdruck < 140/90 mmHg). Zirka 40 % der Probanden waren zu Studienbeginn Diabetiker. Bei Studienende konnte kein signifikanter Unterschied bezüglich des primären Endpunkts (tödliche KHK oder nicht-tödlicher MCI) beobachtet werden. Die gewünschten Blutdruckziele wurden in allen Gruppen von ca. 60 % der Probanden erreicht. In der CTD-Gruppe traten im Vergleich zu Amlodipin signifikant weniger Fälle von Herzinsuffizienz (–38 %) auf. Ein zu Studienbeginn eingeplanter Doxazosin-Arm wurde nach einem Jahr terminiert, da sich im Vergleich mit CTD eine Verdoppelung der Inzidenz von Herzinsuffizienz und ein erhöhtes kardiovaskuläres Risiko zeigte.16, 17
Metabolische Fallstricke
Als Nebenergebnis der ALLHAT-Studie hatten nach 4 Jahren signifikant weniger „Nicht-Diabetiker“ in der Lisinopril-Gruppe eine erhöhte Nüchternplasmaglukose (> 126 mg/dl) als in der CTD-Gruppe (11,6 % vs. 8,1 %; p < 0,001), wobei der Anstieg im Median sehr gering war (126,3 mg/dl vs. 121,5 mg/dl). Es zeigten sich aber auch hier keine negativen Effekte bezüglich des kardiovaskulären Outcomes bei Diabetikern im Beobachtungszeitraum.16 Auch in der INSIGHT-Studie (Nifedipin vs. Amilorid plus HCT), zeigte sich in der CCB-Gruppe eine geringere Inzidenz für Diabetes mellitus (–1,3 %), wenn zu Anfang eine euglykäme Stoffwechsellage bestanden hat. Insgesamt konnte in beiden Gruppen kein Unterschied bezüglich kardiovaskulärer Mortalität gefunden werden.25 Die Autoren postulieren, dass dies – ungeachtet der kleinen Zahl – im Krankheitsverlauf einen wesentlichen Unterschied machen könnte, da beide Erkrankungen kombiniert ein deutlich erhöhtes Risiko für kardiovaskuläre Erkrankungen darstellen. Zu einem ähnlichen Ergebnis kam eine spanische Studie mit 120 Patienten mit metabolischem Syndrom (IDF-Definition). Probanden unter Therapie mit Olmesartan in Kombination mit Amlodipin hatten eine signifikant niedrigere Diabetesinzidenz als eine Vergleichsgruppe mit HCT als Kombinationspartner (5 % vs. 18,3 %).26 Prinzipiell kann jedoch gesagt werden, dass die metabolischen Effekte von Thiaziddiuretika, vor allem in niedrigen Dosen (bis 25 mg HCT) vernachlässigbar sind.
Metabole Nebeneffekte sind auch bei BB bekannt, wobei es zwischen den Einzelsubstanzen leichte Unterschiede gibt. So scheint Atenolol einen eher ungünstigen Effekt und Carvedilol einen günstigen Effekt auf die Blutglukosewerte zu haben. Metoprolol scheint in dieser Hinsicht eher neutral zu sein. Derzeit läuft eine Phase-IV-Studie für Bisoprolol, welche mögliche Effekte bei Typ-2-Diabetes zeigen soll.27–29
Diabetische Nephropathie
Studien zur Prävention einer diabetischen Nephropathie zeigten gemischte Ergebnisse. In der HOPE- und der MICRO-HOPE-Studie mit Probanden mit hohem kardiovaskulären Risiko (98 % Diabetiker, 60 % aHT) konnte gezeigt werden, dass ein ACE-I im Vergleich zu Placebo neben einer 21-prozentigen Reduktion der Gesamtmortalität mit einer deutlichen Reduktion einer Makroalbuminurie (> 500 mg Albumin im Harn pro Tag) bei allen Patienten verbunden war. Das Auftreten einer Mikroalbuminurie (> 30 mg Albumin im Harn pro Tag) war ebenfalls, wenn auch nicht-signifikant, niedriger unter Ramipril.30
Eine asiatische Studie untersuchte das Auftreten einer diabetischen Nephropathie bei Typ-2-Diabetes unter adäquater Blutdruckeinstellung.31 Nach 8 Jahren Follow-up zeigte sich kein signifikanter Unterschied bezüglich des Auftretens einer ESRD, jedoch konnte vor allem in der „jüngeren“ Population ein vermindertes Auftreten einer Albuminurie beobachtet werden. Limitierend muss gesagt werden, dass im Rahmen der Studie keinerlei spezifische Intervention gesetzt oder ein bestimmtes Blutdruckziel definiert wurde.
In der ACCORD-Blutdruckstudie konnte ein Benefit bezüglich der Entwicklung einer Makroalbuminurie in der Gruppe mit niedrigeren Blutdruckwerten, bei gleichzeitig häufiger GFR-Einschränkung (< 30 ml/min), beobachtet werden. Eingeschlossen waren Diabetiker mit hohem kardiovaskulärem Risikoprofil, welche in einen intensiven und Standardtherapiearm randomisiert wurden (Blutdruckziel 120 vs. 140 mmHg systolisch), wobei kein Benefit bezüglich Gesamtmortalität beobachtet werden konnte.14
Ein etwas kontroverses Ergebnis zeigte sich in der ROADMAP-Studie (Olmesartan vs. Placebo bei Diabetikern ohne Mikroalbuminurie). Zwar konnte eine signifikant niedrigere Inzidenz an Mikroalbuminurie beobachtet werden, jedoch starben, anders als erwartet, in der Interventionsgruppe signifikant mehr Probanden aufgrund eines Herzinfarkts bzw. einer kardiovaskulären Erkrankung (HR 4,94, KI 1,43–17,03). Eine Analyse der Ursachen zeigte, dass vor allem Probanden mit vorbestehender KHK und im niedrigsten Blutdruckquartil betroffen waren.32
In der „Irbesartan for Diabetic Nephropathy“-Studie (1.500 Typ-2-Diabetes-Patienten mit aHT und Makroalbuminurie > 900 g/24 h) zeigte der ARB eine Überlegenheit bezüglich des primären zusammengesetzten Endpunkts (ESRD, Verdoppelung des Serumkreatinins und Tod) im Vergleich zu Amlodipin und Placebo.33
Eine große Metaanalyse von Palmer und Kollegen34 konnte bei über 43.000 Patienten mit diabetischer Nephropathie keine eindeutige lebensverlängernde Therapie nachweisen. ARB und ACE-I aber zeigten die besten Ergebnisse bezüglich eines Hintanhaltens einer ESRD. Limitierend geben die Autoren die Variabilität in der Endpunktdefinition und der unklaren Dosierung in den einzelnen Studien an, wodurch eine dosisabhängige Wirkung nicht beurteilt werden konnte. Eine suffiziente Blutdruckeinstellung scheint positive Effekte auf den Verlauf einer diabetischen Nephropathie zu haben, jedoch gibt es keine eindeutigen Ergebnisse bezüglich der Prävention einer ESRD.
ZUSAMMENFASSUNG: Diabetes und aHT sind Krankheitsbilder, die mit einer erhöhten kardiovaskulären Mortalität einhergehen. Zahlreiche Interventionsstudien haben die Wirksamkeit einer suffizienten Blutdruckeinstellung gezeigt, wobei für Diabetiker generell ein Blutdruckziel von < 140/90 mmHg gewählt werden soll, für manche Patientenpopulationen (hohes Schlaganfallrisiko, diabetische Nephropathie) jedoch auch strengere Zielwerte von < 130/85 mmHg angestrebt werden sollen. Mit welchen Medikamenten dieses erreicht wird, scheint für Patienten ohne wesentliche Komorbiditäten nach dem derzeitigen Wissenstand nicht ausschlaggebend. Prinzipiell sollte eine Therapie jedoch mit einem ACE-I oder ARB gestartet werden. Im Verlauf der Therapie werden zirka 40–60 % der Patienten mehr als ein Antihypertensivum zur Blutdruckkontrolle benötigen.1, 5, 7, 9, 16, 35
Große Metaanalysen haben gezeigt, dass vor allem makrovaskuläre Komplikationen gebessert werden. Ein deutlicher Benefit bezüglich mikrovaskulärer Komplikationen (Retinopathie, ESRD) konnte bisher für keine Substanz oder Kombination gezeigt werden. Dies scheint die Domäne einer guten Blutzuckereinstellung zu sein. Lediglich für ACE-I und ARB konnten in Bezug auf den Verlauf einer diabetischen Nephropathie positive Effekte nachgewiesen werden. Aufgrund der Studiendaten aus Follow-up-Beobachtungen scheint es notwendig, Patienten dauerhaft in den Zielbereich zu bringen, da es – im Gegenteil zum „metabolic memory“ durch eine frühe, gute Blutzuckereinstellung – keinen „cardiovascular memory“ zu geben scheint.20, 24
Im klinischen Alltag scheint die langfristig Erreichung von < 140/90 mmHg eine große Herausforderung zu sein, denn selbst in Studien erreichen nur ca. 2 Drittel der Patienten das Blutdruckziel. Vor allem die so genannte „therapeutical inertia“ (fehlende Therapieintensivierung seitens des Arztes bei Nicht-Erreichen des Therapieziels) und das fehlende Bewusstsein über die Folgen einer insuffizienten Bluthochdrucktherapie in der Bevölkerung stellen wesentliche Probleme dar. Ohne das Überwinden dieser Dilemmas ist eine sinnvolle Behandlung unmöglich.36, 37