Praktische Überlegungen zur Optimierung der Anlage von nativen Gefäßzugängen für die Hämodialyse
Eine effektive Hämodialysebehandlung setzt einen adäquaten Dialysezugang voraus. Die native arteriovenöse Fistel, also die Anastomosierung einer Arterie mit einer Vene, stellt derzeit das Ideal des Hämodialysezuganges dar. Amerikanische Initiativen wie “fistula first” unterstützten die rechtzeitige Anlage solcher Dialyseshunts, die Realität sieht jedoch anders aus. Der Anteil an zentralvenösen Dialysezugängen in Österreich ist sehr hoch (ÖDTR 2009: 22,5%), wobei zwischen den einzelnen Bundesländern erhebliche Schwankungen zu beobachten sind (ÖDTR 2009: Tirol 6%, Wien 37%). Ursachen dafür sind vor allem in der Zunahme des Alters der Patienten und des Anteils an Diabetiker bei Dialysebeginn und die damit assoziierten Gefäßveränderungen zu suchen. Die Variabilität zwischen den Bundesländern kann damit aber nicht erklärt werden. Neben nicht direkt beeinflussbaren Faktoren, sind auch die späte Zuweisung zum Nephrologen, die nicht rechtzeitige Shuntanlage bzw. eine nicht adäquate Evaluierung der Gefäßsituation zur Planung der Shuntanlage Faktoren, die öfters einen Dialysestart über einem zentralvenösen Zugang notwendig machen. Zusätzlich machen eine inadäquate Shuntentwicklung oder die schwierige anatomische Lage der Punktionsstellen die Anlage eines Zentralvenenkatheters für den Dialysebeginn notwendig.
Eine Shuntanlage benötigt also entsprechende Vorbereitungen, um letztendlich ein für den Patienten, den behandelnden Arzt und das Pflegepersonal befriedigendes Ergebnis zu erreichen – einen leicht punktierbaren, lange und gut funktionierenden Hämodialyseshunt. Der Artikel sollte in Kontext mit den Übersichtsarbeiten von Prof. Rosenkranz und Doz. Prischl in einer früheren Ausgabe des NEPHRO Script 1/2007 gesehen werden. Es soll als Praxisanleitung für die präoperative Ultraschalluntersuchung dienen, wie sie von den europäischen und amerikanischen Richtlinien empfohlen wird, und dazu beitragen, den Anteil an nativen AV-Fistelanlagen zu erhöhen.
Wann ist der richtige Zeitpunkt für eine Shuntanlage?
Die Shuntanlage sollte etwa 6 Monate vor dem geplanten Dialysebeginn erfolgen. Dieser Zeitraum ermöglicht eine adäquate Shuntentwicklung und gibt ausreichend Spielraum für eventuell notwendige Interventionen bei fehlender Shuntreifung. Wegen einer möglichen kardiovaskulären Belastung durch das Shuntvolumen und die mögliche Gefahr von Verletzung bzw. der Beeinträchtigung des täglichen Lebens durch die nötige Reduktion der Kraftausübung am Shuntarm, sollte von einer zu frühen Shuntanlage (> 1 Jahr vor zu erwartenden Dialysebeginn) abgesehen werden. Sobald die Notwendigkeit einer Nierenersatztherapie absehbar ist, sollte der Patient über Maßnahmen zur Schonung der peripheren Venen instruiert werden (Malovrh M Nephrol Dial Transplant 18 [Suppl 5]:v50-v52, 2003).
Evaluierung der Gefäßsituation vor der Shuntanlage
Anamnese
Die Anamnese beinhaltet frühere Shuntanlagen und vor allem aktuelle oder frühere Anlagen von zentralen Venenkathetern. Weiters sollte erhoben werden, ob eine internistische Kontraindikation für eine Shuntanlage besteht (z. B. schwere Herzinsuffizienz).
Klinisch-physikalische Untersuchung
Neben der Evaluierung des Pulsstatus (Arteria brachialis [A. brach.], Arteria radialis [A. rad.], Arteria ulnaris [A. uln.]) werden auch die Venen an der oberen Extremität (mit und ohne Anlage einer Stauungsbinde) begutachtet. Es sollte gezielt auf Zeichen der Störung des zentralvenösen Blutabflusses geachtet werden (venöse Kollateralbildung, Seitendifferenz im Armumfang).
Ultraschalluntersuchung
Aufgrund des nicht ausreichenden Vorhersagewerts der Anamnese und der klinisch-physikalischen Krankenuntersuchung für die Shuntreifung und Shuntfunktion wurde in den letzten Jahren die Ultraschalluntersuchung der Gefäße an der oberen Extremität als neues diagnostisches Hilfsmittel entdeckt (Parmley MC Am J Surg184:568-572, 2002). In den letzten 10 Jahren wurden dahingehend zahlreiche Arbeiten publiziert, die es uns nun möglich machen, die Planung der Shuntanlage zu optimieren. Die exzellenten Ergebnisse führten dazu, dass die Ultraschalluntersuchung der Gefäße vor Shuntanlage in die amerikanischen (KDOQI) und europäischen (EBPG) Richtlinien) aufgenommen wurden.
Der Untersuchungsgang ist leider zeitaufwendig und untersucherabhängig, da eine Vielzahl von Kriterien evaluiert werden müssen. Um die Gefäßverhältnisse adäquat interpretieren und um eine fundierte Empfehlung für die Shuntanlage an den Chirurgen abgeben zu können, bedarf es der Kenntnis sämtlicher Optionen zur Shuntanlage (siehe Absatz: Welche Shuntanlagen sind möglich bzw. sinnvoll?).
Die Ultraschalluntersuchung erfolgt in der Regel mit einem 7,5-MHz- oder höheren linearen Schallkopf im B-Mode. Zur Analyse von Flussgeschwindigkeiten wird der PW-Dopplerbzw. die Duplexsonographie eingesetzt.
Arterien
Untersucht werden die A. rad. et uln. ausgehend von der A. brach. bis in den Bereich des Handgelenkes. Die A. brach. wird nach proximal bis in den Bereich der Axilla untersucht. Die Arterien sollen im Längs- und Querschnitt evaluiert werden. Primär sollte nach Stenosierungen, Verkalkungen oder Wandverdickungen und anatomischen Variationen im Verlauf der Arterie (z. B. A. rad. und uln. verlaufen getrennt bis zur Axilla, keine A. brach.) gesucht werden. Eine Stenosierung der Arterien liegt bei mehr als 50% Lumenreduktion bzw. Verdoppelung der maximalen Flussgeschwindigkeit (peak systolic velocity, PSV) vor. Zur Bestimmung des Arteriendurchmessers sollte der Innendurchmesser der Arterie (Intima zu Intima) im Längsschnitt gemessen werden (mind. 2 Messungen), da die Querschnittsmessung fehleranfällig ist. Die Beurteilung der Morpholgie und Dicke der Arterienwand ist insgesamt sehr schwierig, wobei zumindest Verkalkungen leicht zu identifizieren sind. Die Messung der Intima-media Dicke könnte vielleicht in Zukunft eine exaktere Aussage über den Zustand der Arterienwand liefern (Ku YM, Nephrol Dial Transplant 2006; 21:715-720). In weiterer Folge werden die maximale Flussgeschwindigkeit (PSV), der Hyperämietest und der Gefäßdurchmesser an den möglichen Anastomosierungsstellen überprüft. Es muss ein antegrader Fluss in beiden Unterarmarterien vorhanden sein (Ferring M, Nephrol Dial Transplant 2008; 23:1809-1815).
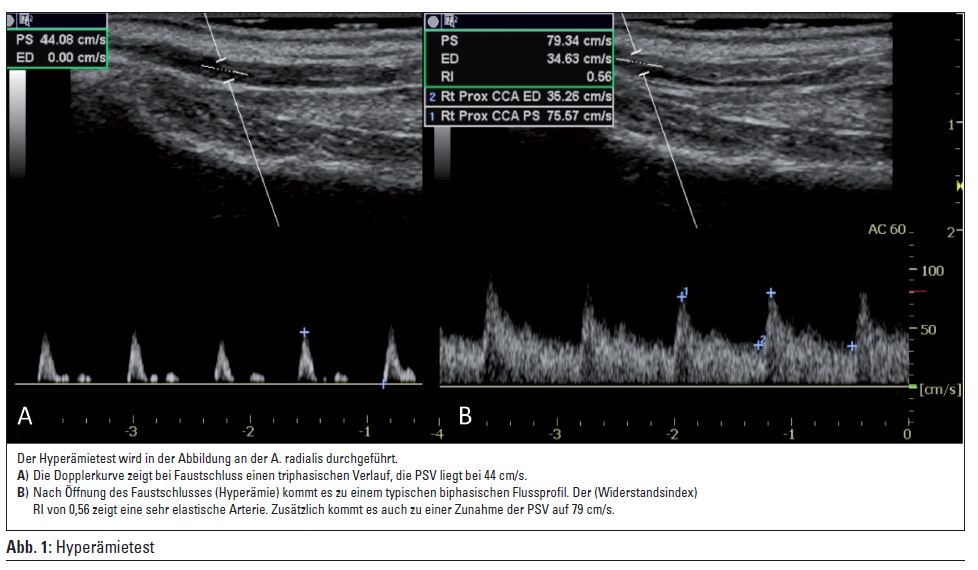
Der Hyperämie- oder Faustschlusstest (A. rad oder A. uln.): Für 2 Minuten sollte ein maximaler Faustschluss erfolgen. Nach Öffnen des Faustschlusses wandelt sich der triphasische Verlauf der Dopplerkurve (Gefäßsystem mit hohem peripherem Widerstand) in einen biphasischen Verlauf um (Abb. 1). Der Widerstandsindex berechnet sich aus der maximalen systolischen Flussgeschwindigkeit – der enddiastolischen Flussgeschwindigkeit dividiert durch die maximale systolische Flussgeschwindigkeit – und sollte an der Shuntarterie 5 cm/s in der Hyperämiephase ist ein Zeichen für eine zukünftig gute Shuntentwicklung (Wall LP, Ann Vasc Surg 2004; 18: 167-171) (Abb. 1).
Venen
Die Evaluierung der Venensituation sollte wie bei den Arterien im Längs- und Querschnitt erfolgen. Sie gelingt nur dann, wenn ein minimaler Druck mit dem Schallkopf auf die Vene ausgeübt wird und damit ein korrekter Venendurchmesser gemessen werden kann. Die Variation des Venendurchmessers schwankt erheblich von Tag zu Tag, da diese von äußeren Umständen abhängig ist, wie Temperatur oder Körperlage oder dem Untersucher. Die Untersuchung sollte daher im Sitzen, bei angenehmer Raumtemperatur und mit Hilfe der Staubinde erfolgen. Die Stauung muss zumindest 2 Minuten vorher angelegt werden. Während der Untersuchung sollte die Vene im Querschnitt regelmäßig komprimiert werden, um die Durchgängigkeit des Gefäßes zu bestätigen. Die Venenwand ist in der Regel sehr zart (Ferring M, Nephrol Dial Transplant 2008; 23:1809-1815). Es werden die V. cephalica und basilica am Unter- und Oberarm bis in den Bereich der Axilla sowie die Begleitvenen der A. brach. evaluiert. Im Bereich der Cubita ist auf eine V. mediana cubiti (Anlage einer Gracz-Fistel möglich?) sowie den weiteren venösen Abstrom zu achten. Neben der Möglichkeit der venösen Drainage nach lateral über die V. cephalica kann die Drainage auch nach medial in Richtung V. basilica oder über das tiefe Venensystem (Begleitvenen der A. brach.) erfolgen. Es bestehen interindividuell erhebliche Variationen im venösen Abfluss über diese drei möglichen Venensysteme. Die Zentralvenen können sonographisch nur schwer beurteilt werden. Vor allem die Endstrecke der V. subclavia ist bezüglich einer möglichen Thrombosierung/Stenosierung oft schwierig zu evaluieren. Atemabhängige Schwankungen im venösen Fluss im Bereich der V. axillaris geben zumindest indirekt einen Hinweis auf eine offene Passage im Zentralvenenraum (Patel MC Radiology 1999; 211:579-583). In unklaren Fällen muss eine konventionelle Angiographie durchgeführt werden.
Die Venen müssen exakt auf Thrombosierungen (kurzstreckige Thrombosen nach Anlage von Dauervenenverweilkanülen) und den Durchmesser untersucht werden. Für die spätere Punktion des Shunts muss auch der Abstand der Vene von der Hautoberfläche untersucht werden. Im Idealfall sollte die Vene 50%, oder wird damit der minimale Venendurchmesser für die Shuntanlage erreicht, so kann diese Vene als Shuntvene verwendet werden (Lockhart ME J Ultrasound Med 2006; 25:1541-1545; Malovrh M Sem Dial 2003; 16(4):299-303). Neuere Methoden zur Objektivierung der Venenelastizität sind vor allem für die Beurteilung der späteren Shuntentwicklung notwendig, aber derzeit noch nicht für die tägliche Praxis geeignet (Biswas R Sem Dial 2010; 23(1):105-109 und van der Linden J Am J Kidney Dis 2006; 47:1013-1019).
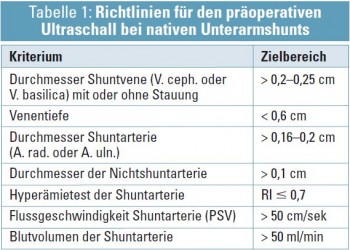
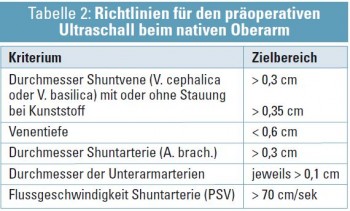
Die Kriterien zur Interpretation der arteriellen und venösen Gefäßsituation ist je nach Shuntlage (Ober- oder Unteram) unterschiedlich (Tab. 1 und 2) (Auswahl der Literatur: Karakayali FY Eur J Vasc Endovasc Surg 2008; 35(2):208-13; Malovroh M Am J Kidney Dis 2002; 39:1218-1225; Ferring M Nephrol Dial Transplant 2008; 23:1809-1815).
Welche Shuntanlagen sind möglich bzw. sinnvoll?
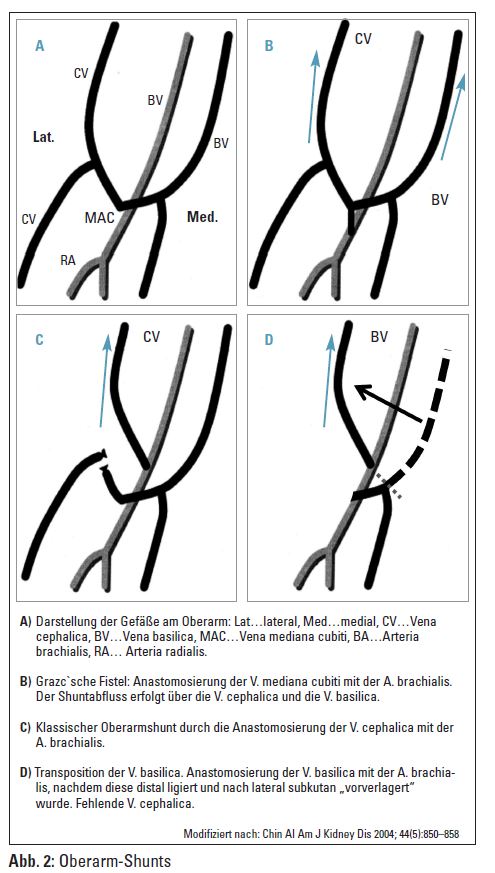
Abhängig von der klinischen Untersuchung des Patienten und des Ergebnisses der Ultraschalluntersuchung erfolgt gemeinsam mit dem Chirurgen die Entscheidung für die ideale Anlagestelle der Fistel. Es ist primär eine native arteriovenöse Fistel anzustreben, wobei der Unterarm (V. cephalica) als Lokalisation der ersten Wahl gilt. Ist eine native Fistel am Unterarm nicht möglich, so muss nach einer Alternative am Oberarm gesucht werden. Oft ist eine Anastomosierung der V. cephalica mit der A. brachialis im Bereich der Cubita leicht möglich (Abb. 2C). In diesem Fall besteht ein höheres Risiko für die Entwicklung einer Steal-Symptomatik, weshalb bei diesen Patienten die Evaluierung der Flüsse in der Art. rad. et uln. besonders wichtig sind. Eine Anastomosierung der V. cephalica an der A. rad. vor der Einmündung in die A. brach. verringert das Steal-Risiko deutlich. In der Cubita kann auch die V. mediana cubiti auf die A. brachialis anastomosiert werden (Grazc’sche Fistel- Abb. 2B).
Ist die V. cephalica am Unterarm und Oberarm nicht für eine Shuntanlage geeignet, so müssen die V. basilica oder die V. brachialis verwendet werden. Manchmal gelingt es, die V. basilica am Unterarm aufgrund der anatomischen Nähe zur A. uln. mit dieser zu anastomosieren. Im Regelfall hat jedoch die A. uln. einen deutlich geringeren Durchmesser als die A. rad., was eine Transpositionierung der V. basilica hin zur A. rad. notwendig macht. Diese kann dabei auf zwei verschiedene Wege durchgeführt werden: in erster Linie durch die komplette Mobilisierung der V. basilica bis auf Höhe der Cubita und einer langen subkutanen Tunnelierung von dort weg bis zur Anastomosenstelle im Bereich des Handgelenkes. Diese Technik hat den Nachteil, dass die V. basilica dabei von ihrer Versorgung durch die Vasa vasorum getrennt wird und damit eine avitale Shuntvene vorliegt, welche sich an die Ansprüche des Hochdruckkreislaufes weniger gut adaptieren kann. Als Alternative kann die V. basilica nur so weit nach proximal mobilisiert werden, dass genug Strecke für die Anastomosierung zur Verfügung steht und die Vene im weiteren Verlauf in ihrer natürlichen Position verbleibt. Ein Nachteil ist bei dieser Anastomosierung eine schwierigere Punktion durch die natürliche dorsolaterale Lage der V. basilica.
Am Oberarm kann die V. basilica ebenfalls transponiert werden, um eine Anastomose mit der A. brach. zu ermöglichen. Dabei muss die Vene weit genug nach lateral und oberflächlich gelegt werden, um eine Fehlpunktion durch die Nähe zur A. brach. zu vermeiden (Abb. 2D). Dies ist auch der Grund dafür, dass die V. basilica oder der mediale Ast der V. mediana cubiti nicht ohne Transpositionierung mit der A. brachialis anastomosiert werden sollte. Diese Shunts sind zumeist nur sehr schwierig zu punktieren und führen sowohl zur Frustration des Pflegepersonals als auch des Patienten. Als letzte Alternative kann eine Begleitvene der A. brachialis zur Shuntanlage herangezogen werden. Diese Venen sind meist sehr zart und benötigen deshalb einen deutlich längeren Reifeprozess als die zuvor erwähnten Venen (zumindest > 2 Monate). Ist die V. cephalica am Oberarm nicht vorhanden und muss die V. basilica oder eine Begleitvene der A. brach. verwendet werden, so muss darauf geachtet werden, dass nach Shuntanlage noch eine ausreichend große Vene verbleibt, welche den venösen Abfluss am Arm garantiert, um eine Ödembildung am Arm zu vermeiden.
Ist eine Shuntanlage mit den nativen Gefäßen nicht möglich, so stellt der Kunststoffshunt eine minderwertige Alternative dar. Selbst die Transpositionen der großen Venen am Arm zeigen bessere Langzeitfunktionsraten als die Kunststoffshunts (Woo K J Vasc Surg 2007; 46(1):94-99 und Maya ID Clin J Am Soc Nephrol 2009; 4:86-92). Die Anlage eines Unterarm-Loops macht arterielle und venöse Gefäßverhältnisse erforderlich, die fast immer eine andere Shuntanlage mit nativen Gefäßen ermöglichen (z. B. Basilica-Transposition am Oberarm). Die Anlage eines Kunststoff-Loops am Oberschenkel kann im Einzelfall (z. B. Verschluss der V. cava sup.) notwendig sein, da die Ergebnisse mit nativen Gefäßen (Transpositionierung der V. saphena magna) weniger gut sind als an der oberen Extremität.
Bei schwierigen oder atypischen Gefäßverhältnissen kann die Skizzierung der Gefäße auf der Haut den chirurgischen Eingriff zusätzlich erleichtern. Bei adipösen Patienten mit tiefer Venenlage (> 1 cm) kann die Vene durch sekundäre Eingriffe (verschiedene Techniken) nach Shuntreifung weiter zur Hautoberfläche hin vorverlagert werden (z.B. Causey MW, J Vasc Surg 2010; 52(5):1397-1400).
Postoperatives Monitoring der Entwicklung des Shunts
Für die Funktionalität eines Shunts gibt es verschiedene Kriterien. Diese inkludieren die Punktierbarkeit des Shunts sowie die Rate der ohne eine Intervention langfristig funktionstüchtigen Shunts (primary patency). Die assisted primary patency ist die Rate der durch radiologische oder chirurgische Interventionen funktionstüchtig erhaltenen Shunts. Kommt es zu einer Thrombosierung des Shunts, welche durch eine Intervention korrigierbar war, so werden diese Shunts in der Secondary-patency-Rate klassifiziert.
Die Ultraschalluntersuchung führt vor allem zu Reduktion der Anzahl unmittelbar postoperativ, aber auch der später auftretenden Shuntthrombosen. Insgesamt kann zwar nicht die primäre, wohl aber die primary assisted patency deutlich verbessert werden. Dass sich die primary patency durch eine Ultraschalluntersuchung vor Shuntanlage nicht verbesserte, ist einerseits darauf zurückzuführen, dass zum Teil die frühen postoperativen Thrombosen aus den Analysen exkludiert wurden, andererseits aber auch darauf, dass mit der Ultraschalluntersuchung die Shuntreifung nicht gut vorhersagbar ist (Ferring M Clin J Am Soc Nephrol 2010; 5:2236-2244).
Um die fehlende Shuntreifung (bis zu 50% der Unterarmshunts) zu objektivieren, muss der Shunt also auch postoperativ untersucht werden. Am besten eignet sich dazu die Shuntvolumenmessung an der A. brach. Diese ist der direkten Messung an der Shuntvene überlegen, da sie einen geraden Verlauf zeigt, die Arterie nicht komprimierbar ist und keine Kaliberschwankungen aufweist. Bei Kunststoffshunts kann das Shuntvolumen direkt am Shuntgefäß gemessen werden. Leider sind nicht alle Kunststoffarten für eine Ultraschalluntersuchung geeignet. Das Shuntvolumen sollte innerhalb der ersten Woche nach Anlage etwa 300-400 ml/min am Unterarm bzw. > 500 ml/min am Oberarm betragen (Basile C Sem Dial 2005; 18(3):243-246). Bis zur ersten Punktion muss das Shuntvolumen am Unterarm auf 600 ml/min und am Oberarm auf 800 ml/min ansteigen. Werden die Zielwerte nicht erreicht, so muss der Shunt auf Stenosierungen untersucht werden, welche einer radiologischen oder chirurgischen Intervention potenziell zugänglich sind. Bei Patienten, die noch keine Hämodialysebehandlung benötigen, kann zur Vermeidung einer Kontrastmittelanwendung in der Shuntreifungsphase auch eine ultraschallgezielte Dilatation der Shuntvene erfolgen (Bacchini G J Vasc Access 2007; 8(2):81-85; Ascher E J Vasc Surg 2009; 50(3):594-599).
Eine fehlende Zunahme des Shuntvolumens beruht aber oft auf einer fehlenden Elastizität der Gefäße im arteriellen oder venösen System. Dabei wird zwar keine Stenosierung im Shuntverlauf festgestellt werden, es kommt aber zu keiner Dilatation der Arterie vor der Anastomose (Arteriendurchmesser vor und nach der Anastomose annähernd gleich) oder zu keiner Dilatation der Shuntvene. Dilatiert sich die Shuntvene um > 50% innerhalb der ersten Woche nach Anlage, so ist mit einer adäquaten Shuntreifung zu rechnen (Malovroh M, Am J Kidney Dis 2002; 39:1218-1225). Kommt es nach 8-12 Wochen (Shunttraining – Rus RR, Hemodial Int. 9(3):275-80, 2005) zu keiner entsprechenden Zunahme des Shuntvolumens, so muss eine Neuanlage überlegt werden.
Ist ein Shunt in Funktion und kann verwendet werden, so muss dessen Funktionalität weiterhin beobachtet werden (klinisch, Ultraschall,…).
NEPHRO Spot
Aufgrund des zunehmenden Anteils älterer Patienten und Diabetiker an der Hämodialysepopulation ist ein erheblicher Mehraufwand notwendig, um das Ziel einer hohen Rate (> 70%) an nativen arteriovenösen Fisteln zu erreichen. Nur durch die Kombination von physikalischer Untersuchung mit einer Ultraschallevaluierung der Gefäßsituation an der oberen Extremität ist in vielen Fällen (ca. 50%) eine erfolgreiche Shuntanlage möglich. Der Nephrologe sollte diese Untersuchung durchführen und beherrschen, da dieser letztendlich auch mit der Punktierbarkeit des Shunts in der Praxis konfrontiert wird. Die Entscheidung über die Art der Shuntanlage erfordert immer die enge Zusammenarbeit mit einem exzellenten Shuntchirurgen.