Die Bedeutung der Phosphatkontrolle
Bereits vor fast 10 Jahren publizierte die American Heart Association eine Arbeit zur kardiovaskulären Mortalität von Patienten mit Nierenersatztherapie. Gezeigt wurde, dass die Mortalität von Dialysepatienten in jedem Lebensalter, beginnend mit 25 Jahren bis über 85 Jahre signifikant höher ist als in der altersgematchten Normalbevölkerung. Jüngere Patienten hatten eine um den Faktor 500- bis 1000-fach höhere Mortalität, bei Patienten über 65 Jahren war sie 20- bis 50-fach erhöht. Eine Nierentransplantation senkte die Mortalität signifikant – bei Patienten ab 65 Jahren sogar auf das Niveau der Normalbevölkerung. Auf Basis dieser Erkenntnisse wurden Anstrengungen gesetzt, die Mortalität der Dialysepatienten, z. B. mit Statinen, zu senken.
Die Statinstudie AURORA zeigte jedoch, dass eine 5-jährigen Rosuvastatin-Therapie die kardiovaskuläre Mortalität in der Dialysepopulation nicht verbessert. Rezente Post-hoc-Analysen der 4D-Studie weisen jedoch darauf hin, dass eine Subpopulation mit einem LDL >120 mg/dl von einer Statintherapie profitieren könnte. Der negative Studienausgang der AURORA- und der 4D-Studie dürfte darin zu suchen sein, dass sich die Todesursachen der Patienten an der Dialyse von denen der Normalbevölkerung dramatisch unterscheiden. In einer Metaanalyse von Statinstudien bei nierengesunden Patienten (CTT-trial; Cholesterol Treatment Trialist) verstarben 42% der Patienten am Myokardinfarkt, in der 4D-Studie waren es nur 9%. Dies entspricht ungefähr den Daten aus dem amerikanischen Dialyseregister. Interessanterweise verstarben in der 4D-Studie 35% der Patienten am plötzlichen Herztod, während dies nur bei 7% der nierengesunden Patienten unter Statintherapie die Todesursache war. Bei Dialysepatienten sind vermutlich strukturelle kardiale Veränderungen (Stichwort Linksventrikelhypertrophie, Myokardfibrose, Veränderung kleiner Myokardgefäße) führend.
Dialysepatienten sterben anders
Seit 15 Jahren wissen wir, dass Dialysepatienten mit koronarer Herzerkrankung (KHK) altersunabhängig wesentlich stärkere Verkalkungen aufweisen als vergleichbare Patienten mit KHK, die nicht an der Dialyse sind. In rezenten Untersuchungen (Shantouf, Am J Nephrology 2010) war der Grad der Verkalkung der Koronargefäße bei Dialysepatienten am Beginn der Dialyse ein Prädiktor für das weitere Outcome (signifikant höhere Mortalität bei einem Agatson-Score > 400). Block et al. haben wiederholt gezeigt, dass die Höhe des Phosphats bei Dialysepatienten mit der Mortalität korreliert. Neuere Daten (Edington, Clin J Am Soc Nephrology 2010) belegen darüber hinaus, dass die Mortalität bereits im Stadium 3-5, also bei noch nicht dialysepflichtigen Patienten, bei hoch normalem Phosphat signifikant erhöht ist. Eine rezente Arbeit von Floege zeigte, dass die Überlebensrate in einem Phosphatbereich zwischen 1,1 und 1,8 am besten ist (NDT 2010). Die “Nephrologische Community” ist sich einig, dass Hyperphosphatämie mit kardiovaskulären Komplikationen verbunden ist, sei es durch direkte vaskuläre Schädigung, durch erhöhte FGF-23-Spiegel oder durch die Inhibition der Vitamin-D-Synthese bzw. die vermehrte Freisetzung von Parathormon aus der Nebenschilddrüse. Uneinigkeit herrscht über die Ursache für die Mortalität aufgrund einer Kalziumphosphatüberladung. Hier schwelt die Diskussion darüber, ob erhöhter Phosphor – so wie früher angenommen mit Kristallbildung – oder eher das Fehlen von Inhibitoren der Kalzifizierung (Stichwort Fetuin-A, Stichwort Pyrophosphat) ursächlich sind. Daten aus Neuseeland haben gezeigt, dass postmenopausale Frauen, die über 5 Jahre lang Kalzium einnehmen, eine erhöhte Anzahl an Myokardinfarkten aufweisen. Basierend auf den Erkenntnissen, dass sowohl bei Dialysepatienten als auch bei Prädialysepatienten die Kalzifizierung durch nicht calciumhältige Phosphatbinder signifikant hintangehalten werden kann (Block, Kidney Int 2005), wurden zu Beginn des neuen Jahrtausends Versuche gestartet, die Kalziumzufuhr bei Patienten an der Dialyse zu reduzieren. Allerdings ergab die große interventionelle DCOR-Studie (Suki et al. Kidney Int 2007) mit über 2.000 Patienten keinen Hinweis darauf, dass die Mortalität durch die Verwendung von nicht calciumhältigen Phosphatbindern im Vergleich zu kalziumhältigen Phosphatbindern gesenkt werden kann. Auch diese interventionelle nephrologische Studie bei Dialysepatienten reiht sich in eine prominente Riege von Studien (4D, AURORA), die keinen Benefit gezeigt hat.
Vielleicht liegt das Problem anderswo …
Epidemiologische Daten von Go et al. (New England Journal of Medicine 2004) zeigen, dass die kardiovaskuläre Mortalität bei Patienten ab dem Stadium CKD 4 dramatisch ansteigt. Der Anstieg beginnt bereits ab einer GFR < 45 ml/min/1,73 m2 und verläuft relativ parallel zur Phosphat-Erhöhung im Blut und dem PTH-Spiegel, der ab einer Clearance < 30 ml/min signifikant ansteigt (Kestenbaum et al., J Am Soc Nephrol. 2005). Es stellt sich die Frage, ob dies ein kontinuierliches Phänomen ist, das bereits in frühen Stadien der Niereninsuffizienz auftritt und initial noch kompensiert werden kann, oder ein Phänomen des Endstadiums der Niereninsuffizienz?
Die Framingham Offspring Study (Dhingra, Arch Int Med 2007) und auch die ARIC-Studie mit immerhin 15.000 Teilnehmern (Foley, Am Heart J 2008) zeigen, dass Patienten mit normaler Nierenfunktion bereits bei hochnormalen Phosphatspiegeln eine erhöhte kardiovaskuläre Mortalität aufweisen. Dies zieht sich durch die gesamte Literatur und gilt auch für die Progression der CKD (Schwarz, Clin J Am Soc Nephrol 2006). Aus observationellen Daten lässt sich herauslesen, dass das Ausmaß der Kalzifizierung mit der Höhe des Phosphatspiegels (im normalen Bereich) korreliert. Je höher der Phosphor, desto mehr Kalzifizierung bei Patienten im Stadium 3 der Niereninsuffizienz (Adeney, J Am Soc Nephrol 2009). Und letztlich zeigte die CARDIA-Studie (Dhingra, Arch Int Med 2007) auch bei Patienten mit Stadium 1-2 der Niereninsuffizienz bei hochnormalem Phosphat ein erhöhtes Risiko für die Entwicklung einer koronare Verkalkung. Dies ist umso bemerkenswerter, als die Studienteilnehmer zwischen 18 und 30 Jahre alt waren und im Durchschnitt eine GFR von 116 ml/min aufwiesen. Die Patienten wurden über 15 Jahre verfolgt und es fand sich bei 9% der Teilnehmer der Studie eine koronare Verkalkung. Aus rezenten Untersuchungen von Watanabe et al. (Clin J Am Soc Nephrol 2010) wissen wir, das mit Stadium 3-4 die koronare Verkalkung mit dem Überleben Hand in Hand geht. Dass erhöhte Phosphatspiegel und Kalzifizierung assoziiert sind, zeigt eine rezente Arbeit aus der eigenen Arbeitsgruppe (Eller et al., Am J Pathol 2011). Im Modell einer akuten Phosphatüberladung kam es zu einer massiven Ablagerungen von Hydroxyapatit in der Niere – der Grundsubstanz unserer Zähne.
Umdenken?
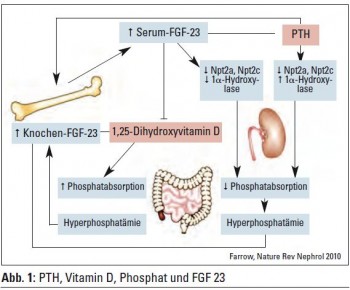
Basierend auf diesen neuen Erkenntnissen hat sich der Schwerpunkt der nephrologischen Forschung auf die Hyperphosphatämie konzentriert. Man weiß nun, dass bei Nierengesunden und Nierenkranken die Hyperphosphatämie zu einer vermehrten Freisetzung von FGF 23 aus dem Knochen führt. FGF 23 bewirkt an der Niere eine “Niederregulation” der Phosphattransporter und eine Hemmung der 1-alpha-Hydroxylase. Dadurch sinkt die Phosphatreabsorption in der Niere, und durch Hemmung der Vitamin-D-Bildung verringert sich die Phosphatabsorption aus dem Magen-Darm-Trakt. Es wird auch über eine direkte Wirkung auf die Nebenschilddrüse zur Parathormonfreisetzung spekuliert (Abb. 1). FGF 23 steigt früher an als das Parathormon. Ein Anstieg von FGF 23 führt damit zum Erhalt normaler Phosphatspiegel. Gutierrez et al. (J Am Soc Nephrol 2005) zeigten, dass mit sinkender Nierenfunktion auch die FGF-23-Spiegel ansteigen, was zu einer vermehrten Ausscheidung von Phosphor führt (Evenpoel, Clin J Am Soc Nephrol 2010). Diese renale Phosphatexkretion kann sowohl von PTH als auch von FGF 23 getriggert werden. Der frühere Anstieg von FGF 23 dürfte für den Abfall der Vitamin-DSpiegel bei Patienten mit eingeschränkter Nierenfunktion verantwortlich sein, da es bereits im Stadium 2 zu einem signifikanten Abfall kommt.
Ist der kompensatorische Anstieg von FGF 23 gut oder schlecht?
Arbeiten von Gutierrez et al. (New Engl J Med 2008) zeigen, dass der Anstieg von FGF 23 bei Dialysepatienten wesentlich besser mit der Mortalität korreliert als die Höhe des Phosphats. Andere Autoren konnten zeigen, dass FGF 23 als Marker für die Kalzifizierung verwendet werden kann (Jean, Nephrol Dial Transplant 2009), dass der erhöhte FGF-23-Spiegel mit der Progression der Nierenerkrankung korreliert (MMKD-Studie, Fliser et al., J Am Soc Nephrol 2007) und dass es ein Marker für die Linksventrikelhypertrophie ist (Gutierrez, Circulation 2009).
Senkt die Phosphatreduktion die Mortalität?
Wichtige klinische Fragen sind noch offen. Unter anderem die jene, ob die Phosphatreduktion per se die Mortalität beeinflusst. Es gilt nun, einen Überlebensvorteil für die Phosphatreduktion nachzuweisen. Isakova et al. haben gezeigt, dass Phosphatbinder die Mortalität senken kann, dies allerdings unabhängig von der Höhe des Phosphatspiegels (J Am Soc Nephrol 2009).
Bisher sind keine Unterschiede in der Effizienz und der Mortalitätssenkung der verschiedenen Phosphatbinder nachgewiesen. Direkte Vergleichsstudien mit Placebo versus Phosphatbinder liegen nicht vor. Es fehlt zwar der Nachweis dafür, dass die Reduktion des Serumphosphatspiegels das Überleben verbessert, die bisherige epidemiologische Evidenz deutet jedoch in die Richtung, dass wir bei unseren Dialysepatienten Serumphosphat senken müssen. Dass das Überleben in der späten Phase der Niereninsuffizienz durch Phosphatsenkung bisher nicht verbessert werden konnte, lässt für “evidenzbasierte Puristen” natürlich auch die Frage nach der Sinnhaftigkeit der Intervention offen. Eine Möglichkeit wäre, eine frühzeitigere Phosphatsenkung in der Prävention von kardiovaskulären Erkrankungen zu etablieren.
Frühe Phosphatsenkung
Der Phosphatspiegel steigt sehr spät im Verlauf der Niereninsuffizienz an (ab Clearance < 30 ml/min), die Mortalität allerdings bereits bei einer Clearance < 45 ml/min (Go et al., N Engl J Med 2004; Kestenbaum, J Am Soc Nephrol 2005). Rezente Untersuchungen von Oliveira et al. (Clin J Am Soc Nephrol 2010) haben gezeigt, dass eine Phosphatsenkung mit Phosphatbindern bei CKD 3 und 4 sowohl das Parathormon als auch FGF 23 signifikant senkt. Und obwohl Statin-Studien keinen Effekt bei Dialysepatienten hinsichtlich der kardiovaskulären Ereignisrate erbrachten, gibt es Hinweise darauf, dass der Zeitpunkt der Intervention bei Nierenpatienten von Bedeutung sein könnte. Im JUPITER-Trial (N Engl J Med 2008) konnte gezeigt werden, dass Rosuvastatin vaskuläre Ereignisse bei Männer und Frauen mit erhöhtem CRP signifikant senken kann. Eine Post-hoc-Analyse der JUPITER-Studie von Ridker et al. (JACC 2010) wies nach, dass Patienten mit eingeschränkter Nierenfunktion sehr wohl von einer Statintherapie im Sinne einer signifikanten kardiovaskulären Risikoreduktion profitierten – ein Ergebnis, das im Rahmen der SHARP-Studie bestätigt werden konnte (Ezetimib plus Simvastatin bei Prädialysepatienten; Risikoreduktion 17%). Die SHARP-Studie lieferte allerdings keinen Hinweis auf eine Reduktion der Progression der chronischen Niereninsuffizienz.
Zusammenfassung
Das Konzept der Kalziumphosphatüberladung steht immer noch im Raum, allerdings sind die Mechanismen bisher noch nicht geklärt. Wir wissen, dass bereits bei Nierengesunden hoch normale Phosphatspiegel mit erhöhter kardiovaskulärer Mortalität vergesellschaftet sind und dass nicht das Parathormon, sondern das FGF 23 die Schlüsselrosse spielt. Allerdings müssen erst Studien zeigen, ob eine Intervention einen therapeutischen Effekt hat.
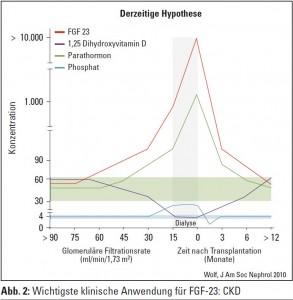
Die derzeitige Hypothese lautet, dass FGF 23 früher ansteigt als Parathormon, und dass der Körper erst im späten Stadium, wenn es zu einem Abfall von Kalzium kommt, versucht, dies über Parathormon zu kompensieren (Abb. 2). Im frühen Stadium der Niereninsuffizienz, in dem es zu keinem Abfall des Kalziumspiegels kommt, stehen die Hemmung der Vitamin-D-Bildung und der Phosphataufnahme im Vordergrund. Schon jetzt gehen die wissenschaftlichen Anstrengungen in Richtung einer frühen Phosphatsenkung und damit einer Verbesserungen des Outcomes. Die Schwierigkeit besteht darin, dass Phosphat im frühen Stadium der Niereninsuffizienz ein schlechter Biomarker ist. In Zukunft könnten uns andere Biomarker oder auch FGF 23 eine viel bessere Prognose ermöglichen, und vielleicht wird auch eine Intervention über FGF 23 möglich sein.
NEPHRO Spot
Das Konzept der Kalziumphosphatüberladung steht immer noch im Raum, allerdings sind die Mechanismen bisher noch nicht abgeklärt worden. Wir wissen, dass bereits bei Nierengesunden hoch normale Phosphatspiegel mit erhöhter kardiovaskulärer Mortalität vergesellschaftet sind. Wir wissen auch, dass durch Entdeckung neuer pathophysiologischer Mechanismen hier nicht das Parathormon, sondern das FGF 23 im Mittelpunkt unseres Interesses stehen wird. Allerdings müssen erst weitere Studien zeigen, ob eine FGF 23 spezifische Intervention eine Veränderung bringen kann.
Die derzeitige Hypothese lautet, dass FGF 23 früher ansteigt als Parathormon, und dass der Körper erst im späten Stadium versucht – wenn es zu einem Abfall von Kalzium kommt – dies über Parathormon zu kompensieren (Abb. 2). Im frühen Stadium der Niereninsuffizienz, wo es zu keinem Abfall des Kalziumspiegels kommt, stehen die Hemmung der Vitamin-D-Bildung und die Hemmung der Phosphataufnahme im Vordergrund. Schon jetzt gehen die Anstrengungen der nephrologischen Wissenschaft verstärkt in Richtung einer frühen Phosphatsenkung und damit einer Verbesserungen des Outcomes. Die Schwierigkeit besteht darin, dass Phosphat im frühen Stadium der Niereninsuffizienz ein schlechter Biomarker ist. In Zukunft könnten uns andere Biomarker oder auch FGF 23 eine viel bessere Prognose ermöglichen, und vielleicht werden wir auch über FGF 23 intervenieren können