Allogene Stammzelltransplantation bei Patienten mit chronisch myeloischer Leukämie
Die chronisch myeloische Leukämie (CML) ist eine myeloproliferative Stammzellerkrankung, die zytogenetisch definiert ist durch das Vorhandensein des sogenannten BCR-ABL1-Onkoproteins, das durch eine Translokation zwischen den Chromosomen 9 und 22 zustande kommt. Dieses Protein besitzt Tyrosinkinaseaktivität und führt so zu einer unkontrollierten Proliferation der myeloischen Vorstufen. Der klinische Verlauf wird eingeteilt in eine chronische, akzelerierte und Blastenphase.
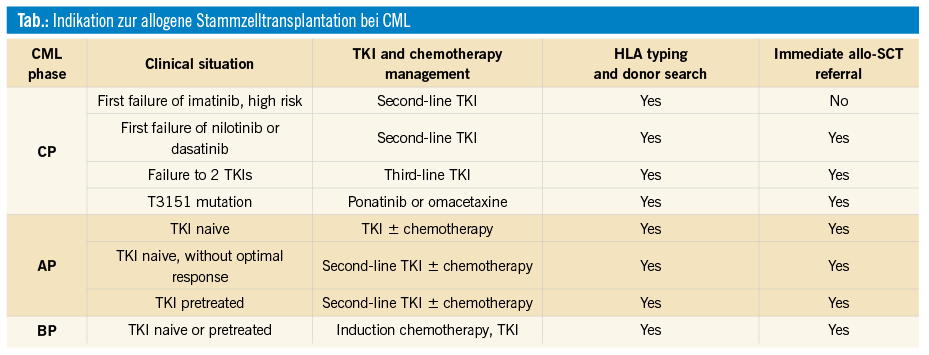
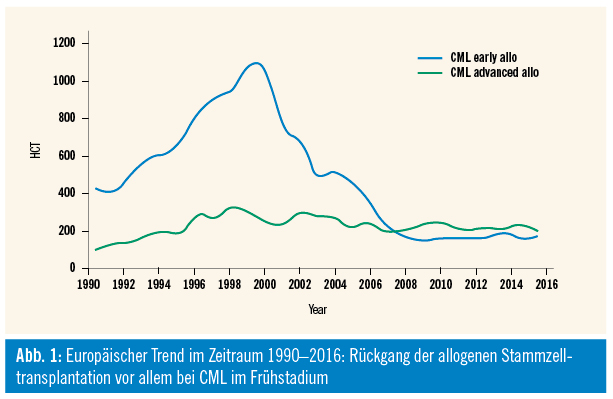
Die Therapie wurde im Jahr 2002 – durch die Zulassung von Imatinib, einem oralen Tyrosinkinasehemmer (TKI) – nahezu revolutioniert. Mittlerweile gibt es für die Erstlinienbehandlung drei weitere zugelassene TKIs, diese sind Nilotinib, Dasatinib und Bosutinib. Die einzige potenziell kurative Behandlung ist allerdings nach wie vor die allogene Stammzelltransplantation. Es hat sich lediglich die Indikationsstellung dahingehend geändert, dass hauptsächlich Patienten mit erworbener oder primärer TKI-Resistenz und/oder Versagen in akzelerierter Phase oder Blastenphase transplantiert werden (siehe Tab., Barrett et al., Blood Spotlight 2015). Diesen Behandlungsalgorithmen entsprechend sind die Transplantraten daher deutlich zurückgegangen, in den letzten 10 Jahren konnte allerdings weiterhin ein konstanter Prozentsatz an CML-Patienten dokumentiert werden (ca. 400 pro Jahr), für die weiterhin eine Indikation zur allogenen Transplantation besteht (siehe Abb. 1, EBMT-Jahresbericht 2016, Passweg et al., BMT 2018).
EBMT-Score
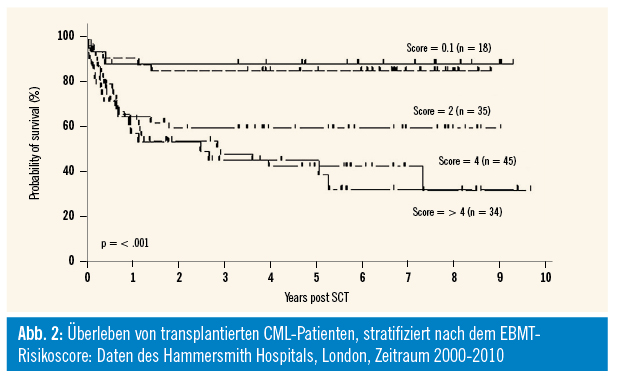
Die Stammzelltransplantation bei der CML wurde vorwiegend von John Goldman, einem Pionier in der Behandlung dieser Erkrankung, in den 1980er Jahren am Hammersmith Hospital in London entwickelt und kontinuierlich verbessert. Initial wurde vorwiegend autolog transplantiert, erst mit der Entdeckung des HLA-Systems und der Möglichkeit von genaueren Spendersuchen konnten auch allogene Transplantationen in den 1990er Jahren mit Erfolg durchgeführt werden. Von der European Group for Blood and Marrow Transplantation (EBMT) wurde ein Score entwickelt, der das 5-Jahres-Overall-Survival sehr genau vorhersagen kann (siehe Abb. 2, Pavlu et al., Blood 2011). Dieser Score besteht aus folgenden Variablen: Krankheitsstatus zum Zeitpunkt der Transplantation, Alter des Empfängers, Dauer der Diagnose bis zur Transplantation, Spendertyp (Fremd- oder Geschwisterspender) und Geschlecht von Spender/Empfänger. Später wurde in vielen Arbeiten gezeigt, dass dieser Score auch prädiktiv bei anderen hämatologischen Erkrankungen ist.
Graft-versus-Leukämie-Effekt
Ein besonderes Charakteristikum bei der Transplantation von CML-Patienten ist der ausgeprägte T-Zell-vermittelte Graft-versus-Leukämie-(GvL-)Effekt, der durch die Gabe von Spenderlymphozyten (DLI) – im Falle eines ungünstigen Verlaufs oder Rückfalls der Erkrankung – auch noch intensiviert werden kann. Diese Alloreaktivität macht wahrscheinlich einen Großteil des kurativen Potenzials der Stammzelltransplantation aus. Darauf basierend wurden daher auch bei der CML dosisreduzierte Konditionierungen (RIC = Reduced Intensity Conditioning) entwickelt, die mit einer niedrigen transplantassoziierten Mortalität (TRM) assoziiert sind und dem Immunsystem Zeit geben einen GvL-Effekt auszubilden.
TKI-Vorbehandlung
Hervorzuheben ist auch, dass TKI-vorbehandelte Patienten keinen Nachteil hinsichtlich Toxizität und Überleben nach einer Transplantation haben, was vor allem deshalb wichtig ist, weil heutzutage jeder CML-Patient schon mit einem TKI vorbehandelt ist.
Auch bei der Frage nach dem optimalen Spender gibt es mittlerweile vielversprechende Studien, dass auch alternative, haploidente Familienangehörige zum Einsatz kommen können. Wichtig und zwingend erforderlich im Post-transplant-Verlauf ist ein enges molekulares Monitoring (BCR/ABL-PCR, Chimärismus), um sehr frühzeitig auf ungünstige Veränderungen mit der Gabe eines TKIs und/oder von DLI reagieren zu können. Hier ist die Datenlage allerdings, insbesondere für eine Erhaltungstherapie mit einem TKI, noch nicht so gut untersucht wie bei der Philadelphia-Chromosom-positiven akuten lymphatischen Leukämie, sodass es keine einheitliche Empfehlung dafür gibt.
Zusammenfassend kann gesagt werden, dass das Overall Survival nach einer allogenen Stammzelltransplantation durch die Verbesserung aller supportiven Maßnahmen, durch die Möglichkeit der dosisreduzierten Konditionierung und sicherlich auch durch ein verbessertes Graft-versus-Host-Disease-(GvHD-)Management in den letzten Jahrzehnten signifikant verbessert werden konnte. Für die Patienten mit TKI-Versagen und/oder -Resistenzen in einer fortgeschrittenen Phase der Erkrankung ist die Transplantation weiterhin eine potenziell kurative Behandlungsoption, die frühzeitig bei Vorliegen einer Indikation in Erwägung gezogen werden sollte.






















































































_Felicitas_Matern_opt.jpg)

