Antiangiogenese beim nichtkleinzelligen Bronchialkarzinom
Antiangiogene Medikamente sind ein wesentlicher Bestandteil in der Behandlung von Patienten mit nichtkleinzelligem Bronchialkarzinom (NSCLC). Dies ist darauf zurückzuführen, dass Lungenkarzinome entscheidend von der Angiogenese (Bildung neuer Gefäße) abhängig sind, um weiterwachsen zu können1, 2. Die Hypoxie ist dabei der entscheidende Faktor, dass eine vermehrte Produktion von Wachstumsfaktoren erfolgt und Angiogenese induziert wird. Dabei nimmt der vaskuläre endotheliale Wachstumsfaktor (VEGF) eine zentrale Rolle ein, daher ist der VEGF-Signalweg der primäre Angriffspunkt antiangiogener Tumorsubstanzen. In der Therapie des NSCLC sind derzeit drei antiangiogene Substanzen zugelassen, welche alle den VEGF/R-Signalweg blockieren. In der Erstlinientherapie des metastasierten NSCLC zeigte der neutralisierende VEGF-Antikörper Bevacizumab in Kombination mit Chemotherapie eine Verlängerung des Gesamtüberlebens. Ramucirumab, ein VEGF-Rezeptor-Antikörper, und Nintedanib, ein antiangiogener Multityrosinkinase-Inhibitor, sind für die Zweitlinientherapie des NSCLC in Kombination mit Docetaxel zugelassen3. Alle drei Substanzen sind fest in den Leitlinien der Therapie des NSCLC verankert und bereits seit mehreren Jahren erfolgreich in klinischer Anwendung4. Dennoch profitieren nicht alle Patienten von einer antiangiogenen Therapie, und die Forschung befasst sich sehr stark mit der Identifizierung von prädiktiven Biomarkern. Ein Hauptnachteil besteht darin, dass unser Verständnis der Tumorangiogenese und der Reaktion des Tumors auf antiangiogene Medikamente größtenteils aus präklinischen Studien stammt und wir immer noch ein sehr schlechtes Verständnis von den Wirkmechanismen haben und welche Mechanismen bei Patienten zu einer Resistenz führen. Unglücklicherweise konnte bis dato kein prädiktiver Biomarker prospektiv validiert werden5. Die am häufigsten in retrospektiven Studien untersuchten Marker sind dabei zirkulierende Wachstumsfaktoren wie z.B. VEGF selbst. Beispielsweise konnte im NSCLC wie auch in anderen Tumorentitäten mehrmals gezeigt werden, dass durch den Einsatz von antiangiogenen Substanzen VEGF oder andere Wachstumsfaktoren signifikant hoch reguliert werden und z. B. der lösliche VEGFR2 (sVEGFR2) abfällt. Diese inverse Korrelation konnte auch Resistenz gegenüber antiangiogenen Substanzen vorhersagen und spiegelt dabei höchstwahrscheinlich eine vermehrte Hypoxie im Tumor wider6. Andere mögliche Biomarker wie zirkulierende Zellpopulationen (CEC oder CEP) oder die Messung von Tumorgefäß-spezifischen Markern konnten nur in kleinen akademischen Studien untersucht werden (bedingt durch eine schwer durchzuführende breite Umsetzbarkeit der sehr spezifischen Methodik). Daher sind prospektiv geplante Biomarker-Analysen mit fundierter Statistik, validierten Assays und standardisierter Probenentnahme während des Einsatzes von antiangiogenen Substanzen, integriert in randomisierte Phase-III-Studien, für ein besseres Verständnis der Wirkungsmechanismen von antiangiogenen Therapien unerlässlich. Ein weiteres Hindernis bei der erfolgreichen Entwicklung von antiangiogenen Arzneimitteln ist, dass die Tumorangiogenese viel komplexer ist, als anfangs gedacht. Daher ist es dringend erforderlich, andere Wege zu überdenken und zu erforschen, als die „traditionelle“ proangiogene Signalweiterleitung zu hemmen.
„Tumor vessel normalization“ (TVN)
Ein neues Therapiekonzept stammt aus der präklinischen Forschung, wo gezeigt wurde, dass eine Normalisierung des pathologischen Gefäßsystems zu einem Synergismus mit anderen Therapieansätzen führt7. Diese sogenannte „Tumor vessel normalization“ (TVN) führt dazu, dass der Tumor weniger aggressiv und das Tumor-Microenvironment positiv beeinflusst werden soll. Aufgrund der TVN sollen Hypoxie und Azidose ausgeglichen und deren lähmender Einfluss auf z. B. das Immunsystem unterbunden werden (Azidose und Hypoxie inhibieren Immunantwort). Klinisch konnte man mit verschiedensten bildgebenden Verfahren ein Zeitfenster der TVN nachweisen, dennoch ist der Einsatz unserer drei zugelassenen antiangiogenen Medikamente bzgl. ihrer Fähigkeit, TVN zu induzieren, nicht konklusiv untersucht und verstanden (z. B. Dosis, Zeitintervall usw.). Diese Bestrebungen, die TVN klinisch besser zu untersuchen, wären sicher von hohem akademischem Wert und sind vielleicht besser durchführbar, wenn der Patentschutz von Bevacizumab in naher Zukunft abläuft und es auch Biosimilars am Markt geben wird8.
Kombination mit Immun-Checkpoint-Inhibitoren
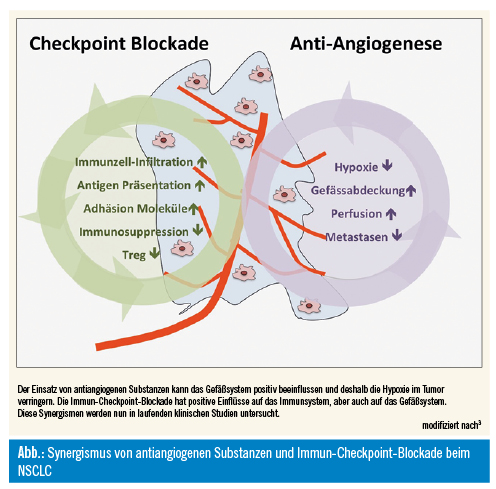
Auch die Tumor-Mikroumgebung und das Stroma sind entscheidende Regulatoren der Angiogenese- und Resistenzmechanismen. Weiters hat der Einsatz von Immun-Checkpoint-Inhibitoren die Therapie des NSCLC revolutioniert, dennoch profitieren nicht alle Patienten von der Immuntherapie. Präklinische Modelle liefern eine klare Begründung für die Kombination von antiangiogenen Substanzen gemeinsam mit einer Immun-Checkpoint-Blockade durch Ausüben einer starken synergistischen Antitumoraktivität (Abb.)3. Aus diesem Grund wurden zahlreiche klinische Studien initiiert, die diese neuartige Kombinationstherapie in verschiedenen Tumorentitäten untersuchen, sich im Speziellen aber auf das NSCLC konzentrieren. Erste Daten sind sehr vielversprechend und scheinen neben guten Ansprechraten auch ein gutes Toxizitätsprofil aufzuweisen. Beispielsweise berichten erste Phase-I/II-Daten über eine Überlegenheit der kombinierten Behandlung von antiangiogenen Medikamenten und Immun-Checkpoint-Blockade im Vergleich zur Monotherapie, dennoch müssen diese Daten mit Vorsicht interpretiert werden, da Daten von Phase-III-Studien abgewartet werden müssen, bevor endgültige Schlussfolgerungen gezogen werden können3. Darüber hinaus scheint der Vergleich mit den Zulassungs-Monotherapie-Studien bisher schwierig zu sein, da sich die Therapiealgorithmen im Laufe der Zeit veränderten und nur direkte Vergleiche diese offenen Fragen beleuchten können. Daher erwarten wir in den nächsten 3–5 Jahren praxisrelevante Ergebnisse aus laufenden Studien zur Immunonkologie in Kombination mit antiangiogenen Wirkstoffen. Erste interessante Daten zur Dreifachkombination aus Chemotherapie, antiangiogener Therapie und Immun-Checkpoint-Blockade wurden am diesjährigen ASCO-Meeting präsentiert9. Die sogenannte IMpower150-Studie untersuchte ein chemotherapiebasiertes Regime (Carboplatin/Paclitaxel) + Atezolizumab (anti-PD-L1-Antikörper) +/– Bevacizumab gegen Chemotherapie alleine in drei Studienarmen bei insgesamt 1.202 Patienten mit nichtplattenepithelialem NSCLC im Stadium IV. Interessanterweise waren in der Studie auch EGFR- und ALK-positive Karzinome (13 % der Patienten) enthalten, eine Patientenpopulation, die normalerweise von Immuntherapiestudien ausgeschlossen ist. Der primäre Endpunkt der Studie war das Gesamtüberleben, welches mit der Triple-Therapie gegenüber der Double-Therapie signifikant verlängert wurde, und zwar mit einer HR = 0,78 in den beiden investigativen Armen vs. Chemotherapie (ITT-Wildtyp-Population) (p = 0,0164). Besonders gut erscheinen die Ergebnisse bei Patienten mit Lebermetastasen. Neu ist, dass Immuntherapie + Antiangiogenese kombiniert mit Chemotherapie auch bei EGFR/ALK-mutierten Patienten einen Überlebensvorteil gegenüber Chemotherapie zeigt. Diese Kombination ist in diesem selektionierten Patientenkollektiv sicher als neue hocheffektive therapeutische Option zu betrachten.
Zusammenfassung
Insgesamt kann man zusammenfassen, dass die Inhibition der Tumorangiogenese mit den drei zugelassenen Substanzen beim NSCLC einen wichtigen therapeutischen Eckpfeiler darstellt. Dabei lassen höchstwahrscheinlich der anstehende Wechsel der Immuntherapie in die Erstlinienkombinationstherapie (analog z. B. Keynote-189, Keynote-407, IMpower131, Checkmate-227) sowie auch die Kombinationstherapie aus antiangiogenen Substanzen mit Immuntherapie die Antiangiogenese ein „Revival“ erleben. Weiters wurde ja auch bereits gezeigt, dass die Kombination aus allen drei Therapiestrategien (IMpower150) in der Erstlinientherapie hoch effektiv ist. Dennoch wird immer klarer, dass die Tumorangiogenese und ihre Resistenz ein hoch adaptiver und komplexer Prozess ist, der auf verschiedensten Ebenen reguliert wird, und die Heterogenität des Tumormilieus bis dato wenig untersucht und verstanden ist. Die bessere Charakterisierung des Tumor-Microenvironments und die Interaktion verschiedener Zellkompartimente werden neue Therapiestrategien identifizieren und zeigen, dass Kombinationsstrategien hoch effizient eingesetzt werden können.