Die EGFR-Resistenz, was dann?
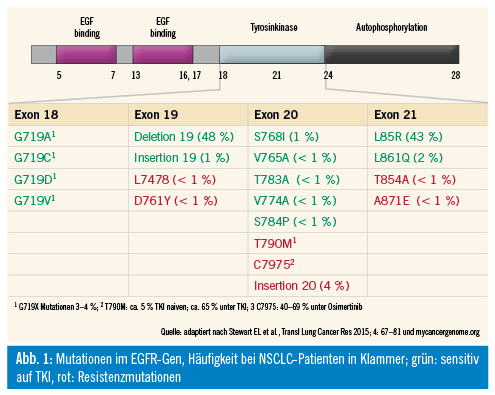
Die aktivierende Epidermal Growth Factor Receptor (EGFR)-Mutation tritt bei ca. 10 % der kaukasischen Patienten und bei ca. 35 % der asiatischen Patienten auf und ist somit die häufigste dieser seltenen Treibermutationen. Betroffen sind v. a. Frauen, jüngere Patienten und Nie- oder Leichtraucher. Es wird eine Reflextestung bei allen Patienten mit nicht kurativ behandelbarem, nichtplattenepithelialem NSCLC empfohlen. EGFR-Mutationen treten innerhalb der Exons 18–21 des EGFR-Kinase-Gens auf, am häufigsten als Deletion im Exon 19 oder als Punktmutation (L858R) im Exon 21. Sie führen zu einer kontinuierlichen Aktivierung der EGFR-Kinase und dadurch von untergeordneten Signalkaskaden, die für das Überleben der Zellen von Bedeutung sind. Neben diesen häufigen EGFR-Mutationen existieren aber auch seltene (engl. uncommon) Mutationen und primäre Resistenzmutationen im EGFR-Gen (Abb. 1).
TKIs in der Erstlinientherapie
Zur Erstlinientherapie des NSCLC mit aktivierender EGFR-Mutation sind in Europa derzeit vier Tyrosinkinaseinhibitoren (TKIs) zugelassen: die Erstgenerationen-TKIs Erlotinib und Gefitinib, der Zweitgenerationen-TKI Afatinib und der Drittgenerationen-TKI Osimertinib. Alle Substanzen zeigten gegenüber der Chemotherapie eine deutliche Verbesserung des progressionsfreien Überlebens und der Lebensqualität. Überlebensunterschiede sind aufgrund des Crossover-Effekts bei Studien TKI vs. Chemotherapie selten, da fast alle Patienten nach Chemotherapieversagen einen TKI erhalten und von diesem profitieren.
Im direkten Vergleich der vier Substanzen war Afatinib in der LUX-Lung-7-Studie Gefitinib in Bezug auf PFS und der Zeit bis zum Versagen der Therapie (TTP) signifikant überlegen, ein OS-Vorteil konnte nicht gezeigt werden. Der bis dato einzige zugelassene Drittgenerationen-TKI Osimertinib hat in der FLAURA-Studie als Erstlinientherapie im direkten Vergleich mit Erlotinib bzw. Gefitinib einen deutlichen Vorteil in Bezug auf PFS (18,9 vs. 10,2 Monate) gezeigt. Auch die zerebrale Kontrolle war unter Osimertinib deutlich besser, Überlebensdaten sind derzeit noch ausständig. Bis dato war Osimertinib in der Zweitlinie bei Auftreten der T790M-Resistenzmutation zugelassen.
Seltene Mutationen
Daten über die Wirksamkeit von TKIs bei seltenen Mutationen stammen aus Metaanalysen großer Studien. Die Mutationen G719X, L861Q und S768I beispielsweise zeigen auf Afatinib gleiches Ansprechen wie die häufigen EGFR-Mutationen und sollten somit lt. S3-Leitlinien auch mit diesem TKI behandelt werden. Auch für Osimertinib konnte rezent am World Lung Cancer Congress (WCLC) im September 2018 eine Wirksamkeit bei diesen Mutationen gezeigt werden. Weiters wurden erstmals Erfolge bei der Exon-20-Insertion gezeigt. Der TKI Poziotinib konnte in einer Phase-II-Studie Ansprechraten bis 55 % bei teilweise mehrfach vorbehandelten Patienten mit EGFR-Ins-20 zeigen.
Progression: Lokalisation
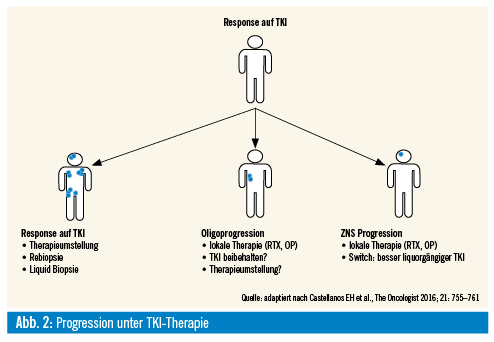
Trotz verbesserter therapeutischer Möglichkeiten entwickeln Patienten mit EGFR-Mutation nach durchschnittlich 11–18 Monaten einen Progress unter TKI-Therapie. Dieser kann allein im ZNS, an wenigen Lokalisationen (Oligoprogression) oder systemisch auftreten (Abb. 2)
- ZNS: Wenn bei sonst stabiler Erkrankung ein ZNS-Progress auftritt, ist dieser weniger auf eine Resistenz der Tumorzellen gegen die laufende Therapie, sondern mehr auf eine mangelnde Überwindung der Blut-Hirn-Schranke zurückzuführen. Lokale therapeutische Maßnahmen wie Stereotaxie und Operation sollten zusätzlich zur TKI-Therapie zum Einsatz kommen, ein Wechsel auf eine TKI-Therapie mit besserer zerebraler Penetranz (Osimertinib vs. Gefitinib/Erlotinib) sollte versucht werden.
- Bei Oligoprogression sollten ebenfalls lokale Maßnahmen (OP, Bestrahlung) angewandt werden, die laufende Therapie muss nicht zwangsläufig geändert werden.
- Ein systemischer Progress erfordert jedenfalls eine Therapieumstellung.
Resistenzmechanismen
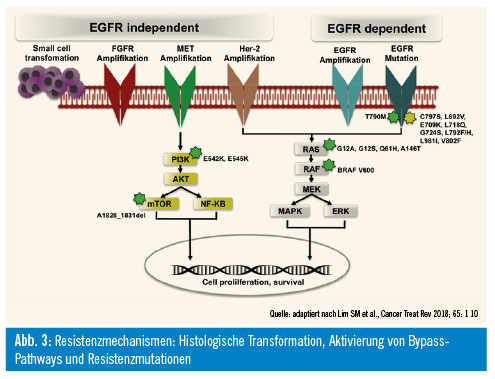
Bei erworbener Resistenz unter einer laufenden TKI-Therapie können verschiedene Mechanismen unterschieden werden (Abb. 3):
- Entstehung von EGFR-Resistenzmutationen (z. B. T790M, C797S)
- Aktivierung von Bypass-Signalwegen
- Histologische Transformation
EGFR-Resistenzmutationen: Sowohl unter Erst- und Zweitgenerationen-TKIs als auch unter Osimertinib können EGFR-Resistenzen auftreten.
Die häufigste erworbene Resistenzmutation unter Erst- bzw. Zweitgenerationen-TKIs ist bekanntermaßen die T790M-Mutation (60 %). Die Substitution von Threonin durch Methionin an der Gatekeeper Position 790 im Exon 20 führt zu einer Veränderung der ATP-Bindungstasche am EGF-Rezeptor, die zwar die Bindung von ATP erlaubt, aber die Erst- und Zweitgenerationen-TKIs aus der Bindungstasche verdrängt. Osimertinib kann diese Resistenz überwinden und ist in der Zweitlinie einer Chemotherapie deutlich überlegen (AURA-3-Studie, PFS: 10,1 vs. 4,4 Monate, HR = 0,32).
Mit dem zunehmenden Einsatz von Osimertinib in der Erstlinie werden jedoch auch weitere Resistenzmutationen detektiert werden. Die häufigste ist mit ca. 30 % C797S, sie verhindert durch eine Punktmutation die Bindung von Osimertinib. Therapeutische Optionen wie die Kombination von Osimertinib und Gefitinib werden derzeit untersucht. Weitere tertiäre Resistenzmutationen wie L718Q und C775Y sind mittlerweile bekannt, haben bis dato jedoch keine therapeutische Konsequenz.
Eine von Oxnard et al. rezent im JAMA Oncology publizierte Arbeit zeigt einen Zusammenhang zwischen Resistenzmechanismen unter Osimertinib und dem Verlust bzw. dem Erhalt der T790M-Mutation. Patienten, bei denen in der Rebiopsie nach Progress T790M weiterhin nachweisbar war, hatten zu 69 % auch die tertiäre Resistenzmutation C797S. Diese Patienten profitierten auch deutlich länger von Osimertinib (12,6 Monate) als Patienten, bei welchen in der Rebiopsie T790M nicht mehr nachweisbar war (5,5 Monate). Bei dieser Gruppe konnten als Resistenzmechanismen am häufigsten die Transformation in ein kleinzelliges Lungenkarzinom und eine MET-Amplifikation detektiert werden.
Aktivierung von Bypass-Signalwegen: Unabhängig vom EGF-Rezeptor können beispielsweise durch MET- oder HER2-Amplifikationen, durch Mutationen innerhalb des PIK3CA- und MAPK-Pathways oder durch das Auftreten weiterer aktivierender Mutationen wie BRAF oder RET alternative Bypass-Signalwege aktiviert werden.
MET-Amplifikationen können sowohl primär wie auch als erworbene Resistenzmutationen unter EGFR-TKI-Therapie auftreten. MET kodiert für die Tyrosinkinase c-MET, die Aktivierung setzt mehrere Signalkaskaden für Proliferation, Invasion und Migration in Gang. Bei Patienten mit MET-Amplifikation wurde unter Therapie mit dem ALK/ROS/MET-Inhibitor Crizotinib ein Ansprechen in Abhängigkeit von der Höhe der MET-Amplifikation gezeigt (high-level MET-Amplifikation: ORR = 50 %). Kombinationstherapien von MET-Inhibitoren (Crizotinib, Cabozantinib, Savolitinib) mit am EGF-Rezeptor wirksamen TKIs bei Vorliegen beider Mutationen werden derzeit untersucht.
Auch die Detektion einer BRAF-V600-Mutation könnte ein potentielles neues Target für eine TKI-Therapie darstellen. Die Kombinationstherapie von Trametinib und Dabrafenib zeigt in der Erstlinie und nach Chemotherapieversagen gute Daten.
Histologische Transformation: Auch die Transformation eines EGFR-mutierten NSCLC in ein kleinzelliges Lungenkarzinom kann als Grund für eine Resistenz vorkommen. Die Häufigkeit bewegt sich in der Literatur zwischen 5 und 14 % und ist damit häufiger als bei Wildtyp-NSCLC. Die Tumorzellen können dabei auch die ursprüngliche EGFR-Mutation behalten. Der genaue Mechanismus der Transformation ist bis dato noch nicht geklärt. Der Verlust des Retinoblastoma-Gens (RB1) wurde bei nahezu allen Patienten mit histologisch gesicherter Transformation von EGFR-mutiertem NSCLC in SCLC nachgewiesen. Bei SCLC sollte jedenfalls eine Chemotherapie zum Einsatz kommen.
Therapeutische Optionen
Die Detektion von Resistenzmechanismen ist für die weitere Therapie von Patienten mit EGFR-Mutationen wichtig. Neben dem Einsatz von TKIs bei Resistenzmutationen bzw. Amplifikationen kann auch die Verabreichung einer Chemotherapie bei Transformation in ein kleinzelliges Lungenkarzinom notwendig sein. Die Immuntherapie mit Checkpoint-Hemmern konnte allerdings bei Patienten mit Treibermutationen in der Monotherapie nicht die gleichen Erfolge zeigen wie bei Wildtyp-Patienten. Daher wurden Patienten mit aktivierenden Mutationen aus vielen Studien ausgeschlossen. Eine Ausnahme stellt die IMpower150-Studie dar. Sie untersuchte die Kombination von Atezolizumab mit Carboplatin, Paclitaxel und Bevacizumab gegenüber dem Kontrollarm Carboplatin, Paclitaxel und Bevacizumab bei Patienten mit Adenokarzinomen der Lunge. Neben einem OS- und PFS-Vorteil zugunsten der 4-fach Kombination schnitt vor allem die Subgruppe der Patienten mit EGFR- und ALK-Mutationen sehr positiv ab (OS: HR = 0,54; 95 % CI 0,29–1,03). Somit stellt die Kombination von Chemo- und Immuntherapie mit Angiogenesehemmung für diese Patientengruppe eine Option dar.
Resümee
Die Erstlinien-TKI-Therapie bei Lungenkarzinompatienten mit EGFR-Mutation ist der Standard, wobei durch neuere Medikamente das PFS signifikant verbessert werden konnte. Bei Progress ist es von zunehmender Wichtigkeit, den Resistenzmechanismus zu detektieren, um nach Möglichkeit weiter zielgerichtet behandeln zu können. Alternativ kann auch eine Kombination von Checkpoint-Hemmern mit Chemotherapie und Antiangiogenese zum Einsatz kommen.