Im Wandel der Zeit – MRD-Monitoring der akuten lymphatischen Leukämie
Nach der deutschen GMALL-Studiengruppe werden unterschiedliche Therapieprotokolle für Philadelphia- Chromosom-positive Patienten, reifzellige B-ALL und B-/T-Vorläufer-ALL verwendet. Auch das Alter fließt als Entscheidungsgrundlage in die Therapieprotokolle ein, da Patienten über 55 Jahre eine schlechtere Prognose haben als jüngere Patienten. Der Tumorload, der Immunphänotyp sowie zytogenetisch bzw. molekularbiologisch detektierbare genetische Veränderungen haben große prognostische Relevanz. Eine Verbesserung des Überlebens von erwachsenen ALL-Patienten auf über 50 % ist durch diese risi – koadaptierte Behandlung unter Einbeziehung der Stammzelltransplantation realistisches Ziel und wird bei einzelnen Subtypen (wie z. B. dem Burkitt-Lymphom) bereits erreicht, aber auch durch den Einsatz zielgerichteter etablierter Medikamente (Ri tuximab, Imatinib) und neuer Substanzen (Anti-CD22-Antikörper Epratuzumab, Anti-CD3- und Anti-CD19- Antikörper Blinatumomab, FLT3-Inhibitoren u. a.). Die Bestimmung der minimalen Resterkrankung (MRD) nach Erreichen einer kompletten Remission ist ebenfalls ein essenzieller Bestandteil moderner Therapiekonzepte. Modernste Diagnostik mittels multiparametrischer FACS-Analyse oder Bestimmung patientenspezifischer molekularer Marker ermöglichst bei fast allen ALL-Patienten eine quantitative MRD-Bestimmung. Der Nachweis residualer Blastzellen 10 Wochen nach Beginn der Induktionstherapie oder ein Wiederauftreten einer MRD ist mit einem erhöhten Risiko eines hämatologischen Rezidivs verbunden: Ein zu diesem Zeitpunkt vorhandener MRD-Level von mehr als 10–4 wird als Hochrisiko- Indikator (High Risk) für ein Rezidiv angesehen, bei mehr als 10–3 spricht man von einem „sehr hohen“ Rezidivrisiko (very high risk). Im vorliegenden Artikel werden die diagnostischen Möglichkeiten des MRD-Monitoring und ihrer spezifischen Vorteile, Nachteile und Grenzen beleuchtet.
MRD-Monitoring mittels Immunphänotypisierung
Durchflusszytometrische Immunphänotypisierung, Bestimmung von MRD und der Nachweis von BCR-ABL-Fusionsproteinen sind unverzichtbare Werkzeuge in der Diagnostik der ALL und ihre Ergebnisse sind von großem Nutzen für die therapeutische Entscheidungsfindung. In den letzten Jahren wurde die Multiparameter- Durchflusszytometrie und deren Immunphänotypisierung ein wichtiges Instrument für die Diagnose und Überwachung des Ansprechens auf die Therapie in einem breiten Spektrum von Krankheiten, einschließlich ALL. Neben anderen Vorteilen ermöglicht die durchflusszytometrische Immunphänotypisierung eine schnelle quantitative Beurteilung mehrerer Merkmale aus Millionen von Zellen. Dies stellt ein Werkzeug für die genaue Identifizierung und Charakterisierung von neoplastischen Zellen unter normalen Zellen im peripheren Blut, Knochenmark und auch in der Rückenmarksflüssigkeit dar, auch wenn Tumorzellen mit sehr niedrigen Frequenzen (< 10–5) unter einer großen Population normaler Zellen vorhanden sind.
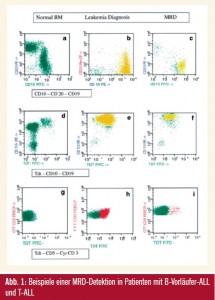
Abb. 1 zeigt Beispiele einer MRD-Detektion in Patienten mit B-Vorläufer-ALL und T-ALL. Plot a, d und g zeigen ein normales Knochenmark-Antigen-Expressionsmuster. Plot b, e und h zeigen leukämischen Blasten (gelbe Punkte für B-ALL und rot für T-ALL). Plot c, f und i zeigen den MRD-Verlauf in Follow-up-Proben. Plot c und f sind von Patienten mit B-Vorläufer- ALL (gelbe Punkte, MRD-Niveau 0,6 %). Plot i ist von einem Patienten mit T-ALL (rote Punkte, MRD-Niveau 0,037 %). Normale B- und T-Zellen in den Follow-up-Proben sind als grüne Punkte dargestellt1.
Flowzytometrie und Fusionsproteine
BCR-ABL-Fusionsproteine zeigen erhöhte Signalgebung durch ihre ABL-Tyrosinkinase- Domäne, die durch spezifische Inhibitoren blockiert werden kann. Dies stellt auch eine effektive Behandlung bei BCR-ABL-positiven akuten lymphatischen Leukämien dar. Die Detektion von BCR-ABL-Aberrationen ist somit für die Diagnose, Klassifikation und Behandlung von Patienten mit akuter lymphatischer Leukämie von großer Bedeutung. BCR-ABL-Aberrationen werden derzeit durch Karyotypisierung, Fluoreszenz-insitu- Hybridisierung (FISH) oder PCRTechniken bestimmt, die zeitaufwendig sind und spezialisierte Einrichtungen erfordern.
Zuletzt wurde ein einfacher durchflusszytometrischer Immunobead-Assay zum Nachweis von BCR-ABL-Fusionsproteinen in Zell-Lysaten entwickelt, mit einem Bead-gebundenen Anti-BCR-fangenden Antikörper und einem Fluorochrom-konjugierten Anti-ABL-Nachweisantikörper.
MRD-Monitoring mittels Molekularbiologie
Die derzeit sensitivste Methode, um MRD nachzuweisen, ist die molekularbiologische Methode der PCR (Polymerase- Kettenreaktion). Dabei wird ein definierter Abschnitt der DNA in einer Kettenreaktion vermehrt (amplifiziert), wodurch geringe Mengen an DNA nachweisbar werden. Dieser DNA-Abschnitt wird durch synthetische, kurze DNA-Moleküle (Primer) links und rechts abgegrenzt, der Bereich zwischen den Primern wird amplifiziert. Bei der quantitativen PCR (Q-PCR) wird zusätzlich eine mit einem Fluoreszenzfarbstoff markierte DNA-Sonde eingesetzt, deren Sequenz exakt mit dem amplifizierten Bereich übereinstimmt. Während der Kettenreaktion wird diese Sonde abgebaut und der Farbstoff freigesetzt. Real-Time-PCR-Geräte messen den freigesetzten Farbstoff während der Kettenreaktion (Abb. 2). Damit kann die Menge der Zielsequenz quantifiziert werden, denn je mehr Zielmoleküle in der Probe vorhanden sind, desto früher kann der freigesetzte Farbstoff nachgewiesen werden.
Um die Q-PCR für den Nachweis der MRD anwenden zu können, müssen bestimmte Zielsequenzen vorhanden sein, die nur in der Leukämiezelle vorkommen und nicht in gesunden Blutzellen (molekularer Marker). Bei der ALL gibt es eine Reihe von wiederkehrenden genetischen Veränderungen, etwa BCR-ABL bei der t(9;22), die als MRD-Marker eingesetzt werden können. Bei 60–70 % der erwachsenen Patienten sind solche Veränderungen jedoch nicht zu finden, hingegen haben ca. 95 % dieser Patienten klonale Immunglobulin-(IG-)- und T-Zell- Rezeptor-(TCR-)Gene.
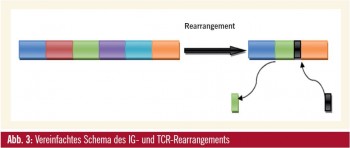
Diese Gene bestehen aus vielen Bausteinen, die in drei Gruppen zusammengefasst werden. Während der frühen Bund T-Zell-Differenzierung werden die variablen (V), diversity (D) und joining (J) Bausteine zufällig miteinander kombiniert (rearrangiert), jeder Lymphozyt enthält daher eine spezifische Kombination von V-D-J-Segmenten. Zusätzlich gehen an den Verbindungsstellen der Bausteine Teile verloren oder kommen dazu (Abb. 3), diese Bereiche sind daher eine Art „Fingerabdruck“ jedes Lymphozyten und als MRD-Marker geeignet.
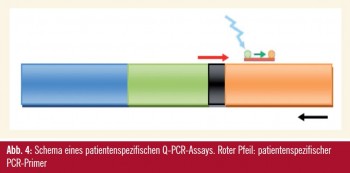
Im ersten Arbeitsschritt wird mittels PCR nach klonalen Bereichen der IG- und TCR-Gene gesucht3. Diese können nur bei Erstdiagnose mit einem erhöhten Blastenanteil gefunden werden, da zu diesem Zeitpunkt prominente PCR-Banden vom polyklonalen Hintergrund unterscheidbar sind. Diese PCR-Banden werden gereinigt und die DNA wird sequenziert, um die rearrangierten Bausteine identifizieren zu können. Die Sequenzen werden mit Sequenzen aus Datenbanken verglichen und jene hochvariablen Bereiche gesucht, die für den malignen Zellklon einzigartig sind. Anschließend werden PCR-Primer synthetisiert, die exakt an diese spezifischen Bereiche binden können (Abb. 4). Für jeden Patienten werden daher spezifische PCR-Assays entwickelt, die nur bei ihm/ihr die maligne Zellpopulation nachweisen können. Wenn möglich, werden pro Patient zwei spezifische Assays für unterschiedliche Bereiche der IG- und TCR-Gene entwickelt, um bei einer klonalen Evolution der Leukämiezellen falsch-negative Ergebnisse zu vermeiden.
Die Qualität der Assays muss strengen Kriterien entsprechen, bevor sie eingesetzt werden können. Diese wurden von der Europäischen Studiengruppe für den MRD-Nachweis bei ALL (EURO-MRD) definiert4. Neben der Sensitivität und dem quantitativen Messbereich ist vor allem auch die Spezifität entscheidend. Daher müssen die patientenspezifischen PCR-Assays eindeutig unterscheidbare Ergebnisse zwischen der Patientenprobe und einer Mischung aus Lymphozyten von zehn gesunden Personen ergeben. Wenn alle Kriterien erfüllt sind, kann eine einzelne Leukämiezelle in bis zu 105 gesunden Zellen nachgewiesen werden. Die Entwicklung der patientenspezifischen PCR-Assays dauert zumindest einen Monat, bei komplexen Rearrangements oder schwierigen Sequenzen kann sich die Entwicklungszeit auf bis zu zwei Monate verlängern. Die eigentlichen MRD-Untersuchungen im Verlauf der Therapie können aber innerhalb weniger Tage durchgeführt werden.
Für rund 90 % der erwachsenen ALL-Patienten ist es möglich, zumindest einen spezifischen MRD-Assay zu entwickeln. In den verbleibenden Fällen können keine klonalen PCR-Produkte gefunden werden (außerhalb der Primer-Bereiche), oder es können keine spezifischen PCRPrimer hergestellt werden.
Der Vorteil von patientenspezifischen MRD-Assays liegt darin, dass diese für fast alle ALL-Patienten entwickelt werden können und derzeit noch eine höhere Sensitivität im Vergleich zur Immunphänotypisierung aufweisen. Weiters ist das DNA-Target des Assays deutlich stabiler als RNA, etwa für BCR-ABL-PCR-Assays. Daher ist der Probentransport für die MRD-Diagnostik in der Regel kein Problem für die Sensitivität der Assays. Nachteilig ist sicherlich der erheblich größere Aufwand im Vergleich zu etablierten PCR-Assays (z. B. BCR-ABL) bzw. zur Immunphänotypisierung, daher kann diese Methode nur zentral in dafür spezialisierten Labors durchgeführt werden.
Bei der Auswahl der MRD-Methodik sollte immer die Gesamtsituation des Patienten betrachtet werden, ob etwa das MRD-Ergebnis eine therapeutische Konsequenz hätte oder nicht.
Zusammenfassung
Das Vorliegen einer MRD ist ein unabhängiger Risikofaktor für Patienten mit ALL. Europäische Studiengruppen wie die österreichische ALL-Studiengruppe haben daher die MRD-Diagnostik zur Risikobewertung und Therapiestratifizierung in ihre aktuellen Studienprotokolle aufgenommen. Im Rahmen des „2. International Symposium on MRD Assessment“ in Kiel wurde von den großen europäischen Studiengruppe eine einheitliche Terminologie zur Beschreibung der MRD-Diagnostik entwickelt („complete MRD response“, „MRD persistence“ und „MRD reappearance“)4. Gleichzeitig wurden wichtige Schritte zur Standardisierung und Validierung der Analytik konsequent durchgeführt, um die Vergleichbarkeit zwischen verschiedenen Labors, aber auch zwischen den Ergebnissen verschiedener ALL-Studiengruppen zu ermöglichen. Daher wurde in Österreich mit Hilfe der AGMT ein zentrales Register mit angeschlossener Biobank gegründet, um Patientendaten und deren MRDV erläufe zu erfassen. Die molekularbiologische MRD-Diagnostik mit patientenspezifischen PCR-Primern erfolgt für Patienten der österreichischen ALL-Studiengruppe in Anlehnung an die in Kiel entwickelte Methodik zentral im KH der Elisabethinen in Linz.
Es bleibt zu hoffen, dass die MRD-Bestimmung bei ALL-Patienten den Weg in eine individualisierte Medizin eröffnet und Patienten mit MRD-Persistenz und Wiederauftreten einer MRD durch Therapieintensivierung bessere Heilungschancen ermöglicht.
1 Björklund E et al., Flow cytometric follow-up of minimal residual disease in bone marrow gives prognostic information in children with acute lymphoblastic leukemia. Leukemia 2003; 17(1):138–148
2 Van der Velden VHJ et al., Detection of minimal residual disease in hematologic malignancies by real-time quantitative PCR: principles, approaches, and laboratory aspects. Leukemia 2003; 17(6):1013–1034,
3 Van Dongen JJM et al., Design and standardization of PCR primers and protocols for detection of clonal immunoglobulin and T-cell receptor gene recombinations in suspect lymphoproliferations: Report of the BIOMED-2 Concerted Action BMH4-CT98-3936. Leukemia 2003; 17(12):2257–2317
4 Brüggemann M et al., Standardized MRD quantification in European ALL trials: proceedings of the Second International Symposium on MRD assessment in Kiel, Germany, 18-20 September 2008. Leukemia 2010; 24(3):521–535