MALT-Lymphom des Magens – Konsensuelle Empfehlungen zum Krankheitsmanagement
Diagnose
Im Hinblick auf die Diagnosestellung empfiehlt das Panel, die histomorphologischen Kriterien laut WHO-Klassifikation heranzuziehen. Vor Beginn einer H.- plyori-Eradikation sollte die Diagnose referenzpathologisch bestätigt werden. Der PCR-Nachweis einer Monoklonalität der veränderten Immunglobulin-Gene ist hilfreich, wenn histologische und immunphänotypische Merkmale nicht ausreichen, stellt aber keine Voraussetzung dar. Dagegen sollte zum Diagnosezeitpunkt eine Testung auf eine Transloka – tion t(11;18) erwogen werden, da das Ergebnis eine Einschätzung des zu erwartenden Ansprechens auf die H.-pylori- Eradikation ermöglicht. Routinemäßige Klonalitätsanalysen in der Nachbeobachtungsphase werden nicht empfohlen; sie geben nicht definitiv Aufschluss über das Rezidivrisiko.
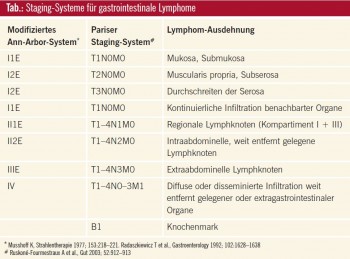
Das Staging hat entscheidende Wichtigkeit für Prognose und Therapiewahl. Im Sinne eines Gastric Mapping sollten Biopsien in ausreichender Zahl aus makroskopischen Läsionen und normaler Mukosa entnommen werden. Der Konsensus legt die Verwendung des Ann-Arbor- Staging-Systems mit seinen Modifikationen durch Musshoff und Radaszkiewicz nahe, eine weitere Möglichkeit besteht in der Paris-Klassifikation (Tab.).
Initial sind körperliche Untersuchung, Routinelabor (komplettes Blutbild, LDH, _2-Mikroglobulin, Serumprotein-Immunfixation, HIV-Test, Hepatitis-C- und -BSerologie) sowie CT-Scan von Thorax und Abdomen empfohlen. Die Endosonographie kann als einziges Verfahren die einzelnen Schichten der Magenwand unterscheiden und erlaubt somit eine Differenzierung der Stadien I1E–II1E und T1-4, N0/1. Bei fehlender Rückbildung nach H.-pylori-Eradikation und vor dem Beginn der onkologischen Therapie wird eine Knochenmarkbiopsie empfohlen. Zu erwägen ist eine Ileokoloskopie, da ein multifokaler Befall des Gastrointestinaltrakts gelegentlich beobachtet wird.
Therapie
Helicobacter pylori: In der überwiegenden Zahl der Fälle geht die Entstehung eines MALT-Lymphoms des Magens auf H.-pylori-Infektionen zurück, weshalb deren Diagnose (vorzugsweise mittels Histologie, im negativen Fall mittels Serologie) und Behandlung unabhängig vom Stadium den ersten Schritt im Krankheitsmanagement darstellt. Als Therapie der Wahl gilt das Tripelschema aus einem Protonenpumpenhemmer (PPI), Clarithromycin und Amoxicillin oder Metronidazol. Falls der Patient kein adäquates Ansprechen zeigt, wird eine bismuthbasierte Vierfachtherapie (PPI, Bismuth, Tetrazyklin, Metronidazol) empfohlen. Auch Patienten mit einem negativen H.-pylori-Nachweis können einer Eradikation als primärer Therapie zugeführt werden.
Das Ergebnis der Therapie sollte zumindest sechs Wochen nach ihrem Ende und zumindest zwei Wochen nach Absetzen des PPI mittels Atemtest überprüft werden. Bei lokalisierter Erkrankung ist in Abhängigkeit von der Eindringtiefe in die Magenwand in 60–90 % mit einer kompletten Remission zu rechnen. Patienten, die nachweislich von der Eradikation profitiert haben, sollten keine andere Therapie erhalten.
Weitere Optionen: Bei fehlendem Ansprechen auf die Eradikation mit Persis – tieren der endoskopischen Läsionen bzw. bei disseminierter Erkrankung oder großer Tumorausdehnung sind weitere lokale oder systemische Maßnahmen notwendig. Vor der „Eradikationsära“ war die operative Sanierung die primäre therapeutische Intervention, heute beschränkt sie sich auf die Behandlung seltener Komplikationen wie Perforation oder Blutung, die nicht endoskopisch kontrolliert werden können.
Sowohl Radio- als auch Chemotherapie haben bei lokalisierter Erkrankung kuratives Potenzial. Wenn möglich, sollten die Patienten in klinische Studien eingeschlossen werden. Die Bestrahlung ist im Stadium IE–II1E (T1-4, N0/1M0B0) nach Versagen der Eradikation effektiv. Verschiedene Formen der Chemo- und Immuntherapie zeigen in allen Stadien Wirksamkeit. Bei disseminierter Erkrankung steht die Indikation zur Chemotherapie außer Frage, aufgrund des Datenmangels konnte bisher allerdings kein Standardregime definiert werden.
Follow-up
Die erste Evaluierung der Lymphom-Regression sollte 3–6 Monate nach Abschluss der Behandlung erfolgen. Für die nachfolgenden Kontrollen werden Intervalle von 4–6 Monaten bis zur kompletten Remission vorgeschlagen. Die Untersuchung umfasst Gastroskopien mit multiplen Biopsien (Mapping gemäß demselben Protokoll wie bei der Diagnosestellung) sowie die Überprüfung der ursprünglichen Manifestationsorte. Komplette Remissionen, die durch zwei unabhängige Gastroskopien bestätigt werden sollen, treten meistens 6–12 Monate nach der Eradikation ein, können aber bis zu 72 Monate in Anspruch nehmen. Nach der Dokumentation einer kompletten Remission werden Kontrollgastroskopien mit Biopsien (Rezidiv, Entstehung eines Magenkarzinoms) empfohlen. Partielle Remissionen machen ein individuell angepasstes Management notwendig. Bei persistierenden makroskopischen Läsionen ist eine onkologische Therapie indiziert; wenn nur eine mikroskopische Infiltration vorliegt, kann diese Form der Behandlung bis zu 24 Monate nach einer erfolgreichen Eradikation verschoben werden. Eine Progression bzw. ein Rezidiv mit Progression erfordert die Initiierung einer onkologischen Therapie. Im Fall eines Rezidivs ohne endoskopische oder klinische Hinweise auf eine Progression stellt eine Watch-and-Wait-Strategie eine gangbare Option dar.
Quelle: Ruskoné-Fourmestraux A et al., EGILS consensus report. Gastric extranodal marginal zone B-cell lymphoma of MALT. Gut 2011; 60:747–758