Allergologie: Aufarbeitung von unerwünschten Arzneimittelreaktionen
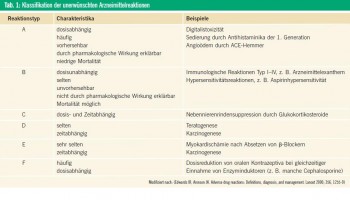
Gemäß der WHO-Definition sind unerwünschte Arzneimittelwirkungen (UAW; englisch: „adverse drug reac tion“ oder auch „adverse drug event“) als Reaktionen auf ein Arzneimittel definiert, die schädlich und unbeabsichtigt sind, bei Dosen auftreten, die normalerweise beim Menschen zur Prophylaxe, Diagnose oder Therapie von Erkrankungen oder zur Modifikation physiologischer Funktionen dienen. RAWLINS & THOMPSON unterteilten 1991 in ihrer ursprünglichen Terminologie die UAW in 2 Gruppen (Tab. 1):
Typ-A-Reaktionen („Augmented Reaction“ = übertrieben starke Reaktion) können pharmakologisch erklärt werden, sind häufig, vorhersehbar und können bei jedem Individuum vorkommen. Üblicherweise sind sie schon vor der Registrierung eines Arzneimittels aus den Zulassungsstudien bekannt, z. B. Sedierung durch Antihistaminika der 1. Generation oder Hauttoxizität vor allem an den Extremitäten durch manche Chemotherapeutika. Typ-A-Reaktionen machen mehr als 80 % aller UAW aus und sind im Arzneimittelkodex vermerkt.
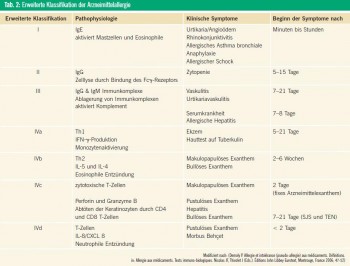
Typ-B-Reaktionen („Bizarr“) sind selten, nicht vorhersehbar, pharmakologisch nicht erklärbar und bleiben auf dafür empfängliche Individuen beschränkt. Typ-BReaktionen machen 13 % aller UAW aus. „Arzneimittelunverträglichkeit“ oder auch „Arzneimittelhypersensitivität“ sind Überbegriffe für alle Arten von Typ-B-Reaktionen, ohne den genauen pathophysiologischen Hintergrund zu berücksichtigen. Alle UAW ohne Beteiligung des Immunsystems sollten als Hypersensitivitätsoder Unverträglichkeitsreaktionen bezeichnet werden, z. B. die Aspirinhypersensitivität. Diese Reaktionen wurden früher auch als „Pseudoallergien“ bezeichnet. Gemäß der neuen Terminologie der World Allergy Organization (WAO) sollte der Begriff „Arzneimittelallergie“ auf Patienten mit einem nachgewiesenen immunologischen Pathomechanismus beschränkt werden. Die Zusätze „sofort“ („immediate“; Typ I, IgE-vermittelt) und „verzögert“ („delayed“; Typ IV, T-Zell-vermittelt) sollen die zeitliche Dynamik und den wahrscheinlichen immunologischen Hintergrund beschreiben. Eine erweiterte Klassifikation von Arzneimittelallergien im eigentlichen Sinne findet sich in Tabelle 2. Das ursprüngliche Klassifikationsschema von RAWLINS & THOMSON wurde später um 4 selten verwendete Klassen erweitert (Tab. 1): Typ C („Chronisch“); Typ D („Delayed“; verzögert, z. B. Karzinogenese oder Teratogenese); Typ E („Ende der Behandlung“; umfasst UAW nach dem Absetzen eines Medikaments, z. B. Myokardischämie nach dem plötzlichen Absetzen eines β-Blockers); Typ F („Fehlen des Therapieerfolges“).
Der vorliegende Artikel wird sich fast ausschließlich Typ-B-Reaktionen widmen.
Epidemiologie
UAW haben eine große Bedeutung für öffentliche Gesundheitssysteme. Eine portugiesische Gruppe um GOMES et al. berichtete 2004, dass 7,8 % einer Zufallsstichprobe der Bevölkerung irgendeine Form einer selbst berichteten „Medikamentenallergie“ angeben. Bei Patienten, die vor einer Anästhesie stehen, kann die Prävalenz einer selbst berichteten UAW 33,4 % erreichen. Eine prospektive britische Studie von PIRMOHAMED et al. konnte 2004 zeigen, das UAW für 6,5 % aller Aufnahmen in Krankenhäuser verantwortlich sind, wobei nicht zwischen Typ A oder B (Tab. 1) unterschieden worden war. Daraus entstanden Kosten von 466 Mio. £ Sterling (695 Mio. ). BIGBY et al. beschrieben in einer 1986 publizierten, klassischen Studie an 15.000 hospitalisierten Patienten die Häufigkeit von Haut-UAW mit 2,2 %. UAW sind der Hauptverursacher von Spitalsaufnahmen wegen Anaphylaxie. In einer nationalen US-Studie berichteten BUDNITZ et al. 2006, dass ein Alter von über 65 Jahren ein 2,4-fach höheres Risiko für eine notärztliche Behandlung aufgrund einer UAW als bei jüngeren Patienten bedeutete.
Trotz der Häufigkeit von UAW sind Todesfälle selten und rangieren zwischen 0,15 % und 0,32 % aller Todesfälle in Krankenhäusern.
Pathophysiologie
Genetik und Umwelt
Eine UAW ist ein komplexer Prozess, der von multiplen Interaktionen von Genprodukten und Umwelt abhängt. 4 verschiedene Gengruppen beeinflussen die Biologie einer UAW:
a. Bioaktivierung eines Arzneimittels: z. B. durch „First-Pass-Mechanismen“ in der Leber
b. Inaktivierung eines Medikaments: z. B. durch Biotransformation wie hepatische Glucuronidierung
c. Immunantwort: z. B. der individuelle MHC-Lokus, auf dem Antigene wie Arzneimittel den T-Zellen präsentiert werden
d. Gewebeschaden und -reparatur: z. B. Zytokine
Umweltfaktoren wie Entzündungen sind wichtige Co-Faktoren, die unspezifische „Danger“-Signale freisetzen. Bekannte Risikofaktoren für das Auftreten einer UAW sind Infektionen mit HIV- und EBV-Viren. Auch häufige Arzneimittelexposition ist ein wichtiger Umweltfaktor, wie z. B. die häufige Anwendung von Antibiotika bei Patienten mit zystischer Fibrose.
Hypersensitivitätsreaktionen
Aspirinhypersensitivität äußert sich durch Asthma bronchiale und/oder Urtikaria/ Angioödem nach der Einnahme von Cyclooxygenase-1 (COX-1)-Hemmern, deren Leitsubstanz Acetylsalicylsäure (Aspirin®) ist. Sie wird durch Polymorphismen im Lipoxygenase-Stoffwechsel verursacht und ist ein typisches Beispiel einer nicht-immunologisch verursachten UAW.
Während IgE-vermittelte Typ-I-Reaktionen wie Urtikaria/Angioödem/Anaphylaxie eindeutig immunologische Reaktionen sind, ist die Beziehung zwischen anderen Hypersensitivitätssyndromen wie „Drug Rash with Eosinophilia and Systemic Symptoms (DRESS)“, „Acute Generalized Exanthematous Pustulosis (AGEP)“, „Erythema Multiforme Majus (EEM)“, „Stevens-Johnson-Syndrome (SJS)“ bzw. „Toxic Epidermal Necrolysis (TEN)“ und dem Immunsystem weniger klar. Einerseits ist die Toxizität von Medikamenten und ihren Metaboliten, wie oben erwähnt, eine wichtige Voraussetzung für UAW. Andererseits gibt es Berichte über spezifische Immunantworten bei schweren Haut-UAW.
Hypothesen: Drei nebeneinander stehende Hypothesen versuchen derzeit verschiedene Teilaspekte der Wechselwirkungen von Arzneimitteln und dem Immunsystem bei der Entstehung von UAW zu erklären:
- T-Zellen können ein Medikament oder dessen Metaboliten erkennen, wenn er ihnen auf dem immunologischen Rezeptor, dem „Major Histocompatibility Complex (MHC)“, von anderen Zellen präsentiert wird. Dafür ist entweder eine direkte molekulare (kovalente) Bindung an den MHC oder eine solche Bindung nach intrazellulärer Prozessierung notwendig – die klassische immunologische Reaktion.
- Das Arzneimittel oder einer seiner Metaboliten bindet an körpereigene Proteine und bildet ein neues Antigen und wird wie oben präsentiert – dies ist die alte „Hapten“-Hypothese.
- Eine Bindung an T-Zellen wie in Hypothese 1, allerdings ohne kovalente (also keine molekulare) Bindung, sondern nur eine pharmakologische Bindung, ähnlich wie Arzneimittel, die nur lose an ihre spezifischen Rezeptoren binden – das neue „P-I-Konzept“ nach Werner Pichler.
Diese drei Hypothesen schließen einander gegenseitig natürlich nicht aus.
Betroffene Organsysteme
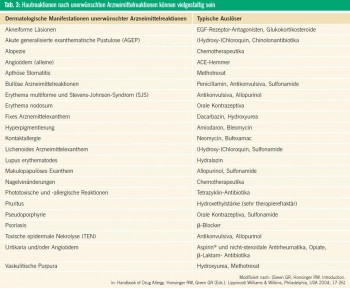
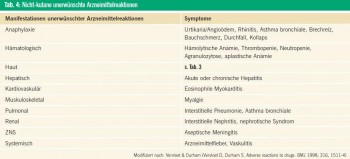
Die klinische Präsentation bei UAW ist mannigfaltig. Die am häufigsten betroffene Organe sind die Haut und ihre Anhangsgebilde (Tab. 3). Viele dieser dermatologischen Zustandsbilder sind nicht typisch für eine UAW und können andere Erkrankungen imitieren. Grundsätzlich können UAW aber fast alle Organsysteme betreffen und treten häufig in Kombination auf (Tab. 4).
Management der akuten UAW
Die Diagnose einer UAW muss so früh wie möglich gestellt und der Auslöser identifiziert werden. Wie der Basler Dermatologe Andreas Bircher betont, ist das einzige Werkzeug im Management einer akuten UAW eine ausführliche (Medikamenten-) Anamnese, wobei als Faustregel gilt, dass das als letzte hinzugekommene Medikament der wahrscheinlichste Auslöser der UAW ist. Weitere wichtige Punkte sind eine sorgfältige klinische Untersuchung (kompletter Haut- und Schleimhautstatus, Lymphknotenstatus, Fieber, Kopfschmerz etc.) und im Bedarfsfall eine Hautbiopsie. In-vitro-Tests sollten Differentialblutbild (Eosinophilie, atypische Lymphozyten), Leber- und Nierenwerte sowie Entzündungsmarker (C-reaktives Protein, Blutsenkung) umfassen. Eine ausführliche Fotodokumentation während der Akutphase erleichtert wesentlich die spätere korrekte Aufarbeitung des Falles. Diese Aufarbeitung sollte frühestens 6 Wochen bis spätestens 6 Monate nach dem Verschwinden der Symptome erfolgen.
Sobald das auslösende Arzneimittel identifiziert ist, muss die Therapie sofort beendet werden. Da UAW meist mild und selbstlimitiert sind, bedürfen sie im Normalfall keiner spezifischen, sondern nur einer symptomatischen Therapie.
Therapie der milden Hautreaktion
Sobald die Gabe des Auslösers beendet ist, ist keine weitere Therapie notwendig. Topische Glukokortikosteroide können optional verabreicht werden. Da immunologisch vermittelte UAW oft nicht durch die Ursprungssubstanz, sondern durch einen Metaboliten verursacht sind, wird die Abheilung bis zum Abbau und Abtransport des Metaboliten aus der Haut einige Zeit dauern. Der Patient sollte auf eine mögliche Verzögerung bis zur kompletten Abheilung hingewiesen werden.
Therapie der schweren Hautreaktion
Schwere Haut-UAW sind mit erhöhter Mortalität verknüpft. Die französischen Dermatologen GHISLAIN & ROUJEAU berichteten 2002 folgende Mortalitätswerte: 10 % bei DRESS, 5–15 % bei SJS und 30–35 % bei TEN. Ein wichtiger Risikofaktor ist das Vorliegen schwer wiegender Komorbiditäten.
Auch hier besteht die Therapie im Wesentlichen in der Identifikation und dem Absetzen des Auslösers. Die restliche Therapie erfolgt symptomatisch, so wie bei schweren Verbrennungen.
Viele Behandler fühlen sich allerdings unwohl, die oft schwer kranken Patienten ohne spezifische Therapie zu versorgen, und so wurden „off-label“ einige Therapien getestet. Hochdosiertes intravenöses Immunglobulin (hdIVIG) bei einer Dosis von ≥ 2 g/kg KG scheint positiv zu wirken. Auch gibt es viel versprechende Berichte über Cyclosporin und den TNF-α-Rezeptor-Antagonisten Infliximab (Remicade®).
Anaphylaxie
Die Behandlung Typ-I-allergischer, anaphylaktischer Ereignisse übersteigt den Horizont dieser kurzen Übersichtsarbeit. Interessierte Leser seien auf die europäische Leitlinie zur Behandlung der Anaphylaxie bei Insektengiftallergie verwiesen (BONIFAZI F, et al., Prevention and treatment of hymenoptera venom allergy: Guidelines for clinical practice. Allergy 2005; 60, 1459-1470).
In den letzten Jahren hat sich die Bestimmung der Serumtryptase als wichtiger In-vitro-Parameter zur Dokumentation anaphylaktischer Ereignisse etabliert. Sie ist auch noch etliche Stunden nach einer Anaphylaxie erhöht und kann dann noch abgenommen werden. Das kann nützlich sein, um bei Fehlen objektiver Kriterien (Urtikaria, Angioödem, Blutdruckabfall > 30 mmHg) zweifelhafte Reaktionen von psychogenen Reaktionen (Angst) abzugrenzen. Der positive prädiktive Wert von Tryptase für die Diagnose einer Anaphylaxie liegt bei 92,6 %, der negative bei 54,3 %. Hohe basale Serumtryptase-Spiegel sind außerdem ein Hinweis für das Vorliegen einer Mastozytose.
Aufarbeitung anamnestischer UAW
Nicht abgeklärte UAW führen zur Verschreibung weniger effizienter oder teurerer Alternativtherapien. Deshalb empfehlen europäische und amerikanische Leitlinien allergologischer Fachgesellschaften die Aufarbeitung solcher Ereignisse. Alle Leitlinien folgen einem ähnlichen Schema. Wie oben erwähnt, sollte die Aufarbeitung 6 Wochen bis 6 Monate nach dem Ereignis durch einen Spezialisten erfolgen.
Anamnese
Am wichtigsten ist zunächst eine ausführliche Anamnese. Durch diese ist bereits zu entscheiden, ob es sich um eine Typ-A- oder -B-Reaktion (Tab. 1) handelt. Nur Typ-B-Reaktionen, die durch eine individuelle Disposition des Patienten bedingt sind, stellen eine Indikation zur weiteren Abklärung dar, z. B. keine Abklärung nach einer Überdosierung von Digitalis und gleichzeitiger Niereninsuffizienz. Wichtig ist die eindeutige Identifikation des verdächtigten Medikaments, z. B. „Amoxicillin“ statt „Antibiotikum“ auf der Zuweisung. Generelle Hinweise zur Zuweisung an den Spezialisten zur Aufarbeitung einer UAW finden sich in Tabelle 5.
Obwohl die Anamnese der Startpunkt ist, ist ihre Aussagekraft für den Ausgang der weiterführenden Testung schlecht. Aus diesem Grund soll an dieser Stelle vor der Ausstellung von Allergiepässen allein aufgrund anamnestischer Angaben durch den Nicht-Spezialisten gewarnt werden. Sie stigmatisieren den Patienten und schränken seine zukünftige Pharmakotherapie ein.
Hauttests
Hauttests folgen der Anamnese. Leider gibt es nur für manche β-Laktam-Antibiotika kommerzielle Hauttests. Die meisten Leitlinien für die Durchführung von Hauttests leiten sich demnach von den Empfehlungen für Hauttestungen mit β-Laktamen ab. Je nach Art der berichteten UAW werden unterschiedliche Hauttestverfahren ausgewählt. Grundsätzlich gibt es 4 Arten von Hauttests:
- Beim „Skin Prick Test“ wird das Medikament in flüssiger Form (nur möglich, wenn i.v.-verabreichbare Applikationsformen erhältlich sind) auf die Haut aufgebracht und die Haut danach angeritzt.
- Beim Intrakutantest wird das Arzneimittel in verdünnter Form unter die Haut gespritzt.
- Falls das Medikament nicht in i.v.-Form im Handel erhältlich ist, führen manche Zentren „Scratch-Tests“ durch, bei denen das im Mörser zerriebene Medikament auf die Haut aufgebracht wird. Aufgrund ihres hohen irritativen Potenzials und der geringen Aussagekraft lehnen manche Spezialis ten diese Form der Testung jedoch ab, was dann aber gleichzeitig bedeutet, dass etliche Arzneimittel nicht testbar sind, falls sie nicht in i.v.-Form im Handel sind.
- Beim Epikutantest wird das Arzneimittel in Vaseline oder Wasser gelöst oder zerstampft unter einem Pflaster für 24–48 Stunden auf die Haut appliziert.
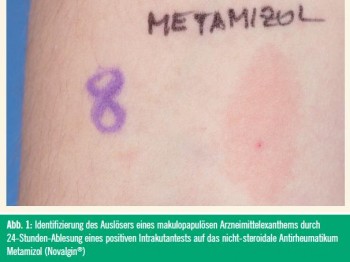
Hauttests werden für Typ-I-Reaktionen früh (nach 15–20 Minuten) abgelesen, für Spättypreaktionen im Normalfall nach 24–72 Stunden, obwohl hier keine einheitlichen Standards existieren (Abb. 1).
Eine Anamnese einer schweren Haut-UAW (AGEP/EEM/SJS/DRESS; siehe oben) stellt eine Kontraindikation gegen Austestungen dar, weil durch Haut- und Expositionstests eventuell noch einmal eine Reaktion erzeugt werden kann, für die es im Gegensatz zu Typ-I-Reaktionen keine spezifische Therapie gibt. Optional können in Einzelfällen Epikutantests durchgeführt werden.
Jeder Hauttest beinhaltet ein sehr geringes Risiko, den Patienten zu sensibilisieren, also erst zum Medikamentenallergiker zu machen. Unnötige Tests sollten deshalb vermieden werden.
In-vitro-Tests
Gute, validierte In-vitro-Tests für die Routineabklärung existieren leider nur für Typ-IReaktionen auf β-Laktam-Antibiotika. Für alle anderen Medikamente stehen nur experimentelle Systeme zur Verfügung, z. B. Lymphozytentransformationstests bei Typ-IV-Reaktionen.
Provokationstests
Bleibt die Abklärung bis zu diesem Zeitpunkt unschlüssig, sehen oben genannte Leitlinien die Durchführung von Provokationstests vor. Diese werden an spezialisierten Einheiten durchgeführt. Provokationstests gelten als „goldener Standard“ in der Abklärung von UAW. Obwohl Provokationstests in einem ethischen Graubereich liegen, wird im Allgemeinen der Erkenntnisgewinn aus dem Test als das für den Patienten höhere Gut angesehen als das mit dem Test verbundene, normalerweise geringe Risiko.
Provokationstests beginnen mit einer kleinen Dosis des verdächtigen Medikaments, die allmählich bis zum Erreichen einer normalen Tagesdosis gesteigert wird. Reagiert der Patient gleich wie bei der UAW (im Normalfall aufgrund der geringeren Gesamtdosis aber schwächer), so gilt der Zusammenhang zwischen Einnahme des Arzneimittels und der UAW als bewiesen. Wird das Arzneimittel ohne Nebenwirkungen vertragen, so gilt ein Zusammenhang zwischen Einnahme des Arzneimittels und der UAW als ausgeschlossen und das Arzneimittel kann in Zukunft wieder eingenommen werden. Wichtig ist, dass diese Aussagen nur für den Zeitpunkt der Provokationstestung gelten. Eine eventuelle zukünftige (er)neu(t)e Sensibilisierung ist natürlich nicht ausgeschlossen.
Die Art der Überwachung bei der Durchführung von Provokationstests hängt von der Klinik der UAW ab. Soforttypreaktionen (Typ I) bedürfen einer intensiveren (stationären) Überwachung als Spättypreaktionen (Typ IV), bei denen eine nicht so intensive Überwachungspflicht besteht.
Das Ergebnis der Austestung soll dem Patienten schriftlich mitgegeben werden. Das Ausstellen eines Allergiepasses hat sich hier bewährt, weil dieser vom Patienten jederzeit leicht mitgeführt werden kann. Wichtig ist es, zu verstehen, dass Provokationstestungen prinzipiell nicht die Pathophysiologie hinter einer UAW abklären helfen (z. B. Typ-I-Allergie oder Hypersensitivitätsreaktion), sondern die Kausalität zwischen Einnahme eines Medikaments und einer UAW herstellen und dem Patienten die Frage beantworten: „Darf ich dieses Medikament in Zukunft wieder einnehmen?“
Provokationstestungen können bei ängstlichen Patienten auch mit Alternativmedikamenten durchgeführt werden, um dem Patienten die Verträglichkeit dieser Medikamente zu demonstrieren.
Differentialdiagnosen zu UAW
Vermeintliche UAW nach der Gabe eines Medikaments können auch andere Ursachen haben. So sind infektassoziierte Urtikaria und/oder Angioödem die wichtigsten Differentialdiagnosen bei gleichzeitiger Antibiotikagabe wegen akuten Infekten. Auch sind, wie oben erwähnt, Angstreaktionen oder vasovagale Synkopen wichtige Differentialdiagnosen. Wie im Kapitel „Anaphylaxie“ erläutert, kann die Abnahme von Serumtryptase während oder kurz nach dem Akutereignis bei der Objektivierung einer anaphylaktoiden Reaktionsform helfen. Toxische UAW durch relative Überdosierung bei Nieren- oder Leberinsuffizienz sind besonders bei älteren Patienten wichtige Differentialdiagnosen.
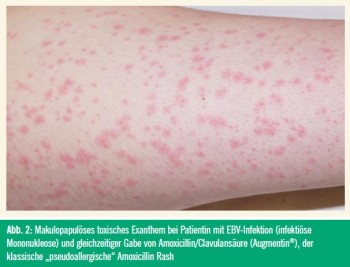
Bei Typ-IV-Reaktionen sind virale Exantheme häufige sowie andere Dermatosen seltenere Differentialdiagnosen.
Zusammenfassung
Bevor ein Patient zur Abklärung nach einer UAW auf ein Arzneimittel einem Spezialisten zugewiesen wird, sollten die in Tabelle 5 angeführten Fragen durchgegangen werden. Die klinische Aufarbeitung einer UAW soll für den Patienten zu einer klaren Antwort auf die wesentliche Frage führen: „Welche Medikamente kann ich in Zukunft verwenden?“. Anders ausgedrückt, kann man auch sagen, dass die Abklärung von UAW zum Optimieren der individuellen Pharmakotherapie des Patienten führen soll.
Eckpfeiler der Aufarbeitung sind Anamnese, Hauttest sowie in ausgewählten Fällen Provokationstests und dienen der Identifizierung des Auslösers der UAW. In-vitro-Tests sind nur für wenige Arzneimittel für die Routinetestung verfügbar. Alle Testergebnisse sollen dem Patienten in schriftlicher Form mitgeteilt werden. Üblicherweise werden dazu Allergiepässe ausgehändigt. Diese sollten auch Informationen über sichere Therapiealternativen enthalten. Gut vertragene Alternativmedikationen haben hohen didaktischen Wert bei ängstlichen Patienten und erhöhen dessen Lebensqualität.
„Verdachtsallergiepässe“ (siehe auch Kapitel „Differentialdiagnosen zu UAW“) behindern die zukünftige Pharmakotherapie des Patienten. Besteht trotzdem die Notwendigkeit, einen Verdachtsallergiepass auszustellen, sollte das im Pass klar ersichtlich sein. Solch ein Vorgehen wird nur in Einzelfällen notwendig sein, sollte aber auf Hochrisikosituationen beschränkt bleiben (z. B. nach Anaphylaxien oder schweren Hautreaktionen).
Literatur beim Verfasser
Lecture Board: Mitglieder des Beirats der Arbeitsgruppe Allergologie der ÖGDV:
- Univ.-Prof. Dr. Werner Aberer, Universitätsklinik für Dermatologie, Abteilung für Umweltdermatologie, Medizinische Universität Graz
- Ass.-Prof. Dr. Tamar Kinaciyan, Universitätsklinik für Dermatologie, Abteilung für Immundermatologie und infektiöse Hautkrankheiten, Medizinische Universität Wien
- Univ.-Prof. Dr. Norbert Reider, Universitätsklinik für Dermatologie und Venerologie, Medizinische Universität Innsbruck