Antinukleäre Antikörper (ANA)
Der Nachweis der Existenz von ANA geht auf das erstmals durch Hargraves et al. 1948 beschriebene LE-Zellphänomen der Phagozytose von intaktem Kernmaterial durch polymorphe Leukozyten zurück.7 Später, 1957, folgte die Identifizierung der ANA und Anti-DNAAntikörper.8
ANA stellen ein mit verschiedenen Labormethoden (z. B. indirekte Immunfluoreszenz, ELISA) bestimmbares Epiphänomen bei Autoimmunprozessen dar. Ein gestörter Ablauf der Apoptose und eine verzögerte Phagozytose von Zellfragmenten bzw. apoptotischen Partikeln werden als mögliche endogene Ursache in der Entstehung von ANA gesehen. Während der Apoptose werden durch Endonukleasen Nukleosomen als wichtiger Chromatinbestandteil freigelegt, sodass zuvor maskierte Autoantigene nun als Zielantigene der ANA vorliegen.9 Zielantigene der ANA sind vor allem Bestandteile des Zellkerns, z. B. Nukleinsäuren, Enzyme des Nukleinsäurestoffwechsels, Kernproteine, Spindelapparat und Zentriolen, sie können sich aber auch gegen Bestandteile des Zytoplasmas (Ribosomen, Mitochondrien) richten.2
Exogene Faktoren wie z.B. Noxen, Medikamente und UV-Licht beeinflussen die Entstehung von Autoimmunphänomenen ebenfalls durch die Induktion von Apoptose, da beispielsweise bei Zerfall UV-Licht-geschädigter Keratinozyten Zellkernmaterial freigelegt wird.1, 2, 10, 11
Bestimmung von ANA: Methodik
Indirekte Immunfluoreszenz: Als Screening-Methode für ANA hat sich die indirekte Immunfluoreszenz auf humanen Kulturzellplatten (HEp-2-Zellen) etabliert. Diese HEp-2-Zellen (Human Epithelioma Type 2 Cells) stammen von einem epithelialen Larynxkarzinom ab. Als immortalisierte Zellen wachsen sie als Monolayer auf Objekträgern.12 Die Hep-2-Kultur enthält somit Zellen in der Ruhephase und in unterschiedlichen Mitosephasen. Aufgrund der verschiedenen Zellstadien können die unterschiedlichen Fluoreszenzmuster der ANA leicht erkannt und Antikörper gegen chromosomale Antigene (z. B. nDNA, Centromere, Histone) oder gegen nicht-chromosomale Antigene (z. B. Sm-Antigen, Ribonukleoprotein – RNP) mittels der Fluoreszenzfärbung der Chromosomen bestimmt werden.
Für eine semiquantitative ANA-Bestimmung muss die Serumprobe entsprechend verdünnt werden.13 Bei der Fluoreszenzmikroskopie wird dann die Leuchtintensität aufsteigender ANA-Titer-Serumproben auf den HEp-2-Zell-Platten beurteilt, mit Referenzbildern verglichen und somit der ANA-Titer der Serumprobe bestimmt. Dieser Schritt der Untersuchung ist stark vom Wissen und von der Erfahrung des Beurteilers abhängig. Eine Titer-Stufe höher/tiefer zu etwaigen Vorbefunden kann daher untersucherabhängig sein und muss in Kauf genommen werden.26
Weiters wird die Leuchtintensität, welche der Bindungsreaktion der Fluoreszinkonjugierten ANA mit dem HEp-2-Subs – trat entspricht, abgelesen und anhand von Referenzbildern beurteilt. Den unterschiedlichen Fluoreszenzmustern kann ein klinisches Korrelat zugeordnet werden. Das Ergebnis wird in Verdünnungsstufen (Titer-Stufen) und unter Angabe des Fluoreszenzmusters angegeben.
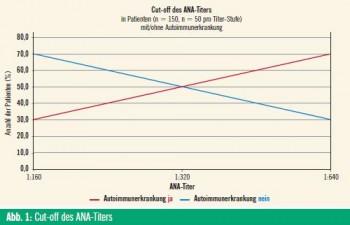
Diese Methode ist, wie bereits erwähnt, untersucherabhängig, weshalb der ANANachweis mittels automatisierter Durchführung von ELISA von manchen favorisiert wird. Um eine bestmögliche Qualität zu gewährleisten, wird die Durchführung von Rundversuchen gefordert und auch die Bestimmung des laboreigenen Richtwerts (Cut-off) für positive Befunde empfohlen. Eigene Untersuchungen des Immunologielabors der Hautklinik Innsbruck für die ANA-Bestimmung auf HEp-2-Zellen zeigen diesen bei einem ANA-Titer von 1:320, d.h. bei der Hälfte der Patienten mit einem ANA-Titer von 1:320 liegt auch eine Autoimmunerkrankung vor26, wie im Diagramm (Abb. 1) dargestellt.
ELISA: Die Bestimmung von ANA-Subtypen und der Zielantigene erfolgt mit ELISA-Testsystemen und mit gereinigten Antigenen durch Immunoassays, Gelpräzipitation oder Western Blots.2
Epidemiologie von ANA, Interpretation von ANA-Befunden
Positiver ANA-Befund
Ein positiver ANA-Befund kann bei systemischen, aber auch organspezifischen Autoimmunerkrankungen, weiters auch im Rahmen von Infektionserkrankungen (z. B. infektiöse Mononukleose, chronische Hepatitis C, HIV-Infektion und Infektion mit Mycobacterium tuberculosis14–16), Neoplasien17–21 sowie mit zunehmendem Alter auch bei Gesunden, insbesondere Frauen, nachgewiesen werden.2
ANA werden in der Literatur in 4–7 %22–24 bei Gesunden beschrieben. Craig et al.22 fanden bei weiblichen Blutspendern gegenüber männlichen leicht erhöhte ANATiter.
Epidemiologische Daten – Tirol: Im Rahmen einer epidemiologischen Studie in Tirol wurden die im Jahr 2007 erhobenen ANA-Befunde evaluiert und eine Prävalenz für positive ANA bei 3,37 % der Tiroler Bevölkerung nachgewiesen.25 Es bestätigte sich zudem ein häufigeres Auftreten von ANA bei Frauen als bei Männern, wie in der Literatur beschrieben. 25, 2 Auch zeigten eigene Daten bei Frauen eine mehr als fünffach erhöhte Rate an Autoimmunerkrankungen.26 Eine Multicenter-Studie23 bei Gesunden weist in 31,7 % einen ANA-Titer > 1:40 nach. Niedrige ANA-Titer bis zu 1:160 sind zumeist unspezifisch und somit nicht von diagnostischer Relevanz.22–26 Ein ANA-Titer von 1:160 ist jedoch bei jungen Frauen, wie eigene Daten zeigen, ernst zu nehmen.
Auch ist die Aussagekraft hochtitriger ANA ohne klinische Korrelation gering, wenngleich bei Frauen mit ansteigender Titer-Stufe das Vorliegen einer Autoimmunerkrankung fast linear zunimmt.26
ANA-Anstieg: Die Beurteilung einer möglichen Entwicklung einer Kollagenose bei klinisch Gesunden bleibt daher mittels Bestimmung von ANA schwierig, obschon ein positiver ANA-Test der klinischen Manifestation eines SLE viele Jahre vorangehen kann.1 Klinisch relevant sind somit Bewegungen von zwei Stufen des ANA-Titers bei Patienten mit bereits bekanntem Ausgangsbefund. ANA-Titer-Veränderungen von zwei Stufen können bei einem Anstieg die klinisch relevante Manifestation einer Autoimmunerkrankung oder ein erneutes Aufflammen einer solchen bedeuten. Eine Verringerung des ANA-Titers kann hingegen auf eine reduzierte Krankheitsaktivität oder auf das Ansprechen auf die eingeleitete Therapie hinweisen.23
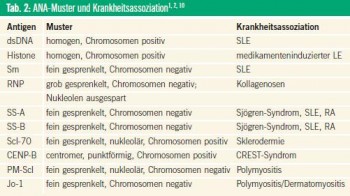
ANA können daher als laborchemische Eckpfeiler bei Patienten mit systemischen Autoimmunerkrankungen gesehen werden. Sie unterstützen die präzise Diagnostik und mögliche Prognose von systemischen Autoimmunerkrankungen, insbesondere bei Patienten mit nur geringen klinischen Symptomen oder mit klinischen Aspekten von mehreren Autoimmunerkrankungen27, auch wenn die Spezifität von ANA für eine spezifische, systemische Autoimmunerkrankung unterschiedlich ist, wie Tabelle 1 zeigt.
Spezifische ANA-Muster
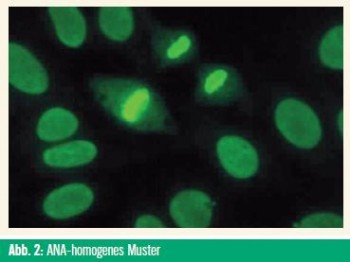
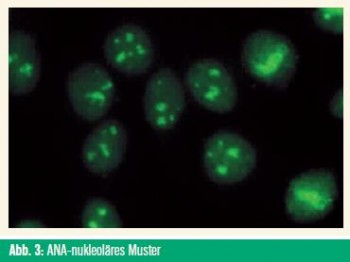
ANA, insbesondere ihre spezifischen Muster und Untergruppen (Abb. 3), können Informationen über eine mögliche Organbeteiligung bei entzündlichen Systemerkrankungen liefern.28 Die unterschiedlichen ANA-Subtypen sind durch ihr jeweiliges Zielantigen definiert, wie Doppelstrang-DNA, Histone, andere Zellkernproteine und RNA-Protein-Komplexe (z. B. U1-RNP, Anti-Sm, Ro/SS-A, La/SSB, Scl-70).
Wie bereits erwähnt, sind ANA gelegentlich auch bei organspezifischen Autoimmunerkrankungen wie Hashimoto-Thyreoiditis (46 %), M. Basedow (50 %), Autoimmunhepatitis (63–91 %), primär biliärer Zirrhose (10–40 %) und primärer Autoimmuncholangitis (bis 100 %) nachweisbar. 6, 29–33
Negativer ANA-Befund
Bei Vorliegen eines negativen ANA-Tests können systemische, entzündliche Erkrankungen wie SLE, Sjögren-Syndrom, systemische Sklerodermie und Mischkollagenosen in der Regel ausgeschlossen werden. Bei klinischem Verdacht eines vorliegenden SLE und negativem ANABefund wird zur weiterführenden Diagnostik die Bestimmung von Antikörpern gegen Ro/SS-A, Phospholipide und Ribosomen empfohlen.34
Klinische Anwendung der ANA-Bestimmung
Richtlinien zur klinischen Anwendung der Bestimmung von ANA sind etabliert.3, 35 Die Bestimmung von ANA wird empfohlen36
- bei klinischen Beschwerden, vereinbar mit Autoimmunerkrankungen, Kollagenosen;
- zum Ausschluss oben genannter Erkrankungen bei Patienten mit nur geringen und/oder unklaren klinischen Beschwerden;
- zur Klassifikation der bereits diagnostizierten Autoimmunerkrankung oder Kollagenose;
- als Verlaufskontrolle der Krankheitsaktivität (z. B. dsDNA-Antikörper bei Lupus-Nephritis).37
Ein positiver ANA-Befund erweist sich in der Diagnostik des SLE, der systemischen Sklerodermie und des Sjögren-Syndroms als sehr hilfreich.1
In nahezu 100 % der Fälle sind ANA zudem bei Mischkollagenosen, medikamenteninduziertem SLE und Autoimmunhepatitis nachweisbar.
Allgemein stellen ANA einen Marker für oben genannte Erkrankungen dar und eignen sich nur bedingt als Verlaufsparameter hinsichtlich Prognose und Krankheitsaktivität.
Die Bestimmung von ANA bei Patienten mit der Verdachtsdiagnose einer Autoimmunerkrankung gilt als aussagekräftige Laboruntersuchung.
1 Puchner R. Rheumatologie aus der Praxis. Springer Wien, 2010
2 Fritsch P. Dermatologie und Venerologie, Lehrbuch und Atlas. Springer – verlag, Berlin-Heidelberg, 2nd Edn. 2004, S. 479-517
3 Shoenfeld Y, Gershwin ME, Meronii PE (Eds.). Autoantibodies. 2nd Edn. Elsevier, Amsterdam, 2007
4 Reichlin M, Arnett FC Jr., Multiplicity of antibodies in myositis sera. Arthritis Rheum 1984; 27: 1150
5 Rosenberg AM. The clinical associations of antinuclear antibodies in juvenile rheumatoid arthritis. Clin Immunol Immunopathol 1988; 49: 19
6 Solomon DH, Kavanaugh AJ, Schur PH. American College of Rheumatology ad hoc Committee on Immunologic Testing Guidelines. Evidence-based guidelines for the use of immunologic tests: Antinuclear antibody testing. Arthritis Rheum 2002; 47: 434
7 Hargraves MM, Richmond H, Morton R. Presentation of two bone-marrow elements: The Tart cell and LE cell. Proc Staff Meetings maxo Clin; 23: 25, 1948. Zitiert in Lahita RG, Systemic lupus erythematosus. 3rd Edn. 1999, Academic Press, San Diego. Kap. 9
8 Holborow EJ, Weir DM, Johnson GD. A serum factor in lupus erythematosus with affinity for tissue nuclei. Br Med J 1957; 2732. Zitiert in: Lahita RG, Systemic lupus erythematosus. 3rd Edn. 1999, Academic Press, San Diego. Kap. 9
9 Lorenz HM. The pathogenesis of autoimmune diseases. Scand J Clin Lab Invest 2001; 61 (Suppl 235): 16-26
10 Lahita RG. Systemic lupus erythematosus. 3rd Edn. 1999, Academic Press, San Diego. Kap. 1
11 McHugh NJ. Systemic lupus erythematosus and dysregulated apoptosis – what is the evidence? Rheumatology 2002; 41: 242-245
12 Bradwell AR, Stokes RP, Johnason GD. Atlas of HEp-2-patterns. The Binding Site, England, 1995
13 Kallestad Diagnostica. Produktinformation zu Quantafluor ANA-Immunfluoreszenztest – Human-Epithel (HEp-2)-Zellkultur-Substrat, ANA- 00/10/83, US/4/82
14 Kaplan ME, Tan EM. Antinuclear antibodies in infectious mononucleosis. Lancet 1968; 1: 561
15 Clifford BD, Donahue D, Smith L, et al., High prevalence of serological markers of autoimmunity in patients with chronic hepatitis C. Hepatology 1995; 21: 613
16 Bonnet F, Pineau JJ, Taupin JL, et al., Prevalence of cryoglobulinemia and serological markers of autoimmunity in human immunodeficiency virus infected individuals: A cross-sectional study of 97 patients. J Rheumatol 2003; 30: 2005
17 Burnham TK. Antinuclear antibodies in patients with malignancies. Lancet 1972; 2: 436 18 Guyomard S, Salles G, Coudurier M, et al., Prevalence and pattern of antinuclear autoantibodies in 347 patients with non-Hodgkin’s lymphoma. Br J Haematol 2003; 123: 90 19 Imai H, Ochs RL, Kiyosavwa K, Furuta S, Nakamura RM, Tan EM. Nucleolar antigens and autoantibodies in hepatocellular carcinoma and other malignancies. Am J Pathol 1992 Apr; 140(4): 859-70
20 Covini G, Von Mühlen CA, Pacchetti S, Colombo M, Chan EKL, Tan EM. Diversity of antinuclear antibody responses in hepatocellular carcinoma. J of Hepatology 1997; 26: 1255-1265
21 Thomas PJ, Kaur JS, Aitcheson CT, Robinson WA, Tan EM. Antinuclear, antinucleolar, and anticytoplasmatic antibodies in patients with malignant melanoma. Cancer Res Mar; 43(3): 1372-80, 1983
22 Craig WY, Ledue TB, Johnson AM, Ritchie RF. The distribution of antinuclear antibody titers in „normal“ children and adults. J Rheumatol 1999; 26: 4: 914-919
23 Tan EM, Feltkamp TEW, Smolen JS, et al., Range of antinuclear antibodies in „healthy“ individuals. Arthritis Rheum 1997; 40, 1601-1611
24 Forslid J, Heigl Z, Jonsson J, Scheynius A. The prevalence of antinuclear antibodies in healthy young persons and adults, comparing rat liver tissue sections with HEp-2 cells as antigen substrate. Clin Exp Rheumatol 1994; 12: 137-41
25 Scheurecker Ch, Sepp N. ANA in Tirol 2007. Manuscript in Preparation; Poster P49, Antinukleäre Antikörper (ANA) in Tirol 2007, Jahrestagung der österreichischen Gesellschaft für Dermatologie und Venerologie, 28.– 30. 11. 2008, Wien
26 Kaindl Ch. Signifikanz von antinukleären Antikörpern und deren Titer-Höhe in der Entwicklung von Autoimmunerkrankungen. 2002, Dissertation, Universität Innsbruck
27 Reichlin M. Diagnosis criteria and serology. In: Clinical Management of Systemic Lupus erythematosus. Schur PH (Ed.), Grune and Stratton, New York, 1983
28 Klippel JH, Stone JH, Crofford LJ, White PH. The primer on rheumatic diseases. 2nd Edn., Springer, London, 2010
29 Petri M, Karlson EW, Cooper DS, Ladenson PW. Autoantibody tests in autoimmune thyroid disease: A case-control study. J Rheumatol 1991; 18: 1529
30 Czaja AJ, Nishioka M, Morshed SA, Hachiya T. Patterns of nuclear immunofluorescence and reactivities to recombinant nuclear antigens in autoimmune hepatitis. Gastroenterology 1994; 107: 200
31 Dagenais A, Bibor-Hardy V, Senécal JL. A novel autoantibody causing a peripheral fluorescent antinuclear antibody pattern is specific for nuclear pore complexes. Arthritis Rheum 1988; 31: 1322
32 Taylor SL, Dean PJ, Riely CA. Primary autoimmune cholangitis. An alternative to antimitochondrial antibody-negative primary biliary cirrhosis. Am J Surg Pathol 1994; 18: 91 33 Rich S, Kieras K, Hart K, et al., Antinuclear antibodies in primary pulmonary hypertension. J Am Coll Cardiol 1986; 8: 1307
34 DGKC-Arbeitsgruppe „Autoimmundiagnostik“, www.autoimmundiagnostik.de
35 Hartung K, Seelig HP. Labordiagnostik der systemischen Autoimmunerkrankungen, Teil 1: Kollagenosen. Z Rheumatol 2006; 65: 709-724
36 Phan TG, Wong RC, Adelstein S. Autoantibodies to extractable nuclear antigens: Making detection and interpretation more meaningful. Clin Diagn Lab Immunol 2002; 9: 1
37 Hoffman IE, Peene I, Meheus L, et al., Specific antinuclear antibodies are associated with clinical features in systemic lupus erythematosus. Ann Rheum Dis 2004; 63: 1155-1158